Spectrale Reflectometric microscopie op Myelinated axonen In Situ
Summary
Hier presenteren we een stapsgewijze protocol voor imaging-myelinated axonen in een segment van de vaste hersenen met behulp van een label-vrije nanoschaal imaging techniek gebaseerd op spectrale reflectometrie.
Abstract
In een zoogdieren zenuwstelsel biedt myeline een elektrische isolatie door enwrapping de axon vezels in een spiraal van meerdere lagen. Geïnspireerd door haar zeer georganiseerde subcellular architectuur, ontwikkelden we onlangs een nieuwe beeldvorming modaliteit, spectrale reflectometrie (SpeRe), waarmee de ongekende label-vrije nanoschaal beeldvorming van de levende myelinated axonen in situgenoemd. Het onderliggende principe is nanostructural om informatie te verkrijgen door het analyseren van het spectrum van de reflectie van de meerdere lagen subcellular structuur. In dit artikel beschrijven we een gedetailleerde stapsgewijze protocol voor het uitvoeren van een basic SpeRe beeldvorming van de nerveus weefsels met behulp van een commerciële confocal microscopische systeem, uitgerust met een laser wit-licht en een afstembare filter. Wij behandelen de procedures voor de bereiding van de monsters, verwerving van spectrale gegevens en beeldverwerking voor het verkrijgen van nanostructural informatie.
Introduction
In de zoogdieren zenuwstelsel biedt myeline snelle zenuw geleiding en axonale integriteit door het enwrapping van de axon vezels met meerdere lagen membraanachtig omhulsels. Zijn meerdere lagen structuur bestaat uit afwisselende nanoschaal dun-films samengesteld uit plasma membranen (~ 5 nm), cytosol (~ 3 nm), en extracellulaire ruimte (~ 7 nm)1,2. Optische microscopie, met inbegrip van de recente Super resolutie microscopie, zijn niet geschikt voor het observeren van de nanoschaal myeline dynamiek als gevolg van hun onvoldoende resolutie als gevolg van optische diffractie3,4,5. Hoewel elektronenmicroscopie de fijne details van de myeline nanostructuur bieden kan, is het niet compatibel met de levende biologische systemen als gevolg van sterk invasieve staalvoorbereiding waarbij chemische fixatie en ultrasectioning6,7 . Tot voor kort, is er geen techniek toepassing op nanoschaal dynamiek van myelinated axonen in situte observeren.
Shain et al. eerder gemeld dat myelinated axonen kleurrijk licht reflectie8vertonen. Door het aannemen van de spectroscopische analyse van het gereflecteerde licht, hebben we een nieuwe beeldvorming modaliteit voor de nanoschaal beeldvorming van myelinated axonen, genaamd spectrale reflectometrie (SpeRe)9bedacht. SpeRe is gebaseerd op de inmenging van de dunne-film die zich voordoen in de multi-gelaagde structuur van de myelineschede (Figuur 1). Door middel van optische simulatie op verschillende axonen, we hebben aangetoond dat het spectrum van de reflectie een periodieke functie van golfgetal en de periodiciteit (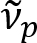 ) is omgekeerd evenredig met de diameter van de axon (d). Deze eenvoudige relatie (
) is omgekeerd evenredig met de diameter van de axon (d). Deze eenvoudige relatie (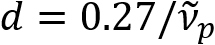 ) biedt facile kwantificering van axon diameter van de SpeRe gegevens. Gebruik makend van dit, onthuld wij het overwegend axon bolling onder licht traumatisch hersenletsel in onze voorafgaand verslag.
) biedt facile kwantificering van axon diameter van de SpeRe gegevens. Gebruik makend van dit, onthuld wij het overwegend axon bolling onder licht traumatisch hersenletsel in onze voorafgaand verslag.
Het SpeRe systeem is gebaseerd op confocale microscopie en bestaat uit een gespecialiseerde laserbron en filters (Figuur 2). De invoerbron is een wit-light laser, verstrekken van breedband spectrale uitgang voor infrarood regio’s zichtbaar. Voor de spectrale scan, het systeem is uitgerust met twee akoestisch-optische apparaten: een akoestisch-optische afstembare filter (AOTF) voor het leveren van een geselecteerde golflengte van de breedband ingangsbron en een akoestisch-optische balk splitter (AOBS) voor de geselecteerde begeleiden weerspiegeld golflengte naar de detector. De software voor hyperspectrale confocale microscopie biedt (Zie Tabel van materialen) een aanpasbare spectrale scan-optie om opeenvolgend verwerven de reflectiecoëfficiënt beelden bij verschillende input golflengten. Bovendien, kan chromatische aberratie kritisch mengen in de spectrale meting; Daarom wordt gebruik van een objectief apochromat aanbevolen.
Wit-licht lasers produceren een ongelijke spectrale vermogen van de nota, en de optische onderdelen ook invloed hebben op de spectrale profiel. Daarom moeten de verworven spectra worden gekalibreerd voor de verdere kwantitatieve analyse. Een beschermde zilveren spiegel wordt het meestal gebruikt als een verwijzing, waarin een bijna constante reflectie (> 97%) over de volledige zichtbare gebied. De verworven spectra worden vervolgens gedeeld door de spectra van de verwijzing van de spiegel.
De spectrale stap-grootte voor de spectrale scan bepaalt de snelheid van de overname; Dus, moet worden geoptimaliseerd. Aangezien een grotere axon een hogere spectrale periode heeft, vereist het fijnere spectrale bemonstering. Een axon met een diameter van 10 µm, een van de grootste fysiologische axonen, heeft bijvoorbeeld een spectrale periode van ~ 8 nm. Door Nyquist bemonstering criteria toe te passen we gebruikt de spectrale voorbeeldinterval van 4 nm ter dekking van alle fysiologische axonen in de muis nerveus weefsels. Deze aanpak meestal neemt enkele seconden voor een volledige spectrale scan en dus niet geschikt voor in vivo toepassingen, waar fysiologische beweging (b.v. ademhaling en hartslag) interfereert stabiele spectrale acquisitie. Wij eerder dit probleem opgelost door het implementeren van een aangepaste rechtop Microscoop, ontworpen om het volledige spectrum voor elk punt met behulp van een array spectrometer (overname snelheid ≈ 30 ms per pixel) verwerven.
In dit verslag, beschrijven we een gedetailleerd protocol op de imaging SpeRe op een vaste brain slice, die kan worden uitgevoerd in een commerciële hyperspectrale Microscoop (Zie Tabel van materialen). Aldus, kan het protocol worden uitgevoerd door onderzoekers zonder expertise in optische instrumentatie. Wij behandelen ook de mogelijke problemen en probleemoplossing voor overname en analyseren van SpeRe gegevens.
Protocol
Representative Results
Discussion
SpeRe is een nieuwe label-vrije imaging modaliteit op basis van spectrale interferometrie, die voor het eerst biedt de nanoschaal informatie in levende myelinated axonen. In het huidige protocol voor de verwerving, de ruimtelijke resolutie voor de axon diameter is in de orde van 10 nm. Bovendien SpeRe maakt gebruik van de ordes van grootte lager lichte dosis in vergelijking met andere super resolutie microscopies; het is dus vrij van fototoxiciteit en photobleaching. SpeRe zou voorzien in een nieuwe laan studeren nanosch…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd gesteund door het Institute of Basic Science (IBS-R015-D1) en door fundamentele wetenschap Research Program via de nationale onderzoek Stichting van Korea (NRF) gefinancierd door het ministerie van onderwijs (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

