人間のサブタイプに固有の光の活動電位記録誘導多能性幹細胞由来の心室心筋細胞
Summary
ここで具体的には心室のような誘導多能性幹細胞由来心筋細胞イメージ活動電位光学的方法を提案する.メソッドは、電位感受性蛍光タンパク質のプロモーターに駆動される式に基づいています。
Abstract
ひと誘導多能性幹細胞 (iPSC CMs) から生成された心筋細胞、循環器病研究に新たなツールです。均一な細胞集団ではなく、現在の差別化プロトコルによって生成された iPSC CMs 心室細胞の混合物を表す-心房、-、およびリンパ節のような表現型表現型解析を複雑にします。ここでは、心室のような iPSC CMs から具体的に活動電位の光学的記録の方法が表示されます。これは、遺伝子にコードされた電圧インジケーターが心室固有プロモーター要素の制御の下で、構成要素にレンチ ウイルス伝達によって達成されます。IPSC CMs は、この構造体の導入は、電圧センサー、心室のような細胞でのみ表されます、タイムラプス蛍光顕微鏡を用いたサブタイプ特異光学膜潜在的な録音を有効にします。
Introduction
心筋 (CMs) 由来の誘導多能性幹細胞 (Ips) が解剖心臓副作用効果1,2 の分子機構新規治療法を調査するため、心臓病や画面にする新たなツール、3。スタートから右 channelopathies などの不整脈疾患はこの研究領域4の重要な焦点をされています。その結果、不整脈や活動電位 (AP) 形態の変化など、CMs の電気の表現型を調べる方法は、この技術の中心。
IPSC CMs のアプリケーションの重要な考察は現在心筋分化誘導方法が同種の細胞の人口で起因しません。洞結節、心房に似た細胞と成熟5,6,7,8のさまざまなレベルでの心室の CMs の混合物ではなくされます。この不均一性は、関連するソースをすることができます実験的変動の AP 持続時間 (APD) などのパラメーターを検討した場合に特に本質的に異なる CM サブタイプ間 (例えばAPD は短いよりも心室の CMs で心房)。この問題に対処するための従来のアプローチはパッチ クランプ法を用いた単一 iPSC CMs を調査し、節として各セルを分類する-心房、-、または心室のように、その AP 形態9に基づいて。任意の後続の分析は興味の CM のサブタイプを表すセルにし、制限できます。この方法の主な欠点は、その限られたスループットとスケーラビリティの欠如です。また、パッチ クランプ電気生理学の侵襲的な性質は、長期にわたる連続同じ細胞のイメージングを許可しません。
ここでは、光学的 iPSC CMs の特定のサブタイプの APs をイメージする開発方法10実験の詳細を提供します。これはサブタイプの不均一性の問題を克服し、iPSC CMs の遺伝的変異を運ぶまたは薬理学的にさらされるエージェントの急速な表現をできるように、従来の方法と比較してスループットが大幅に増加します。
サブタイプに固有の光イメージング手法の概要
その蛍光特性を脱分極および細胞膜の再分極時に変更、遺伝子にコードされた電圧インジケーター (GEVI) を使用して、CMs の膜電位の変化を光学的にイメージします。ここに適用 GEVI は電圧検出蛍光タンパク質 VSFP CR11緑 (クローバー) と赤 (mRuby2) 蛍光タンパク質 (図 1 a) のペアに融合した電圧感知の膜貫通ドメインから成っています。2 つの同時の近くのため緑色蛍光タンパクの励起は、赤の蛍光タンパク質を介して蛍光共鳴エネルギー移動 (FRET) に転送されている励起エネルギーの一部の結果します。したがって、緑色蛍光タンパクの励起は、緑、赤の蛍光タンパク質 (図 1 a、上部のパネル) からの排出量の結果します。細胞は脱分極、FRET 効率を高める 2 つの蛍光タンパク質の向きかえに変換する電圧センサーの構造転位が発生します。したがって、励起エネルギーのさらに転送されます、緑から赤色けい光たんぱく質 (図 1 a、下部のパネル)。その結果、脱分極のセルに緑の蛍光性の放出は、調光器と赤い蛍光性の放出は、安静時の膜電位 (図 1 b) セルよりも明るい。
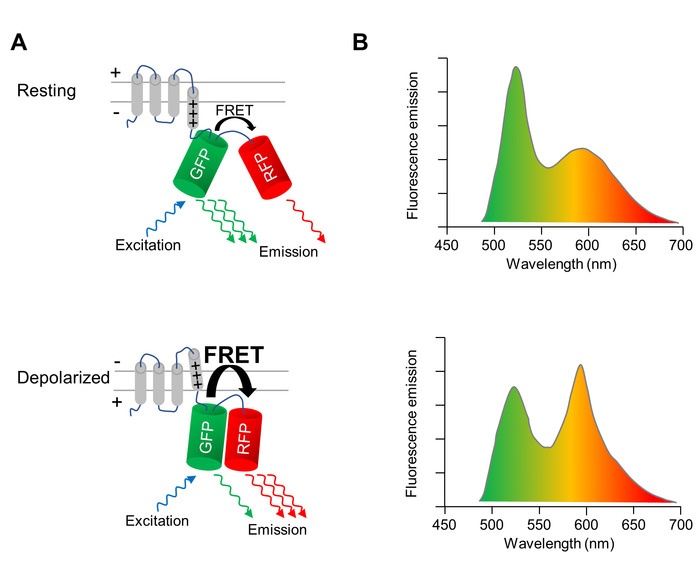
図 1: 膜電位 VSFP 単位での光イメージング(A) A の回路図 VSFP CR を示す電位感受性蛍光タンパク質のアクションを描いたします。細胞膜の脱分極時に電圧センサーの膜貫通ドメインの構造転位変換緑 (GFP) と赤 (RFP) 蛍光蛋白質、分子の蛍光を効率の向きかえ共鳴エネルギー移動 (FRET)。(B) 排出量の静止膜電位 (上部パネル) 細胞および脱分極細胞 (下段) GFP 励起による VSFP のスペクトルが描かれています。脱分極時にスペクトルの変化がわかりやすくするために誇張されています。この図の拡大版を表示するのにはここをクリックしてください。
膜電位の変動をミラーリング FRET 効率の変化、赤と緑の蛍光放出を分離し、2 つの隣接する領域に投影する画像分割を搭載した蛍光顕微鏡を使ってイメージ化します。sCMOS カメラ (図 2) のチップ。このセットアップで、2 つの異なる波長の蛍光性の放出を記録できます同時に、膜電位コマ撮りシリーズのすべてのイメージを反映するように赤と緑の蛍光性の比率の計算が可能します。
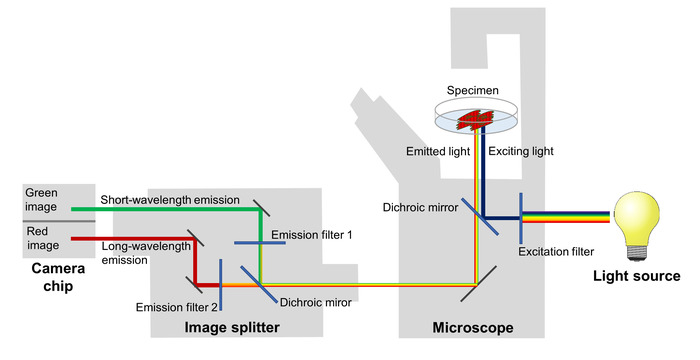
図 2: イメージング システムの構成します。イメージング システムの主要なコンポーネントは、高時間分解能で膜電位変化をミラーリング電位感受性蛍光タンパク質のスペクトルの変化が描かれている画像に使用されます。この図の拡大版を表示するのにはここをクリックしてください。
CMs の VSFP CR の式は、レンチ ウイルス伝達によって実現されます。CM のサブタイプに興味の表現を直接に、レンチ ウイルスには特に心室のような iPSC CMs10で転写をドライブ プロモーター要素 ( MLC2vエンハンサー) が含まれています。心房のような節のようなおよび心室のような細胞の混合物を表す iPSC CMs はこのレンチ ウイルスで導入した、VSFP CR が心室のような細胞のみで表現されます。この蛍光センサーに依存する光の活動電位イメージング、記録された活動電位は排他的関心 (図 3) の CM のサブタイプを表します。
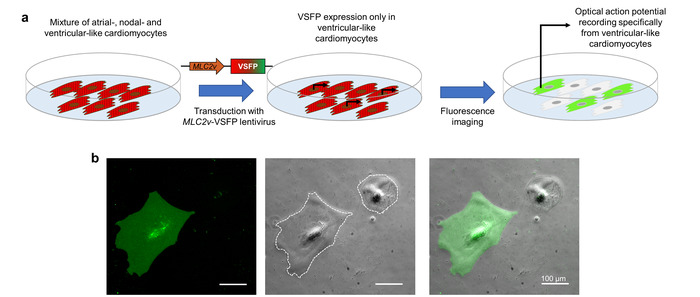
図 3: サブタイプに固有の膜電位イメージングのための VSFP のプロモーターに駆動される式。(、) この回路図は、心筋細胞サブタイプに固有の光の活動電位記録を実現する方法を示しています。(b) iPSC-CMs 心室固有 MLC2v エンハンサーの制御の下で VSFP に感染しているが表示されます。電圧センサーの表現は、GFP チャネル (左側のパネル) の心室のような CMs でだけ観察されます。位相コントラスト (中央のパネル) とオーバーレイ イメージ (右側のパネル) が備わっています。白の点線は、セルの境界をマークします。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
ここで説明したメソッドは、ヒトの Ips から生成された CMs の特定のサブタイプ (すなわちのような心室細胞) から APs の光学的記録をできます。人間 iPSC CMs は、巨大な様々 な生物や医療の問題に対処するための新たなツールと CM サブタイプごとに分化実験的変動の重要な源であります。特異的プロモーターの要素を使用して、GEVI の式は特に光学的イメージがその後の関心のサブタイ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この作品は、ドイツ研究振興協会 (Si 1747/1-1)、他の Kröner フレゼニウス財団、ドイツ財団 für Herzforschung からの補助金によって支えられました。
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
References
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

