Enregistrements de potentiel d’Action optique sous-type spécifique dans l’homme induit pluripotentes cellules souches dérivées des Cardiomyocytes ventriculaires
Summary
Nous présentons une méthode pour image optiquement les potentiels d’action, plus précisément dans les cardiomyocytes de cellules souches dérivées ventriculaire comme pluripotentes induites. La méthode est basée sur l’expression pilotée par le promoteur d’une protéine fluorescente sensibles au voltage.
Abstract
Cardiomyocytes générés à partir des cellules souches humaines pluripotentes induites (iPSC-CMs) sont des outils émergents en recherche cardiovasculaire. Plutôt que d’être une population homogène de cellules, l’iPSC-CMs générés par des protocoles de différenciation actuels représentent un mélange de cellules avec ventriculaire-, auriculaire-et phénotypes nodal-like, qui complique les analyses phénotypiques. Ici, une méthode aux potentiels d’action optiquement Records spécifiquement des ventriculaire type iPSC-CMs est présentée. Ceci est réalisé par transduction des gènes avec une construction dans laquelle un détecteur de tension codé génétiquement est sous le contrôle d’un élément promoteur ventriculaire spécifique. Lorsque iPSC-CMs sont transduites avec cette construction, le capteur de tension est exprimé exclusivement dans les cellules ventriculaires-like, ce qui permet des enregistrements de potentiel membranaire optique sous-type spécifique à l’aide de la microscopie en fluorescence Time-lapse.
Introduction
Cardiomyocytes (CMs) dérivés des cellules souches pluripotentes induites (CISP) sont un outil émergent à décortiquer les mécanismes moléculaires des maladies cardiaques, d’enquêter sur nouveaux traitements et à l’écran pour cardiaques indésirables effets1,2 ,3. Dès le début, arythmogène maladies tels que les canalopathies ont été un objectif important de ce domaine de recherche4. Par conséquent, les méthodes pour étudier des phénotypes électriques de CMs, comme arythmies ou des changements dans la morphologie du potentiel d’action (PA), sont au cœur de cette technologie.
Une considération importante dans l’application de l’iPSC-CMs est que les protocoles actuels de différenciation cardiaques n’entraînent pas une population homogène de cellules. Au lieu de cela, ils sont plutôt un mélange de cellules ressemblant à n ud sinusal, auriculaire et ventriculaires CMs à différents niveaux de maturation5,6,7,8. Cette hétérogénéité peut être une source pertinente de la variabilité expérimentale, surtout si les paramètres tels que la durée des PA (APD) sont l’objet d’une enquête, qui diffèrent intrinsèquement entre sous-types CM (p. ex., l’APD est plus courte dans auriculaire que dans CMs ventriculaires). L’approche classique pour régler ce problème est d’enquêter sur iPSC-CMs unique à l’aide de la méthode de serrage de patch et de classer chaque cellule sous la forme nodale-, auriculaire-, ou ventriculaire-like, basée sur la morphologie de son AP9. Toute analyse ultérieure peut être restreint alors aux cellules représentant le sous-type de CM d’intérêt. L’inconvénient majeur de cette stratégie est son débit limité et le manque d’évolutivité. En outre, le caractère invasif de l’électrophysiologie de patch clamp ne permet pas de l’imagerie des cellules mêmes séquentiellement sur une période de temps prolongée.
Ici, nous fournissons des détails expérimentaux sur une méthode10 mis au point pour l’image optiquement APs en sous-types spécifiques de l’iPSC-CMs. Cela permet de surmonter le problème de l’hétérogénéité de sous-type et augmente considérablement le débit par rapport aux méthodes conventionnelles, permettant le phénotypage rapide du CISP-CMs transportant des variants génétiques ou d’être des agents exposés à pharmacologique.
Aperçu de l’approche d’imagerie optique du sous-type spécifique
Un indicateur de tension codé génétiquement (GEVI), dont les propriétés fluorescence changent lors de la dépolarisation et la repolarisation de la membrane cellulaire, est utilisé pour image optiquement les changements du potentiel membranaire des CMs. Le GEVI appliqué ici est la protéine fluorescente-détection de tension VSFP-CR11, qui se compose d’un domaine transmembranaire détection tension fusionné à une paire d’un vert (trèfle) et une protéine fluorescente rouge (mRuby2) (Figure 1 a). En raison de la proximité des deux fluorophores, l’excitation de la protéine fluorescente verte résulte en une fraction de l’énergie d’excitation étant transféré à la protéine fluorescente rouge par transfert d’énergie de résonance Förster (FRET). Par conséquent, l’excitation de la protéine fluorescente verte entraîne une émission à la fois le vert et les rouges protéines fluorescentes (Figure 1 a, panneau supérieur). Lorsque la cellule dépolarise, un réarrangement structural de la sonde de tension se produit qui se traduit par une réorientation des deux protéines fluorescentes, augmentant ainsi l’efficacité de la frette. Ainsi, encore plus de l’énergie d’excitation est transféré du vert à la protéine fluorescente rouge (Figure 1 a, panneau inférieur). Ainsi, dans une cellule dépolarisée, l’émission de fluorescence verte est plus faible, et l’émission de fluorescence rouge est plus brillante que dans une cellule au repos le potentiel de membrane (Figure 1 b).
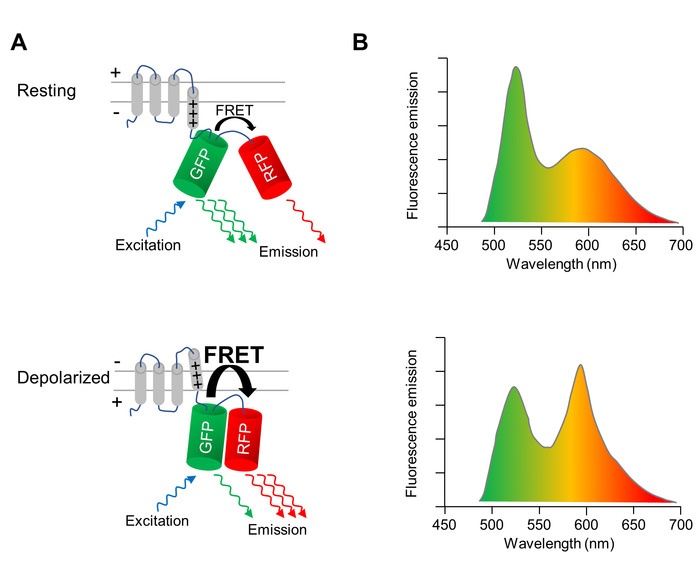
Figure 1 : l’imagerie optique du potentiel avec VSFP-CR. de membrane (A) A schéma illustrant l’action de la protéine fluorescente sensibles à la tension QUE VSFP-CR est montré. Lors de la dépolarisation de la membrane cellulaire, un réarrangement structural du domaine transmembranaire-détection de tension se traduit par une réorientation de la verte (GFP) et rouge protéine fluorescente (DP), augmentant l’efficacité de la Förster intramoléculaire transfert d’énergie par résonance (FRET). Les spectres (B) l’émission d’une VSFP sur l’excitation de la GFP dans les cellules au potentiel de repos membranaire (panneau du haut) et dans les cellules dépolarisées (panneau inférieur) sont représentés. Le changement spectral sur dépolarisation est exagéré pour plus de clarté. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Les changements dans l’efficacité de la frette reflétant les fluctuations du potentiel membranaire sont imagés à l’aide d’un microscope à fluorescence équipé d’un séparateur de l’image, qui sépare l’émission de fluorescence rouge et vert et les projette sur deux zones adjacentes de la puce d’une caméra sCMOS (Figure 2). Avec ce set-up, l’émission de fluorescence à deux bandes de longueur d’onde différente peut être enregistrée simultanément, ce qui permet le calcul d’un ratio de fluorescence rouge au vert afin de refléter le potentiel de membrane dans chaque image d’une série de Time-lapse.
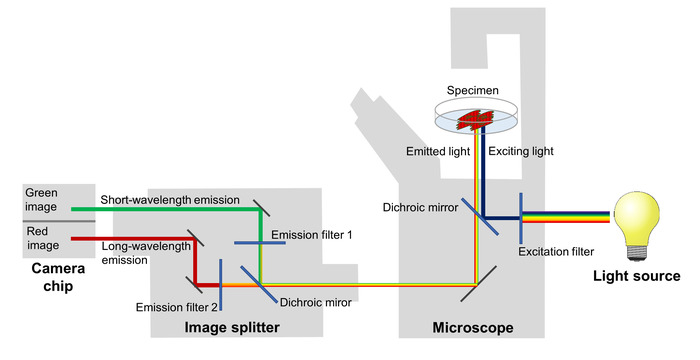
Figure 2 : Configuration du système d’imagerie. Les principaux composants du système d’imagerie utilisé pour image les modifications spectrales de la protéine fluorescente sensibles au voltage, reflétant les changements potentiels de membrane à une haute résolution temporelle sont représentées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
L’expression de VSFP-CR dans CMs est obtenue par transduction des gènes. Pour diriger l’expression au sous-type CM d’intérêt, le lentivirus contient un élément de promoteur (le renforceur de MLC2v ) qui anime spécifiquement transcription ventriculaire type iPSC-CMs10. Lorsque l’iPSC-CMs qui représentent un mélange de cellules de type auriculaire, nodal, ventriculaire-type et sont transduites avec ce lentivirus, VSFP-CR est exprimée uniquement dans les cellules ventriculaires. Étant donné que l’imagerie optique potentiel d’action dépend de cette sonde fluorescente, les potentiels d’action enregistrés représentent exclusivement le sous-type de CM d’intérêt (Figure 3).
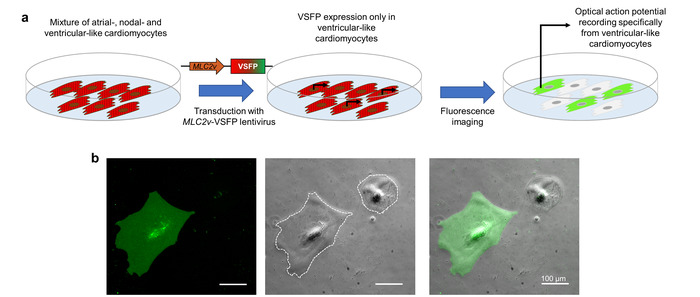
Figure 3 : expression VSFP pilotée par le promoteur pour l’imagerie de potentiel membranaire sous-type spécifique. (a) ce schéma montre comment enregistrements de potentiel d’action optique sous-type spécifique cardiomyocyte sont atteints. (b) iPSC-CMs infectés par un VSFP sous le contrôle de le MLC2v-amplificateur de ventriculaire spécifiques sont indiqués. L’expression de la sonde de tension est observée seulement dans CMs ventriculaire-comme dans le chenal de la GFP (panneau de gauche). Le contraste de phase (panneau central) et une image de superposition (panneau de droite) sont également fournis. Les pointillés blancs marquent les limites d’une cellule. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
La méthode décrite ici permet un enregistrement optique des APs d’un sous-type spécifique (c.-à-d., cellules ventriculaires) de CMs produit du CISP humaine. IPSC-CMs humaines représentent un outil émergent d’aborder une grande variété de problèmes médicaux et biologiques, et la différenciation de différents sous-types de CM est une source importante de la variabilité expérimentale. En utilisant des éléments de promoteurs spécifiques, l’expression d’un GEVI est spécifiquement réalisée …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par des subventions de la Fondation de recherche allemande (Si 1747/1-1), l’autre Kröner-Fresenius-Stiftung et la Deutsche Stiftung für Herzforschung.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
References
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

