Subtyp-spezifische optische Aktionspotential Aufnahmen in menschlichen induzierten pluripotenten Stammzellen abgeleitet ventrikuläre Kardiomyozyten
Summary
Hier präsentieren wir eine Methode, um optisch Bild Aktionspotentiale, insbesondere ventrikuläre erinnernden induzierten pluripotenten Stammzellen abgeleitet Kardiomyozyten. Die Methode basiert auf der Projektträger-gesteuerte Ausdruck eines Spannung-empfindlichen fluoreszierenden Proteins.
Abstract
Kardiomyozyten generiert aus menschlichen induzierten pluripotenten Stammzellen (iPSC-CMs) sind ein aufstrebenden Werkzeug in der Herz-Kreislauf-Forschung. Anstatt eine homogene Population von Zellen, repräsentieren die iPSC-CMs von aktuellen Differenzierung Protokolle erzeugt eine Mischung aus Zellen mit ventrikulären-, Vorhofflimmern-, und nodal-ähnlichen Phänotypen, die phänotypische Analysen erschwert. Hier ist eine Methode, um optisch Rekord Aktionspotentiale speziell von ventrikulären-wie iPSC-CMs präsentiert. Erreicht wird dies durch Lentivirale Transduktion mit einem Konstrukt, in dem ein genetisch codierte Spannungsanzeige unter der Kontrolle eines ventrikulären-spezifischen Promotor-Elements ist. Beim iPSC-CMs mit diesem Konstrukt ausgestrahlt werden, drückt sich die Spannungssensor ausschließlich in ventrikuläre-ähnlichen Zellen, Subtyp-spezifische optische Membran möglichen Aufnahmen mit Zeitraffer-Fluoreszenz-Mikroskopie ermöglicht.
Introduction
Kardiomyozyten (CMs) von induzierten pluripotenten Stammzellen (iPSCs) abgeleitet sind eine aufstrebende Werkzeug zu Molekulare Mechanismen von Herzerkrankungen, um neue Therapien zu untersuchen und zu Bildschirm für kardiale Nebenwirkungen Effekte1,2 sezieren ,3. Von Anfang an wurden Arrhythmogenic Krankheiten wie channelopathien ein wichtiger Schwerpunkt der Forschung Bereich4. Infolgedessen sind Methoden zu untersuchen, elektrische Phänotypen von CMs, wie Herzrhythmusstörungen oder Änderungen der Aktionspotential (AP) Morphologien, das Herzstück dieser Technologie.
Ein wichtiger Aspekt bei der Anwendung der iPSC-CMs ist, dass die aktuellen Protokolle der kardialen Differenzierung nicht zu einer homogenen Bevölkerung der Zellen führen. Stattdessen sind sie eher eine Mischung aus Zellen ähnlich Sinusknoten, Vorhofflimmern, und ventrikuläre CMs auf verschiedenen Ebenen der Reifung5,6,7,8. Diese Heterogenität kann eine relevante Quelle der experimentellen Variabilität, vor allem, wenn Parameter wie AP-Dauer (APD) untersucht werden, die per se unterscheiden sich zwischen CM Subtypen (z. B.die APD ist kürzer im Vorhofflimmern als in ventrikuläre CMs). Der konventionelle Ansatz zur Lösung dieses Problems ist es, einzelne iPSC-CMs mit der Patch-Clamp-Methode zu untersuchen und um jede Zelle als Knotenpunkt zu klassifizieren-, Vorhofflimmern-, oder ventrikuläre-Like, basierend auf der AP-Morphologie-9. Jede nachfolgende Analyse kann dann auf die Zellen aus der CM-Untertyp von Interesse beschränkt werden. Der größte Nachteil dieser Strategie ist die begrenzten Durchsatz und Mangel an Skalierbarkeit. Darüber hinaus erlaubt die invasive Art der Patch-Clamp-Elektrophysiologie nicht die Bildgebung der gleichen Zellen nacheinander über längere Zeiträume.
Hier bieten wir experimentelle Details auf eine Methode10 entwickelt, um optisch APs Bild in bestimmte Subtypen der iPSC-CMs. Dies überwindet das Problem der Subtyp Heterogenität und dramatisch erhöht den Durchsatz im Vergleich zu herkömmlichen Methoden erlauben die schnelle Phänotypisierung von iPSC-CMs genetische Varianten oder ausgesetzt pharmakologische Agenten.
Überblick über den Subtyp-spezifische optische Bildgebung Ansatz
Ein genetisch codierte Spannungsanzeige (GEVI), deren Fluoreszenzeigenschaften Depolarisation und Repolarisation der Zellmembran zu ändern, wird verwendet, um Änderungen des Membran-Potentials CMS optisch Bild. Die hier angewandte GEVI ist das Spannung-sensing fluoreszierende Protein VSFP-CR11, bestehend aus einer Spannung-sensing transmembrane Domäne verschmolzen zu einem Paar von einer grünen (Klee) und eine rote (mRuby2) fluoreszierendes Protein (Abb. 1A). Aufgrund der Nähe der zwei Fluorophore ergibt sich die Erregung des grün fluoreszierenden Proteins in einem Bruchteil der Anregungsenergie auf das rot fluoreszierende Protein über Förster Resonanz Energietransfer (FRET) übertragen werden. Daher führt die Anregung für das grün fluoreszierende Protein in einer Emission von Grün und rot fluoreszierende Proteine (Abbildung 1A, obere Leiste). Wenn die Zelle erschüttert, tritt eine strukturelle Neuordnung der Spannungssensor, die zu einer Neuausrichtung der beiden fluoreszierende Proteine, Erhöhung der FRET-Effizienz führt. Somit ist noch mehr von der Anregungsenergie vom Grün, das rot fluoreszierende Protein (Abb. 1A, untere Leiste) übertragen. Infolgedessen in einer depolarisiert Zelle grüne Fluoreszenz-Emission ist dunkler, und die rote Fluoreszenz-Emission ist heller als in einer Zelle bei ruhenden Membranpotential (Abbildung 1 b).
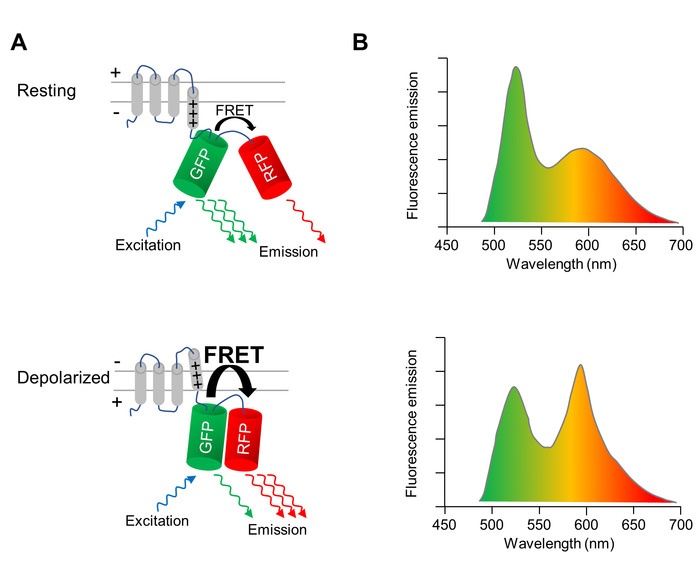
Abbildung 1: optische Bildgebung des Membranpotentials mit VSFP-CR. (A) A schematische Darstellung der Aktion die Spannung-empfindlichen fluoreszierenden Proteins VSFP-CR gezeigt wird. Auf die Depolarisation der Zellmembran übersetzt eine strukturelle Neuordnung in der Spannung-sensing transmembrane Domäne in eine Neuorientierung des grünen (GFP) und rot (RFP) fluoreszierendes Protein, Steigerung der Effizienz der intramolekularen Förster Resonanz Energietransfer (FRET). (B) die Emission-Spektren von VSFP auf Anregung von der GFP in Zellen an die Membran-Ruhepotential (obere Abdeckung) und depolarisiert Zellen (untere Leiste) werden dargestellt. Die spektrale Änderung nach Depolarisation ist zur Verdeutlichung übertrieben dargestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Die Veränderungen in der FRET-Effizienz spiegeln die Schwankungen des Membranpotentials sind abgebildet mit einem Fluoreszenzmikroskop ausgerüstet mit einer Bild-Splitter, die roten und grünen Fluoreszenz Emissionen trennt und projiziert sie auf zwei angrenzenden Gebieten der der Chip einer Kamera sCMOS (Abbildung 2). Mit diesem Set-up kann die Fluoreszenz-Emission bei zwei verschiedenen Wellenlängen Bands gleichzeitig ermöglicht die Berechnung des Verhältnisses der rot-grünen Fluoreszenz entsprechend das Membranpotential in jedem Bild eine Zeitraffer-Serie aufgezeichnet werden.
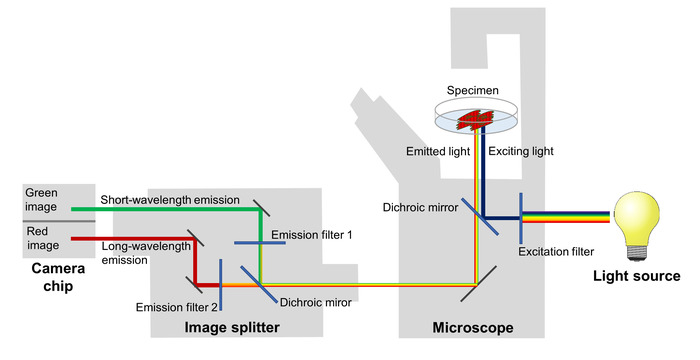
Abbildung 2: Konfiguration des das Abbildungssystem. Die Hauptkomponenten des imaging-System verwendet, um Bild, das die spektrale Veränderungen der Spannung-empfindlichen fluoreszierenden Proteins spiegeln die Membran mögliche Veränderungen mit einer hohen zeitlichen Auflösung dargestellt werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
Der Ausdruck der VSFP-CR im CMs wird durch Lentivirale Transduktion erreicht. Interessenbekundung für die CM-Subtyp direkt, enthält die Lentivirus ein Promotor-Element ( MLC2v -Enhancer), das speziell Transkription in ventrikuläre wie iPSC-CMs10fährt. Wenn das iPSC-CMs, die eine Mischung von Vorhofflimmern-ähnliche, nodal-ähnliche und ventrikuläre-wie Zellen darstellen mit diesem Lentivirus ausgestrahlt werden, wird VSFP-CR nur in den linksventrikulären-ähnliche Zellen ausgedrückt. Da die optische Aktionspotential Bildgebung von fluoreszierenden Sensor abhängt, vertreten die aufgezeichneten Aktionspotentiale ausschließlich den CM-Untertyp von Interesse (Abbildung 3).
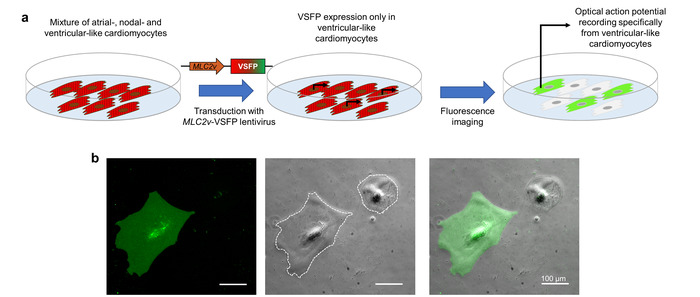
Abbildung 3: Projektträger-gesteuerte VSFP Ausdruck für potenzielle Bildgebung Subtyp-spezifischen Membran. (ein) dieses Schema zeigt, wie Cardiomyocyte Subtyp-spezifische optische Aktionspotential Aufnahmen erreicht werden. (b) iPSC-CMs mit einem VSFP unter der Kontrolle der ventrikulären-spezifische MLC2v-Enhancer infiziert werden angezeigt. Der Ausdruck von der Spannungssensor ist nur in ventrikuläre-ähnlichen CMs in der GFP-Kanal (links) beobachtet. Die Phasenkontrast (Mitte Platte) und Overlay-Bild (Rechte Abbildung) sind ebenfalls vorhanden. Die weiße gepunktete Linien markieren Zellgrenzen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Die hier beschriebene Methode ermöglicht eine optische Aufnahme von APs aus ein bestimmten Subtyp (z.B. ventrikuläre-wie Zellen) des CMs generiert aus menschlichen iPSCs. Menschlichen iPSC-CMs sind eine aufstrebende Werkzeug, eine Vielzahl von biologischen und medizinischen Probleme anzugehen, und die Differenzierung zu CM-Subtypen ist eine wichtige Quelle für experimentelle Variabilität. Mithilfe von spezifischen Promotor Elemente wird der Ausdruck einer GEVI speziell im CMs repräsentieren den Untertyp des…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch Zuschüsse von der Deutschen Forschungsgemeinschaft (Si 1747/1-1), die Else Kröner-Fresenius-Stiftung und der Deutschen Stiftung Für Herzforschung unterstützt.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
References
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

