하위 형식 관련 광학 활동 전위 녹음 인간의 유도 만능 줄기 세포 유래 심 실 Cardiomyocytes
Summary
여기 우리는 특히 심 실 같은 유도 만능 줄기 세포 유래 cardiomyocytes에에서 광학 이미지 활동 전위, 하는 방법을 제시. 메서드를 사용 하면 전압에 민감한 형광 단백질의 발기인 기반 식을 기반으로 합니다.
Abstract
Cardiomyocytes 인간 유도 만능 줄기 세포 (iPSC-CMs)에서 생성 된 심혈 관 연구에 새로운 도구입니다. 셀의 균질 성 인구 되 고, 보다는 오히려 현재 분화 프로토콜에 의해 생성 된 iPSC CMs 대표 심 실 세포의 혼합-, 심 방-, 및 phenotypic 분석을 복잡 하 게 꾸벅꾸벅 졸 기 같은 고기. 여기, 특히 심 실 같은 iPSC-CMs에서에서 광학 기록 활동 전위 하는 방법을 제시 합니다. 이는 유전자 인코딩 전압 표시기가 심 실 특정 발기인 요소의 제어 구조와 lentiviral 변환에 의해 달성 된다. IPSC-CMs는이 구문으로 불리고 때 하위 특정 광 막 잠재적인 녹음 시간 경과 형광 현미경 검사 법을 사용 하 여 사용 전압 센서 심 실 같은 셀에 독점적으로 표현 된다.
Introduction
유도 만능 줄기 세포 (Ipsc)에서 파생 된 Cardiomyocytes (CMs)는 불리 한 심장 약물 효과1,2 에 대 한 분자 메커니즘의 심장 질환, 비 발한 요법을 조사 하 고 화면을 해 부하는 신흥 도구 3. 바로 처음부터, channelopathies 같은 arrhythmogenic 질병이 연구4의 중요 한 초점 되었습니다. 따라서, 부정맥 또는 활동 전위 (AP) 형태학 변화 같은 CMs의 전기 고기를 조사 하는 방법이이 기술의 마음에 있습니다.
IPSC CMs의 응용 프로그램에서 중요 한 고려 사항이입니다 셀의 균질 성 인구 현재 심장 차별화 프로토콜 발생 하지 않습니다. 대신, 그들은 오히려 셀 닮은 공동 노드, 심 방, 심 실 CMs 성숙5,6,,78의 서로 다른 수준에서의 혼합물. 이 관련 소스 수 실험 가변성의 AP 기간 (APD) 같은 매개 변수를 조사 하는 경우에 특히는 본질적으로 다릅니다 CM 하위 (예를 들어, APD는 짧은 심 실 CMs에 보다 심 방). 이 문제를 해결 하기 위해 기존의 접근 방법과 패치 클램프 메서드를 사용 하 여 단일 iPSC-CMs를 조사 하 고 각 셀에 꾸벅꾸벅 졸 기를 분류 하는-, 심 방-, 또는 심 실 같은, 그것의 AP 형태9에 따라. 모든 후속 분석 관심의 CM 하위 나타내는 셀에 다음 제한 될 수 있습니다. 이 전략의 주요 결점은 그것의 한정 된 처리량과 확장성의 부족. 또한, 패치 클램프 전기 생리학의 침략 적인 본질 순차적으로 확장 된 기간 동안 동일한 셀의 이미지를 허용 하지 않습니다.
여기, 우리는 방법10 광학 iPSC CMs의 특정 하위에 Ap의 이미지를 개발에 실험 정보를 제공 합니다. 이 하위가 문제를 극복 하 고 극적으로 iPSC-CMs 유전 이체를 운반 하거나 약물에 노출 된 에이전트의 급속 한 형질을 허용 하는 기존의 방법에 비해 처리량을 증가 시킵니다.
하위 형식 관련 광학 이미징 접근 방법의 개요
도발은와 세포 막의 repolarization 형광 속성 변경, 유전자 인코딩 전압 표시기 (GEVI), CMs의 막 잠재력의 변화를 광학 이미지에 사용 됩니다. 여기에 적용 하는 GEVI은 전압 감지 형광 단백질 VSFP CR11, 전압 감지 막 횡단 도메인 융합 그린 (클로버)와 레드 (mRuby2) 형광 성 단백질 (그림 1A)의 쌍을 이루어져 있는. 두 fluorophores의 근접 때문에 녹색 형광 단백질의 여기 여기 에너지는 빨간색 형광 단백질을 통해 포스터 공명 에너지 전달 (무서 워)에 전송 되 고의 결과. 따라서, 녹색 형광 단백질의 여기 모두 녹색과 적색 형광 단백질 (그림 1A, 상단 패널)에서 방출에 발생합니다. 셀 depolarizes, 전압 센서의 구조 재편 무서 워 효율성 두 가지 형광 단백질의 재교육으로 변환 하는 발생 합니다. 따라서, 여기 에너지의 더 많은 전송 됩니다 녹색에서 빨간색 형광 단백질 (그림 1A, 하단 패널). 그 결과, depolarized 셀에 녹색 형광 방출 주차, 이며 휴식 막 잠재적인 (그림 1B)에 셀에 빨간색 형광 방출은 보다 밝은.
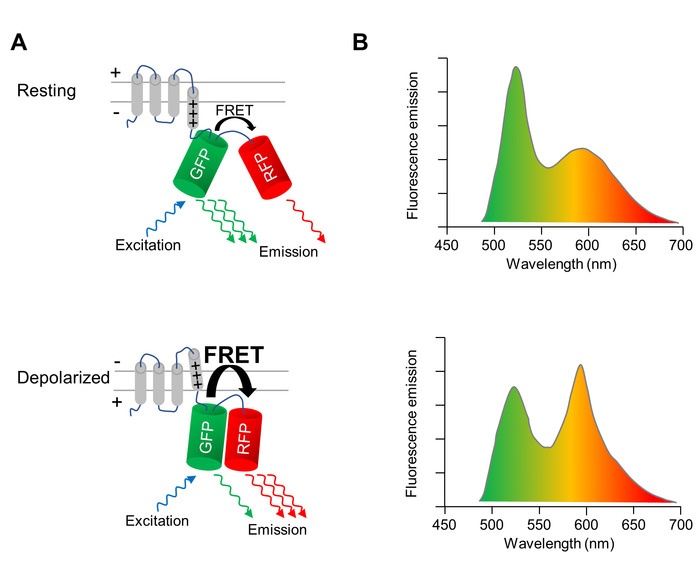
그림 1: VSFP cr.와 막의 광학 영상 VSFP CR 표시 전압에 민감한 형광 단백질의 행동을 묘사 하는 (A) A 회로도 세포 막의 도발은 시 전압 감지 막 횡단 도메인 구조 재편 (GFP) 녹색과 빨간색 (RFP) 형광 단백질, intramolecular 포스터의 효율성 증가의 재교육으로 변환 공명 에너지 전달 (무서 워) 휴식 막 잠재력 (위 패널)에서 셀에 및 depolarized 셀 (하단 패널)에 GFP의 구동 시 VSFP의 (B) 방출 스펙트럼 묘사 된다. 도발은 시 스펙트럼 변화 명확성을 위해 과장 이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
막 잠재력의 변동 미러링 무서 워 효율에서 변화는 빨간색과 녹색 형광 방출 분리 하 고 그들의 2 개의 인접 한 지역에 프로젝트는 이미지 스플리터 장착 형광 현미경을 사용 하 여 몇 군데 sCMOS 카메라 (그림 2)의 칩 했다. 이 설정으로 2 개의 다른 파장 악대에서 형광 방출 기록 될 수 동시에, 빨강-녹색 형광 막 잠재적인 시간 경과 시리즈의 모든 이미지에 맞게 비율의 계산을 허용 하.
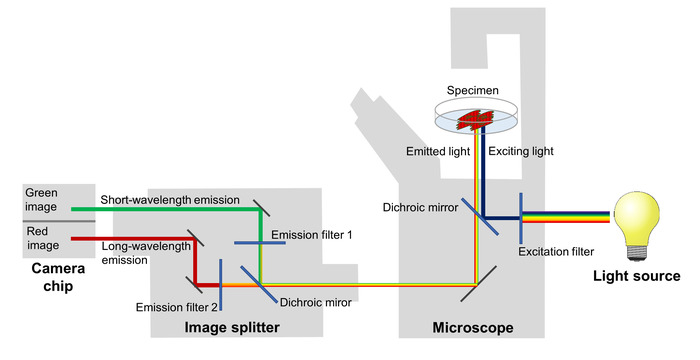
그림 2: 이미징 시스템의 구성. 이미징 시스템의 주요 구성 요소는 높은 시간 해상도에서 막 잠재적인 변화를 미러링 전압에 민감한 형광 단백질의 스펙트럼 변화를 묘사 하는 이미지를 사용. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
VSFP-CR CMs의 식 lentiviral 변환 함으로써 이루어집니다. 관심의 CM 하위 식을 직접 lentivirus는 특히 심 실 같은 iPSC-CMs10전사를 드라이브 하는 발기인 요소 ( MLC2v enhancer)를 포함 합니다. 심 방 같은, 꾸벅꾸벅 졸 기 같은와 같은 심 실 세포의 혼합물을 나타내는 iPSC-CMs는이 lentivirus 함께 불리고, VSFP CR 심 실 같은 셀에만 표시 됩니다. 광학 활동 전위 이미징이 형광 센서에 따라, 이후 기록 된 활동 전위는 독점적으로 관심 (그림 3)의 CM 하위 유형을 나타냅니다.
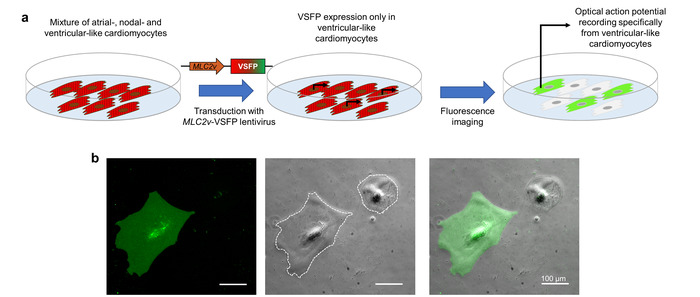
그림 3: 하위 형식 관련 막 잠재적인 이미징 발기인 구동 VSFP 식. (한)이이 회로도 cardiomyocyte 하위 형식 관련 광학 활동 전위 기록 달성 하는 방법을 보여 줍니다. (b) iPSC-CMs 심 실 전용 MLC2v-증강의 통제는 VSFP에 감염 표시 됩니다. 전압 센서의 식 GFP 채널 (왼쪽된 패널)에서 심 실 같은 CMs에만 관찰 된다. 오버레이 이미지 (오른쪽 패널) 및 위상 대비 (중간 패널)도 제공 됩니다. 흰색 점선 셀 경계를 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Protocol
Representative Results
Discussion
여기 설명 하는 방법을 인간의 Ipsc에서 생성 하는 CMs의 특정 하위 (즉, 같은 심 실 세포)에서 Ap의 광학 기록 수 있습니다. 인간의 iPSC-CMs는 거 대 한 다양 한 생물학과 의료 문제를 해결 하기 위해 새로운 도구 이며 다른 CM 하위 형식에 차별화 실험적인 다양성의 중요 한 소스. 특정 발기인 요소를 사용 하 여는 GEVI의 식 CMs에 관심, 하위를 나타내는 있는 광학 이미지 다음에 구체적으로 달성 된…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 작품은 독일 연구 재단 (Si 1747/1-1), 다른 Kröner-Fresenius-재단, 그리고 도이치 재단에 Herzforschung에서 교부 금에 의해 지원 되었다.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
References
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

