Подтип конкретных оптический потенциал действия записи в человека индуцированных плюрипотентных стволовых клеток кардиомиоцитов желудочков
Summary
Здесь мы представляем метод оптически изображение потенциалы действия, особенно в кардиомиоцитов желудочков как индуцированных плюрипотентных стволовых клеток. Метод основан на промоутер driven выражение напряжения чувствительных флуоресцентный белок.
Abstract
Cardiomyocytes, образующиеся человеческое индуцированных плюрипотентных стволовых клеток (iPSC-CMs) являются инструментом, возникающих в сердечно-сосудистых исследований. Однородная популяция клеток, а iPSC-CMs, порожденных текущей дифференциация протоколы представляют собой смесь клеток с желудочковой-, предсердий-и узловые как фенотипы, которые усложняет фенотипические анализы. Здесь представлен метод для оптически записи потенциалы действия конкретно от желудочков как iPSC-CMs. Это достигается путем лентивирусные трансдукция с конструкцией, в которой генетически закодированный напряжения Индикатор находится под контролем элемента желудочков конкретной промоутера. Когда iPSC-CMs преобразованы с этой конструкции, датчик напряжения выражается исключительно желудочков подобных клеток, позволяя оптических мембраны подтип конкретных потенциальных записи с помощью микроскопии флуоресцирования промежуток времени.
Introduction
Кардиомиоцитов (CMs), производные от индуцированных плюрипотентных стволовых клеток (iPSCs) являются новым инструментом для рассечения молекулярных механизмов болезни сердца, расследовать Роман терапии и экран для сердца побочных эффектов1,2 ,3. С самого начала аритмогенная заболеваний, таких как channelopathies был важным направлением этой области исследования4. Следовательно методы расследования электрические фенотипы CMs, например аритмий или изменения в морфологии потенциал действия (AP), находятся в центре этой технологии.
Важным фактором в применении iPSC-CMs является, что текущие протоколы сердца дифференциация не приводят к однородная популяция клеток. Вместо этого они являются скорее смесь из клетки, напоминающие синусового узла, фибрилляция и желудочковая CMs на различных уровнях созревания5,6,,78. Эта разнородность может быть источником соответствующих экспериментальных изменчивости, особенно если исследованы параметры, такие как продолжительность AP (APD), который неразрывно различаются подтипы см (например, APD короче предсердий, чем в желудочковой CMs). Традиционный подход к решению этой проблемы является расследование одного iPSC-CMs, с помощью метода зажим патч и классифицировать каждой ячейки как узловой-, предсердий-, или желудочков как, на основе ее AP морфология9. Любой последующий анализ может быть затем ограничен в клетки, представляющие см подтип интерес. Основным недостатком данной стратегии является его ограниченной пропускной способности и отсутствие масштабируемости. Кроме того захватнический характер патч зажим электрофизиологии не позволяют изображений же клетки последовательно в течение длительного времени.
Здесь мы подробно экспериментальный метод10 , разработаны для оптически изображения APs в конкретных подтипы iPSC-CMs. Это преодолевает проблему неоднородности подтип и резко повышает пропускную способность по сравнению с традиционными методами, позволяя быстрое фенотипирование iPSC-CMs проведение генетических вариантов или в подверженными фармакологических агентов.
Обзор подтип-оптических изображений подход
Генетически закодированный напряжения Индикатор (GEVI), свойства которых флуоресценции изменить деполяризации и реполяризации клеточной мембраны, используется для оптически изображение изменения мембранного потенциала CMs. GEVI, здесь это напряжение зондирования флуоресцентный белок VSFP-CR11, которая состоит из напряжения зондирования трансмембранного домена сливается с парой Грин (клевер) и красный (mRuby2) флуоресцентный белок (рис. 1A). Благодаря близости двух флуорофоров возбуждения зеленого флуоресцентного белка приводит к небольшую часть энергии возбуждения, передаются в красных флуоресцентных белков через передачи энергии резонанса Фёрстер (лад). Таким образом возбуждения зеленого флуоресцентного белка приводит к эмиссии из зеленых и красных флуоресцентных белков (рис. 1A, верхняя группа). Когда клетки depolarizes, структурной перестройки датчика напряжения происходит что переводится в переориентации двух флуоресцентных белков, повышение эффективности ладу. Таким образом даже больше энергии возбуждения передается от зеленого до Красного флуоресцирующего белка (рис. 1A, Нижняя панель). В результате в ячейку деполяризованный, зеленая Флуоресценция выбросов диммер, и красной флуоресценцией выбросов ярче, чем в камере в отдыхая мембранного потенциала (рис. 1B).
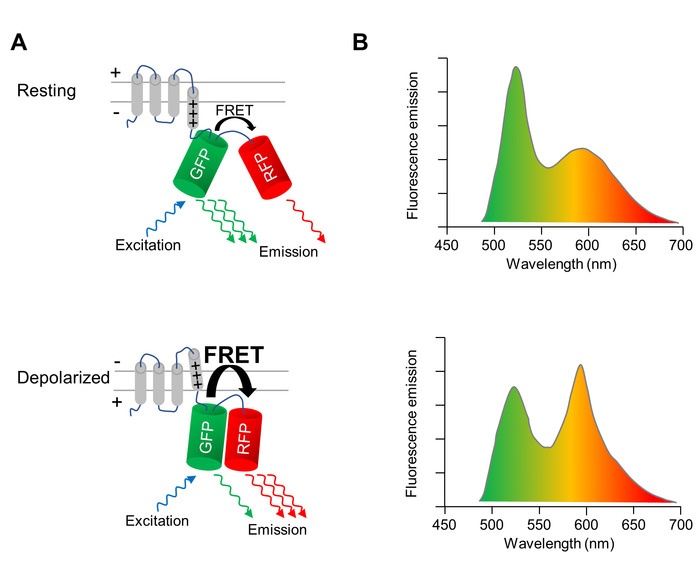
Рисунок 1: оптическая томография мембранного потенциала с VSFP-ручей (A) A схема с изображением действий напряжения чувствительных флуоресцентный белок, проявленную VSFP-CR. При деполяризации мембраны клетки структурной перестройки в напряжение зондирования трансмембранных доменов переводит в переориентации Грин (ГПУП) и красный (RFP) флуоресцентный белок, повышение эффективности внутримолекулярной Фёрстер передача энергии резонанса (лад). (B) выбросов спектры VSFP после возбуждения GFP в клетках на мембранного потенциала покоя (Верхняя панель) и в деполяризованный клетках (Нижняя панель) изображены. Спектральные изменения при деполяризации преувеличен для ясности. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Изменения в ладу эффективность зеркального отображения колебаний мембранного потенциала отражаются с помощью микроскопа флуоресценции оснащены изображения разделителя, который отделяет красной и зеленой флуоресценцией выбросов и проецирует их на две прилегающие районы Микросхема sCMOS камеры (рис. 2). С этой настройки флуоресценции выбросов на двух разных волны полосы могут быть записаны одновременно, что позволяет расчет коэффициента красно зеленая Флуоресценция отразить мембранного потенциала в каждом изображении покадровой серии.
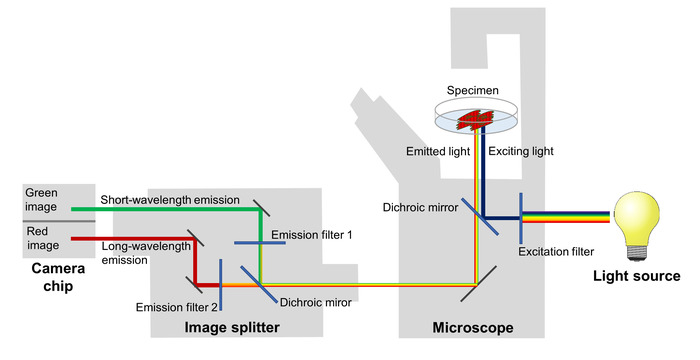
Рисунок 2: Настройка системы,. Основные компоненты системы, используется для изображений, которые изображены спектральные изменения напряжения чувствительных флуоресцентный белок, зеркального отображения потенциальных изменений мембраны с высоким временным разрешением. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Выражение VSFP-CR в CMs достигается лентивирусные трансдукции. Направлять проявление интереса к подтипу см, несущего содержит элемент промоутер ( MLC2v усилитель), который конкретно диски транскрипции в iPSC-CMs желудочков как10. Когда iPSC-CMs, которые представляют собой смесь предсердий как, узловой как и желудочков подобных клеток преобразованы с этой Лентивирусы, VSFP-CR выражается только в клетках желудочков как. Так как оптический потенциал действия изображений зависит от флуоресцентных датчик, записанные потенциалы действия исключительно представляют см подтип интерес (рис. 3).
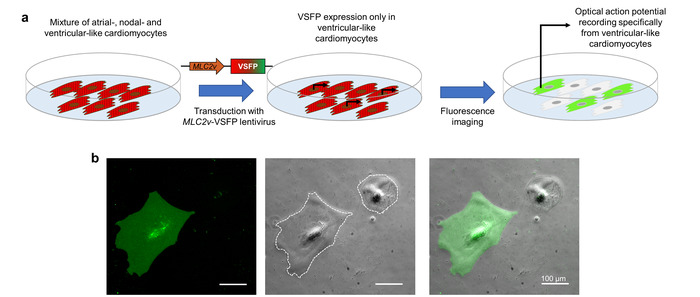
Рисунок 3: промоутер управляемый VSFP выражение для подтипа специфические мембраны потенциал изображений. () Эта схема показывает, как достигаются cardiomyocyte оптический потенциал действия подтип конкретных записей. (b) iPSC-CMs инфицированных VSFP под контролем желудочков специфических MLC2v-усилитель показываются. Выражение датчика напряжения наблюдается только в желудочков как CMs в канале GFP (левая панель). Также предоставляются фазового контраста (средняя группа) и накладываемого изображения (правая панель). Белыми пунктирными линиями Марк границ ячейки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
Метод, описанный здесь позволяет оптической записи APs от конкретного подтипом (например, желудочков подобных клеток) CMs, созданный из человека iPSCs. Человека iPSC-CMs являются новым инструментом решать огромное разнообразие биологических и медицинских проблем, и дифференциации в разли?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана грантов от немецкого фонда научных исследований (Si 1747/1-1), остальное Kröner-Fresenius-Stiftung и Deutsche Stiftung für Herzforschung.
Materials
| ß-Mercaptoethanol | Invitrogen | 21985023 | |
| DMEM-F12 Medium | Invitrogen | 21331046 | |
| FBS(Fetal Bovine Serum) | Invitrogen | 16141079 | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140050 | |
| GlutaMax-I Supplement | Invitrogen | 35050061 | alternative L-Glutamine |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| Fibronectin bovine plasma | Sigma-Aldrich | F1141 | |
| Collagenase type II | Worthington Biochem | LS004174 | |
| Hexadimethrine Bromide (Polybrene) | Sigma-Aldrich | H9268 | enhancing lentiviral infection |
| 3.5 cm glass-bottom microdishes | MatTek corporation, Ashland, MA, USA | P35G-1.5-14-C | |
| Microscope stand | Leica Microsystems, Wetzlar, Germany | DMI6000B | |
| Microscope objective | Leica Microsystems, Wetzlar, Germany | HCX PL APO 63x/1.4-0.6 Oil | |
| sCMOS camera | Andor Technology, Belfast, UK | Zyla V | |
| Microscope filter cube: excitation filter | Chroma Technology Corp, Bellows Falls, VT, USA | ET480/40X | bandpass 480/40 |
| Microscope filter cube: dichroic mirror | Chroma Technology Corp, Bellows Falls, VT, USA | T505lpxr | longpass 505 nm |
| Image splitter | Cairn Research, Faversham, UK | OptoSplit II | |
| Image splitter filter cube: dichroic mirror | AHF Analysentechnik GmbH, Tübigen, Germany | 568LPXR | longpass 568 nm |
| Image splitter filter cube: emission filter 1 (GFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 520/28 BrightLine HC | bandpass 520/28 nm |
| Image splitter filter cube: emission filter 2 (RFP emission) | AHF Analysentechnik GmbH, Tübigen, Germany | 630/75 ET Bandpass | bandpass 630/75 nm |
| Pacing inset | Warner Instruments, Hamden, CT, USA | RC-37FS | |
References
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacology & Therapeutics. 143 (2), 246-252 (2014).
- Goedel, A., My, I., Sinnecker, D., Moretti, A. Perspectives and Challenges of Pluripotent Stem Cells in Cardiac Arrhythmia Research. Current Cardiology Reports. 19 (3), 23 (2017).
- Rocchetti, M., et al. Elucidating arrhythmogenic mechanisms of long-QT syndrome CALM1-F142L mutation in patient-specific induced pluripotent stem cell-derived cardiomyocytes. Cardiovascular Research. 113 (5), 531-541 (2017).
- Sinnecker, D., et al. Modeling long-QT syndromes with iPS cells. Journal of Cardiovascular Translational Research. 6 (1), 31-36 (2013).
- Talkhabi, M., Aghdami, N., Baharvand, H. Human cardiomyocyte generation from pluripotent stem cells: A state-of-art. Life Sciences. , 98-113 (2016).
- Ben-Ari, M., et al. Developmental changes in electrophysiological characteristics of human-induced pluripotent stem cell-derived cardiomyocytes. Heart Rhythm. 13 (12), 2379-2387 (2016).
- Den Hartogh, S. C., Passier, R. Concise Review: Fluorescent Reporters in Human Pluripotent Stem Cells: Contributions to Cardiac Differentiation and Their Applications in Cardiac Disease and Toxicity. Stem Cells. 34 (1), 13-26 (2016).
- Schweizer, P. A., et al. Subtype-specific differentiation of cardiac pacemaker cell clusters from human induced pluripotent stem cells. Stem Cell Research & Therapy. 8 (1), 229 (2017).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. The New England Journal of Medicine. 363 (15), 1397-1409 (2010).
- Chen, Z., et al. Subtype-specific promoter-driven action potential imaging for precise disease modelling and drug testing in hiPSC-derived cardiomyocytes. European Heart Journal. 38 (4), 292-301 (2017).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nature Methods. 9 (10), 1005-1012 (2012).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. Journal of Visualized Experiments. (91), e52010 (2014).
- Wang, X., McManus, M. Lentivirus production. Journal of Visualized Experiments. (32), e1499 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Molecular Medicine. 4 (3), 180-191 (2012).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scientific Reports. 7, 5464 (2017).
- Dorn, T., et al. Direct nkx2-5 transcriptional repression of isl1 controls cardiomyocyte subtype identity. Stem Cells. 33 (4), 1113-1129 (2015).
- Kaestner, L., et al. Genetically Encoded Voltage Indicators in Circulation Research. International Journal of Molecular Sciences. 16 (9), 21626-21642 (2015).

