Potentiation של נוגדנים נגד סרטן יעילות על-ידי סמים Antineoplastic: זיהוי של נוגדן תרופתיים הסינרגטיות באמצעות המשוואה אינדקס שילוב
Summary
פרוטוקול זה מתאר כיצד להעריך הסינרגטיות בין נוגדן נגד סרטן תרופות antineoplastic במודלים פרה באמצעות המשוואה אינדקס שילוב של צ’או, Talalay.
Abstract
Potentiation נוגדנים חד-שבטיים עוינת (mAb) על ידי סוכנים כימותרפיות מהווה אסטרטגיה רב ערך עבור תכנון טיפול יעיל ובטוח מפני סרטן. כאן אנו מספקים פרוטוקול כדי לזהות שילוב רציונלי בשלב פרה. ראשית, אנו מתארים הנועד מבוססת תא להעריך את הסינרגטיות בין mAb נגד סרטן תרופות ציטוטוקסיות, המשתמשת המשוואה אינדקס שילוב של צ’או, Talalay1. זה כולל את המדידה של גידול התא סמים, נוגדן-רגישות שימוש assay MTT, ואחריו ניתוח המחשב אוטומטית כדי לחשב את ערכי אינדקס (CI) שילוב. CI ערכים של < 1 לציין הסינרגטיות בין mAbs נבדק סוכנים ציטוטוקסיות1. כדי לאמת את במבחנה ממצאים ויוו, נתאר בהמשך שיטה כדי להעריך את היעילות של משטר השילוב במודל גידול xenograft. במודל זה, הטיפול המשולב מעכבת באופן משמעותי הגידול, כשהתוצאה הישרדות המורחבת משמעותית בהשוואה פקדים סוכן יחיד. חשוב, הניסויים ויוו חושף משטר השילוב הוא נסבל היטב. פרוטוקול זה מאפשר הערכת יעילות תרופה נגד סרטן צירופי במודלים פרה וזיהוי של שילוב רציונלי כדי להעריך בניסויים קליניים.
Introduction
הגישה הקונבנציונלית בטיפול של מספר רב של סוגים שונים של סרטן היה מבוסס על יחידני. אפילו אם זה משמש עדיין במקרים רבים, שיטה זו נפגשו מספר מכשולים שמוביל בחירה של טיפולים משולבים2. במיוחד, תאים סרטניים פגיעים יותר לפתח עמידות כאשר מטופלים עם תרופה אחת על ידי גרימת הישרדות חלופי מנגנונים3, והתוצאה היא כישלון טיפולי בחולים4. יתר על כן, ביחידני, תרופות בדרך כלל הפארקים אחראית הרשות במינון גבוה. את המצב הזה לעיתים קרובות תוצאות המופע של תופעות לוואי למינון חזק זה יכול להיות בלתי נסבל, כוח רופאים להפסיק את הטיפול2. מסיבות אלו, האגודה של מולקולות נגד סרטן הוא עכשיו העדיפו יחידני.
שילובים תרופתיים האידיאלי יהיה אלה שפועלים בסינרגיה נגד תאים סרטניים, ללא רעילות מוגברת נגד תאים נורמליים. הסינרגטיות מתייחס האינטראקציה של שניים או יותר תרופות שמייצר השפעה תרפויטית עולה על הסכום של כל תרופה בודדים מתנהג בנפרד. אינטראקציות כזה עלול לגרום משופרת יעילות טיפולית קלינית2. זה מגביל את ההתנגדות הטיפול מגביר את היעילות, ניתן גם להפחית רעילות2. למעשה, ניתן להפחית את המינון של כל תרופה כדי להפחית את תופעות הלוואי שלהן על ידי מיקוד מסלולים שונים. בנוסף, אחד של המולקולות יכול לשמש גם סוכן sensitizing נגד תאים סרטניים. ההשפעה של התרופה השנייה שעשויים להיות מוגברת על תאים sensitized, המינונים פחות יכול להיות בשימוש5.
טיפול משולב יכול לכלול שניים או יותר תרופות כימותרפיות ו/או תרופות/מוצרים ביולוגיים, כגון נוגדנים חד-שבטיים6. אלה mAbs במיוחד היעד תאים המבטאים אנטיגן פני שטח התא של עניין מסוגלות להרוג תאים סרטניים באמצעות מסלולים אימונולוגי כולל נוגדנים תלויי תאית cytotoxicity (ADCC), עם המעורבות של תאים חיסוניים אפקטור 7, cytotoxicity תלויי-המשלים (CDC)6. הם גם משמשים דרך מנגנון חיסוניות מתווכת על ידי אפופטוזיס8,9,10,11. במקרה זה, אינדוקציה של התהליך של מוות תאים מתוכנת עלול לרגש תאים סרטניים, להחליש את תפקידם ולבצע את כימותרפית המשויך יעיל יותר במינון נמוך יותר. ככזה, proapoptotic mAb הם מועמדים טובים עבור עיצוב משטרי בשילוב עם תרופות antineoplastic.
מודלים מתמטיים שונים תוארו להעריך הסינרגטיות סמים; אחד מהם הוא מבוסס על שילוב מדד בשיטה1. שיטה זו מבוססת על העיקרון חציון-אפקט שפותחה על ידי צ’או1. המשוואה חציון-אפקט מופיע את מינון התרופה לבין האפקט כדלקמן.
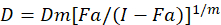
. הנה, D הוא מינון התרופה; Dm הוא המינון חציון-אפקט; הפא הוא השבר מושפע המנה; מ’ הוא המעריך שמסמל את הצורה של מינון-אפקט מגרש1. המינון חציון-אפקט משמש כדי לחשב את המינון Dx של התרופה מעכב או הורג “x” אחוזים של תאים. הערך CI לאחר מכן מחושב כדי להעריך את השפעת השילוב סמים, כדלקמן1מוספים.
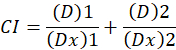
הערך CI 1 מציין אפקט תוסף וערך CI של 1 מציין הטינה1. היישום של שיטה זו נוספת בהנחייתם של הזמינות של תוכנית מחשב, CompuSyn, הקובע הסינרגטיות של אנטגוניזם במינונים כל או רמות ההשפעה הדמיה אוטומטית12.
הקבוצה שלנו פיתח ייחודיים 8B6 mAb O-אצטיל-GD2 ganglioside (OAcGD2) נוירובלסטומה אנטיגן13 , נוספת הדגימו כי mAb הזה הוא מסוגל לגרום מוות של תאים עם תכונות של אפופטוזיס11. כדי לבדוק אם mAb 8B6 יכול לרגש לתאי נוירובלסטומה topotecan הסוכן antineoplastic, שינינו את השיטה הנ ל שפותחה על ידי צ’או1. ראשית, אנו לקבוע מנה אפקטיבית (אד50) 50 הערכים של mAb 8B6 ו- topotecan. בשלב הבא, התאים נוירובלסטומה עם יחס equipotent של שתי תרכובות בהתבסס על אד50 ערכים נחשפים לקבוע את הערכים CI שימוש בתוכנת סימולציה הנ. שיטה זו מאפשרת לנו להפגין הסינרגטיות בין mAb 8B6 ו- topotecan חוץ גופית בתוך. בשלב הבא, אנו מתארים את פרוטוקול להעריך עוד יותר את העוצמה והביטחון של שילוב משטר זה ויוו. פרוטוקול זה ניתן להחיל בקלות כדי לבחור mAb נגד סרטן חזק ובטוח ושילובים הסוכן כימותרפיות במחקרים פרה. ייצוג סכמטי של מחקר זה מסופק באיור1.
Protocol
Representative Results
Discussion
כדי לחזות את התוצאה של תגובות בין תרופתיות, ניתן להשתמש בשלוש שיטות: מתודולוגיה isobologram17, מודל לא-ליניאריות תערובת18ו השילוב מדד1. ניתוח מדד משולב הוא הנפוץ ביותר בשימוש כי היישום שלה היא פשוטה בשל הזמינות של תוכנית מחשב ידידותי למשתמש. למטרה זו, אנו קוד…
Disclosures
The authors have nothing to disclose.
Acknowledgements
להעניק תמיכה: Fondation דה Projet דה L ‘אוניברסיטת דה נאנט, les Bagouz’ א’ מאנון, הליגה חדר מרווח וחדיש le סרטן comité דה לה לואר-מלון אטלנטיק, comité du Morbihan ולאחר comité דה Vendée, une רוז למזוג S.A.R.A.H, מרטין l ‘ etoile de la Société פרנסז דה Lutte חדר מרווח וחדיש לס סרטן et les leucémies de ל’אנפן et de L’adolescent (SFCE). מ ב וג’יי. אף נתמכים על ידי לה ליגה חדר מרווח וחדיש Le סרטן. המחברים תודה את למעבדות-המתקן Bonamy פרנסואה מבנה Fédérative דה רשרש. המחברים גם תודה ד ר ס סוזין (Inserm, פריז) למתן את התאים IMR5, גב’ ח’ Estéphan לסיוע טכני שלה.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
References
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. 암 연구학. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. 암 연구학. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

