Potenziamento dell'efficacia dell'anticorpo antitumorale di farmaci antineoplastici: rilevazione dell'anticorpo-farmaco sinergismo usando l'equazione di indice di combinazione
Summary
Questo protocollo descrive come valutare il sinergismo fra un anticorpo antitumorale e farmaci antineoplastici in modelli preclinici utilizzando l’equazione di indice di combinazione di Chou e Talalay.
Abstract
Potenziamento di ostili gli anticorpi monoclonali (mAb) dagli agenti chemioterapeutici costituisce una strategia importante per la progettazione di una terapia efficace e più sicura contro il cancro. Qui forniamo un protocollo per identificare una combinazione razionale nella fase preclinica. In primo luogo, descriviamo un test per valutare il sinergismo tra mAb anticancro e farmaci citotossici, che utilizza l’equazione di indice di combinazione di Chou e Talalay1cella. Questo include la misurazione della sensibilità del tumore delle cellule farmaco – e anticorpo-usando un’analisi MTT, seguita da un’analisi di computer automatici per calcolare i valori di indice (CI) di combinazione. CI valori di < 1 indicare sinergismo tra testata mAbs e agenti citotossici1. Per corroborare l’in vitro risultati in vivo, ulteriormente Descriviamo un metodo per valutare l’efficacia del regime di combinazione in un modello di xenotrapianto del tumore. In questo modello, il regime combinato ritarda significativamente la crescita del tumore, che si traduce in un significativo di sopravvivenza esteso rispetto ai comandi del singolo-agente. D’importanza, la sperimentazione in vivo rivela che il regime di combinazione è ben tollerato. Questo protocollo permette la valutazione efficace di combinazioni di farmaci anticancro in modelli preclinici e l’identificazione della combinazione razionale per valutare in studi clinici.
Introduction
L’approccio convenzionale nel trattamento di un gran numero di diversi tipi di cancro si basava sul monotherapy. Anche se è ancora usato in molti casi, questo metodo ha incontrato diversi ostacoli che conduce a optare per terapie combinate2. In particolare, le cellule tumorali sono più suscettibili a sviluppare resistenza quando trattati con un farmaco singolo inducendo sopravvivenza alternativo meccanismi3, con conseguente fallimento terapeutico in pazienti4. Inoltre, in monoterapia, farmaci sono solitamente somministrati a dosi elevate. Questa situazione spesso provoca il verificarsi di forti effetti collaterali dose-dipendente che può essere intollerabile e imporre ai medici di interrompere il trattamento2. Per questi motivi, l’associazione di molecole antitumorali è ora preferito alla monoterapia.
Combinazioni di farmaci ideale sarebbero quelli che agiscono in sinergia contro le cellule del tumore, senza tossicità aumentata contro le cellule normali. Sinergismo si riferisce all’interazione di due o più farmaci che produce un effetto terapeutico maggiore della somma di ogni singola sostanza operano separatamente. Tali interazioni possono provocare una maggiore efficacia terapeutica clinica2. Limita la resistenza al trattamento, aumenta l’efficacia e può anche ridurre la tossicità2. Infatti, il dosaggio di ogni farmaco può essere ridotto per abbassare i loro effetti collaterali mirando alle vie differenti. Inoltre, una delle molecole può anche servire come un agente di sensibilizzazione contro le cellule tumorali. L’effetto del farmaco secondo può essere migliorata sulle cellule sensibilizzate e dosaggi meno possono essere usato5.
Terapia combinata può includere due o più farmaci chemioterapici e/o prodotti biologici, come gli anticorpi monoclonali6. Questi anticorpi monoclonali specificamente le cellule che esprimono un antigene di superficie delle cellule di interesse e sono in grado di uccidere le cellule tumorali attraverso vie immunologiche compreso citotossicità cellulo-mediata anticorpo-dipendente (ADCC), con il coinvolgimento di cellule immunitarie effettrici 7e citotossicità complemento-dipendente (CDC)6. Essi possono anche agire tramite un meccanismo non immunologico mediato da apoptosi8,9,10,11. In questo caso, l’induzione del processo di morte programmata delle cellule può sensibilizzare le cellule tumorali, indebolire la loro funzione e rendere più efficace il farmaco chemioterapico associato ad un dosaggio più basso. Come tale, proapoptotic mAb sono buoni candidati per la progettazione di regimi di combinazione con farmaci antineoplastici.
Sono stati descritti diversi modelli matematici per valutare il sinergismo della droga; uno di loro si basa sulla combinazione indice metodo1. Questo metodo si basa sul principio di effetto mediano sviluppato da Chou1. L’effetto mediano equazione correla la dose di farmaco e l’effetto della droga come segue.
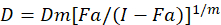
Qui, D è la dose di droga; DM è la dose mediana-effetto; Fa è la frazione influenzata dalla dose; m è un esponente che indica la forma della dose-effetto trama1. La dose mediana-effetto viene utilizzata per calcolare la dose Dx di un farmaco che inibisce o uccide “x” per cento delle cellule. Il valore CI viene quindi calcolato per valutare l’effetto additivo della combinazione del farmaco, come segue1.
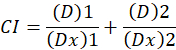
CI il valore 1 indica un effetto additivo e un valore di CI di 1 indica antagonismo1. L’applicazione di questo metodo è ulteriormente facilitato dalla disponibilità di un programma per computer, CompuSyn, che determina sinergismo ed antagonismo a tutte le dosi o livelli di effetto simulato automaticamente12.
Il nostro gruppo ha sviluppato la specifica di 8B6 mAb per O-acetile-GD2 ganglioside (OAcGD2) di neuroblastoma antigene13 e ulteriormente dimostrato che questa mAb è in grado di indurre la morte delle cellule con gli attributi di apoptosi11. Per verificare se mAb 8B6 può sensibilizzare le cellule di neuroblastoma per il topotecan agente antineoplastico, abbiamo adattato il suddetto metodo sviluppato da Chou1. In primo luogo, determiniamo i valori (ED50) 50 di dose efficace di mAb 8B6 e topotecan. Successivamente, le cellule di neuroblastoma con rapporti di uguale potenza dei due composti in base ai valori di50 ED esposte per determinare i valori di CI utilizzando il software di simulazione di cui sopra. Questo metodo permette di dimostrare il sinergismo fra mAb 8B6 e topotecan in vitro. Successivamente, descriviamo un protocollo per valutare ulteriormente la potenza e la sicurezza di questa combinazione regime in vivo. Questo protocollo può essere facilmente applicato per selezionare mAb anticancro potente e sicuro e combinazioni dell’agente chemioterapeutico negli studi preclinici. Una rappresentazione schematica di questo studio è fornita nella Figura 1.
Protocol
Representative Results
Discussion
Per prevedere l’effetto di interazione farmacologica, tre metodi possono essere utilizzati: la metodologia di isobologram17, la miscela non lineare modello18e la combinazione di indice1. Analisi dell’indice di combinazione sono il più comunemente usato perché la sua applicazione è semplificata dalla disponibilità di un programma per computer facile da usare. Per questo scopo, abbiamo caratterizzato in primo luogo la risposta dose-effetto di ogni …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Concedere il sostegno: Fondation de Projet de L ‘Université de Nantes, les Bagouz’ à Manon, La Ligue contre le Cancer comité de Loire-Atlantique, comité du Morbihan e comité de Vendée, une rosa versare S.A.R.A.H, L’Etoile de Martin e la Société Française de Lutte contre les I cancri et les leucémies de l’enfant et de L’adolescent (SFCE). M.B. e J.F. sono supportati da La Ligue Contre Le Cancer. Gli autori ringraziano l’UTE-impianto della struttura Fédérative de Recherche François Bonamy. Gli autori ringraziano anche Dr. S. Suzin (Inserm, Parigi) per fornire le cellule IMR5 e Sig. ra H. Estéphan per la sua assistenza tecnica.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
References
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. 암 연구학. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. 암 연구학. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

