Klinisk protokol producere fedtvæv-afledte stromale vaskulære brøkdel for potentielle brusk regenerering
Summary
Vi præsenterer her, en protokol for at producere en fedtvæv-afledte stromale vaskulære fraktion og dens anvendelse til at forbedre knæ funktioner ved at regenerere brusk-lignende vævet i menneskelige patienter med slidgigt.
Abstract
Osteoarthritis (OA) er en af de mest almindelige invaliderende lidelser. For nylig er sket talrige forsøg på at forbedre funktionerne i knæene ved hjælp af forskellige former for mesenchymale stamceller (msc). I Korea, knoglemarv koncentrater og ledningen er blod-afledte stamceller blevet godkendt af Korean Food and Drug Administration (KFDA) til brusk regenerering. Derudover har en fedtvæv-afledte stromale vaskulære brøkdel (SVF) fået lov af KFDA for fælles indsprøjtninger i menneskelige patienter. Autolog fedtvæv-afledte SVF indeholder ekstracellulære matrix (ECM) ud over mesenkymale stamceller. ECM udskiller forskellige cytokiner, der sammen med hyaluronsyre (HA) og trombocyttal-rich plasma (PRP) aktiveret af calcium chlorid, kan hjælpe MSCs at regenerere brusk og forbedre knæ funktioner. I denne artikel præsenterede vi en protokol for at forbedre knæ funktioner ved at regenerere brusk-lignende vævet i menneskelige patienter med OA. Resultatet af protokollen blev først rapporteret i 2011 efterfulgt af et par supplerende publikationer. Protokollen indebærer Fedtsugning for at opnå autologe lipoaspirates, der er blandet med collagenase. Denne lipoaspirates-collagenase blanding er derefter klippe og homogeniseret for at fjerne store fibrøst væv, der kan tilstoppe nålen under injektionen. Bagefter er blandingen udruget for at opnå fedtvæv-afledte SVF. Den resulterende fedtvæv-afledte SVF, der indeholder både fedtvæv-afledte MSCs og resterne af ECM, sprøjtes ind i knæ af patienter, kombineret med HA og calciumchlorid aktiveret PRP. Inkluderet er tre tilfælde af patienter, der blev behandlet med vores protokol, hvilket resulterer i forbedringer af knæet smerter, hævelse og vifte af bevægelse sammen med Mr bevis for hyaline brusk-lignende væv.
Introduction
Mesenchymale stamceller (msc) er kendt for at have kapacitet til at regenerere brusk1,2,3,4,5,6. De let kan fremskaffes fra forskellige kilder: knoglemarven, navlestrengsblod og fedtvæv blandt mange andre. Blandt disse kilder er fedtvæv den eneste kilde, hvor et tilstrækkeligt antal MSCs kan fås uden nogen kultur udvidelse til at regenerere brusk i klinisk indstillinger7,8. Autolog knoglemarv stromale vaskulære brøkdel (SVF) kan nemt opnået så godt. Antallet af stamceller, der er indeholdt i ikke-kultur udvidet marv er imidlertid meget lav7,8. Navlestrengsblod kan indeholde et tilstrækkeligt antal MSCs. Navlestrengsblod er imidlertid ikke en let tilgængelig kilde til autolog SVF.
Talrige metoder til forarbejdning fedtvæv at opnå SVF er tilgængelige til kliniske applikationer. Blandt disse metode til at opnå MSCs fra fedtvæv bruger collagenase, udviklet og bekræftet af Zuk et al. 5 , 6, er blevet meget godt modtaget. Denne metode til at bruge collagenase er blevet ændret til kliniske applikationer i ortopædi. For at blive anvendt til kliniske indstillinger, skal være et lukket system til at opretholde steriliteten samtidig holde bekvemmelighed. En bestemt ændring præsenteret i denne artikel omfatter homogenisering af lipoaspirates. Lille størrelse lipoaspirates er fordøjet relativt hurtigere end de større, resulterer i en ujævn fordeling af fedtvæv. Desuden kan disse større mellemstore lipoaspirates producere fibrøst væv, der kan tilstoppe sprøjter og nåle mens de udfører fælles indsprøjtninger9,10. For at undgå disse problemer, kan lipoaspirates homogeniseret ved skæring og hakkes lipoaspirates før inkubation med collagenase. Den resulterende fedtvæv-afledte SVF kan indeholde mere ensartet ekstracellulære matrix (ECM) i forhold til lipoaspirates, der ikke er homogeniseret11. Den havarerede ECM indeholdt i SVF kan arbejde som et stillads12.
I 2009, er autologe fedtvæv-afledte SVF tilladt af Korean Food and Drug Administration (KFDA) når behandles inden for en medicinsk facilitet med minimal behandling af en læge13. Bagefter, autolog fedtvæv-afledte SVF har været udnyttet som en potentiel agent til at forbedre knæ funktion i osteoarthritis (OA) patienter af potentielt regenerere brusk-lignende væv10,14,15 , 16 , 17 , 18 .
I 2011 viste Pak for første gang at fedtvæv-afledte stamceller (ASCs) indeholdt i fedtvæv-afledte SVF kan forbedre knæ funktioner potentielt regenerere brusk-lignende vævet i menneskets OA patienter når injiceres med trombocyt-rige plasma (PRP) 14. Derudover har Pak et al. rapporteret sikkerhedsdata i 2013 der involverer 91 patienter. Den gennemsnitlige effektivitet sats rapporteret i dette sikkerhedsdatablad var 67%15. Efterfølgende yderligere undersøgelser af Pak et al. viste forbedret knæ funktioner potentielt på grund af brusk-lignende væv revitalisering hos patienter med en menisken tåre og chondromalacia patellae10,16,17 ,18. Baseret på artikel rapporteret, er det kendt, at antallet af stamceller i 100 g af fedtvæv behandles af den protokol, der er præsenteret i denne artikel kan variere fra 1.000.000-40.000.000 afhængigt af patienters karakteristika8, 19 , 20 , 21 , 22 , 23.
Vi præsenterer her, en klinisk protokol af menneskelige knæ OA ved hjælp af autologe fedtvæv-afledte SVF med HA og PRP aktiveret med calciumchlorid. Den første version af denne klinisk protokol, der involverer en lukket, manuel system for at bevare steriliteten, blev rapporteret i 201114. Identiske protokollen blev optimeret, opretholde sterilitet, og blev rapporteret i 2013 og 201610,15. Her præsenteres den optimerede protokol. Den skematiske oversigt over protokollen er præsenteret i figur 1.
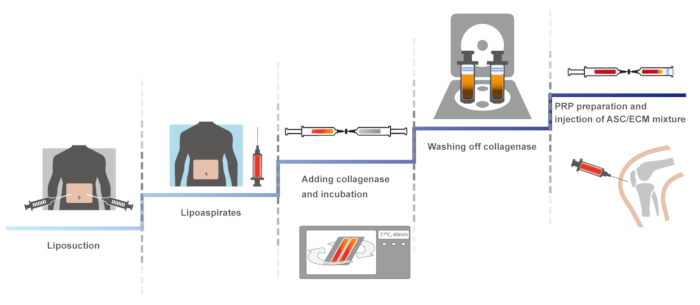
Figur 1: skematisk oversigt over protokollen. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
I 2001, Zuk mfl. isolerede stamceller fra fedtvæv ved at nedbryde kollagen matrix med collagenase6. Bagefter, gruppen viste, at disse stamceller isoleret fra fedtvæv kunne omdanne brusk og andre væv af mesoderm oprindelse, at bevise, at disse stamceller var mesenchymale oprindelse.
Ligeledes, den procedure, der er præsenteret i denne artikel er en modificeret protokol at anvende den samme metode til menneskelige patienter. Den vigtigste ændring af protokol…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatteren erkender støtte fra personale Mipro Lægeklinik og figur design af Jaepil/David Lee. Dette arbejde blev støttet af forskningstilskud fra Bio & medicinsk teknologi Development Program af NRF finansieret af MSIT (antal NRF-2017M3A9E4078014); og den nationale forskning fundament af Korea (NRF) finansieret af Ministeriet for videnskab og IKT (numre NRF-2017R1A2B4002315 og NRF-2016R1C1B2010308).
Materials
| Material | |||
| 5% Betadine (povidone-iodine) | Firson Co., Ltd. | 657400260 | |
| 2% Lidocaine | Daehan Pharmaceutical Co. | 670603480 | |
| Tumescent solution | Myungmoon Pharm. Co. Ltd. | N01BB01 | The solution was composed of 500 mL normal saline, 40 mL 2% lidocaine, 20 mL 0.5% marcaine, and 0.5 mL epinephrine 1:1000. |
| Liberase TL and TM research grade | Roche Applied Science | 5401020001 | |
| D5LR | Dahan Pharm. Co., Ltd. | 645101072 | Dextrose 5% in lactated Ringer's solution |
| Anticoagulant citrate dextrose solution | Fenwal, Inc. | NDC:0942-0641 | The solution was composed of 0.8% citric acid, 0.22% sodium citrate, and 0.223% dextrose. |
| 3% (w/v) Calcium chloride | Choongwae Pharmaceutical Co. | 644902101 | |
| 0.5% (w/v) HA (Hyaluronic acid ) | Dongkwang pharm. Co., Ltd. | 645902030 | |
| 0.25% Ropivacaine | Huons Co., Ltd. | 670600150 | |
| Equipment | |||
| 3.0 mm Cannula | WOOJU Medical Instruments Co. | ML30200 | |
| 60-mL Luer-Lock syringe | BD (Becton Dickinson) | 309653 | |
| Centrifuge Barrel Kit | CPL Co., Ltd. | 30-0827044 | |
| Tissue homogenizer that contains blades | CPL Co., Ltd. | 30-0827045 | |
| Rotating incubator mixer | Medikan Co., Ltd | MS02060092 | |
| Centrifuge | Hanil Scientific Inc. | CE1133 | |
| Magnetic Resonance Imaging | Philips Medical Systems Inc. | 18068 | |
| Ultrasound Imaging System | Samsung Medison co., Ltd | CT-LK-V10-ICM-09.05.2007 |
References
- Arnoczky, S. P. Building a meniscus. Biologic considerations. Clinical Orthopaedics and Related Research. (367 Suppl), S244-S253 (1999).
- Barry, F. P. Mesenchymal stem cell therapy in joint disease. Novartis Foundation Symposium. 249, 86-241 (2003).
- Usuelli, F. G., et al. Adipose-derived stem cells in orthopaedic pathologies. British Medical Bulletin. 124 (1), 31-54 (2017).
- Zhang, H. N., Li, L., Leng, P., Wang, Y. Z., Lv, C. Y. Uninduced adipose-derived stem cells repair the defect of full-thickness hyaline cartilage. Chinese Journal of Traumatology. 12 (2), 92-97 (2009).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 13 (12), 4279-4295 (2002).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 7 (2), 211-228 (2001).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: tissue localization, characterization, and heterogeneity. Stem Cells International. 2012, 812693 (2012).
- Zhu, Y., et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochemistry and Function. 26 (6), 664-675 (2008).
- Bellei, B., Migliano, E., Tedesco, M., Caputo, S., Picardo, M. Maximizing non-enzymatic methods for harvesting adipose-derived stem from lipoaspirate: technical considerations and clinical implications for regenerative surgery. Scientific Reports. 7 (1), 10015 (2017).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of Cartilage in Human Knee Osteoarthritis with Autologous Adipose Tissue-Derived Stem Cells and Autologous Extracellular Matrix. BioResearch Open Access. 5 (1), 192-200 (2016).
- Alexander, R. W. Understanding Adipose-derived Stromal Vascular Fraction (AD-SVF) Cell Biology and Use on the Basis of Cellular, Chemical, Structural and Paracrine Components: A Concise Review. Journal of Prolotherapy. 4, e855-e869 (2012).
- Benders, K. E., et al. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 31 (3), 169-176 (2013).
- Korean Food and Drug Administration (KFDA). Cell therapy: Rules and Regulations. KFDA. , (2009).
- Pak, J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of Medical Case Reports. 5, 296 (2011).
- Pak, J., Chang, J. J., Lee, J. H., Lee, S. H. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskeletal Disorders. 14, 337 (2013).
- Pak, J., Lee, J. H., Kartolo, W. A., Lee, S. H. Cartilage Regeneration in Human with Adipose Tissue-Derived Stem Cells: Current Status in Clinical Implications. BioMed Research International. 2016, 4702674 (2016).
- Pak, J., Lee, J. H., Lee, S. H. A novel biological approach to treat chondromalacia patellae. PLoS One. 8 (5), e64569 (2013).
- Pak, J., Lee, J. H., Lee, S. H. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. BioMed Research International. 2014, 436029 (2014).
- Aust, L., et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 6 (1), 7-14 (2004).
- De Ugarte, D. A., et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs. 174 (3), 101-109 (2003).
- Guilak, F., et al. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. Journal of Cellular Physiology. 206 (1), 229-237 (2006).
- Mitchell, J. B., et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24 (2), 376-385 (2006).
- Oedayrajsingh-Varma, M. J., et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 8 (2), 166-177 (2006).
- . Liberase TL information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/05401020001?lang=en®ion=US (2018)
- . Liberase TM information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/Libtmro?lang=en®ion=US (2018)
- Childs, J. D., Piva, S. R. Psychometric properties of the functional rating index in patients with low back pain. European Spine Journal. 14 (10), 1008-1012 (2005).
- Price, D. D., McGrath, P. A., Rafii, A., Buckingham, B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17 (1), 45-56 (1983).
- Pilgaard, L., Lund, P., Rasmussen, J. G., Fink, T., Zachar, V. Comparative analysis of highly defined proteases for the isolation of adipose tissue-derived stem cells. Regenerative Medicine. 3 (5), 705-715 (2008).
- D’Ambrosi, R., Indino, C., Maccario, C., Manzi, L., Usuelli, F. G. Autologous Microfractured and Purified Adipose Tissue for Arthroscopic Management of Osteochondral Lesions of the Talus. Journal of Visualized Experiments. (131), e56395 (2018).
- Packer, J. D., Chang, W. T., Dragoo, J. L. The use of vibrational energy to isolate adipose-derived stem cells. Plastic Reconstructive Surgery-Global Open. 6 (1), e1620 (2018).
- Hanke, C. W., Bernstein, G., Bullock, S. Safety of tumescent liposuction in 15,336 patients. National survey results. Dermatologic Surgery. 21 (5), 459-462 (1995).
- Illouz, Y. G. Complications of liposuction. Clinics in Plastic Surgery. 33 (1), 129-163 (2006).
- Dixit, V. V., Wagh, M. S. Unfavourable outcomes of liposuction and their management. Indian Journal of Plastic Surgery. 46 (2), 377-392 (2013).
- Lehnhardt, M., et al. Major and lethal complications of liposuction: a review of 72 cases in Germany between 1998 and 2002. Plastic and Reconstructive Surgery. 121 (6), 396e-403e (2008).
- Iyer, S. S., Rojas, M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opinion on Biological Therapy. 8 (5), 569-581 (2008).
- Zhang, J., Middleton, K. K., Fu, F. H., Im, H. J., Wang, J. H. HGF mediates the anti-inflammatory effects of PRP on injured tendons. PLoS One. 8 (6), e67303 (2013).
- Li, N. Y., Yuan, R. T., Chen, T., Chen, L. Q., Jin, X. M. Effect of platelet-rich plasma and latissimus dorsi muscle flap on osteogenesis and vascularization of tissue-engineered bone in dogs. Journal of Oral and Maxillofacial Surgery. 67 (9), 1850-1858 (2009).
- Parsons, P., et al. The biological effect of platelet rich-plasma on the fracture healing process. The Journal of bone and joint surgery. British volume. 91-B, 293 (2009).
- Wu, W., Chen, F., Liu, Y., Ma, Q., Mao, T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. Journal of Oral and Maxillofacial Surgery. 65 (10), 1951-1957 (2007).
- Cooper, T. W., Eisen, A. Z., Stricklin, G. P., Welgus, H. G. Platelet-derived collagenase inhibitor: characterization and subcellular localization. Proceedings of the National Academy of Sciences of the United States of America. 82 (9), 2779-2783 (1985).
- Uzuki, M., Sawai, T. A. A comparison of the affinity of sodium hyaluronate of various molecular weights for degenerated cartilage: a histochemical study using hyaluronic acid binding protein. International Congress Series. 1223, 279-284 (2001).
- Pagano, C., et al. Molecular and morphometric description of adipose tissue during weight changes: a quantitative tool for assessment of tissue texture. International Journal of Molecular Medicine. 14 (5), 897-902 (2004).

