Protocolo clínico de produzir tecido adiposo-derivado do estroma Vascular fração para a regeneração da cartilagem potenciais
Summary
Aqui, apresentamos um protocolo para produzir uma tecido adiposo-derivado do estroma vascular fração e sua aplicação para melhorar as funções de joelho Regenerando o tecido da cartilagem, como em pacientes humanos com osteoartrite.
Abstract
Osteoartrite (OA) é uma das mais comuns doenças debilitantes. Recentemente, várias tentativas foram feitas para melhorar as funções dos joelhos usando diferentes formas de células-tronco mesenquimais (MSCs). Na Coreia, concentrados de medula óssea e cordão hemoderivados células-tronco foram aprovadas pela Korean Food and Drug Administration (KFDA) para regeneração da cartilagem. Além disso, uma tecido adiposo-derivado do estroma vascular fração (SVF) foi autorizada pelo KFDA para injeções conjuntas em pacientes humanos. SVF autóloga derivadas de tecido adiposo contém matriz extracelular (ECM), além de células-tronco mesenquimais. ECM excreta várias citocinas que, juntamente com o ácido hialurónico (HA) e o plasma rico em plaquetas (PRP) ativado pelo cloreto de cálcio, podem ajudar o MSCs para regenerar a cartilagem e melhorar as funções do joelho. Neste artigo, apresentamos um protocolo para melhorar as funções do joelho Regenerando o tecido da cartilagem, como em pacientes humanos com OA. O resultado do protocolo foi primeiramente relatado em 2011, seguido por algumas publicações adicionais. O protocolo envolve lipoaspiração para obter lipoaspirates autólogo que são misturados com colagenase. Esta mistura de lipoaspirates-colagenase é então cortada e homogeneizada para remover grandes de tecido fibroso que pode entupir a agulha durante a injeção. Depois disso, a mistura é incubada para obter SVF derivadas de tecido adiposo. O resultante SVF derivadas de tecido adiposo, contendo tecido adiposo-derivado MSCs e restos de ECM, é injetado em joelhos de pacientes, combinados com HA e cloreto de cálcio ativado PRP. Incluem-se três casos de pacientes que foram tratados com nosso protocolo, resultando em melhora da amplitude de movimento, juntamente com provas de MRI de cartilagem hialina, como tecido, inchaço e dor no joelho.
Introduction
Células-tronco mesenquimais (MSCs) são conhecidas por terem a capacidade de regenerar a cartilagem1,2,3,4,5,6. Elas podem ser facilmente obtidas de várias fontes: sangue do cordão umbilical, medula óssea e tecido adiposo, entre muitos outros. Entre essas fontes, o tecido adiposo é a única fonte onde um número suficiente de MSCs pode ser obtido sem qualquer expansão da cultura para regenerar a cartilagem em ambientes clínicos7,8. Autólogo de medula óssea do estroma vascular fração (SVF) pode ser facilmente obtida também. No entanto, o número de células-tronco contida na medula expandida não-cultura é muito baixa7,8. Sangue do cordão umbilical pode conter um número suficiente de MSCs. No entanto, o sangue do cordão umbilical não é uma fonte prontamente disponível de SVF autólogo.
Numerosos métodos de processamento de tecido adiposo para obter SVF estão disponíveis para aplicações clínicas. Entre estes, o método de obtenção MSCs de tecido adiposo usando colagenase, desenvolvida e confirmada pelo Zuk et al 5 , 6, é muito bem aceito. Este método de usar colagenase foi modificado para aplicações clínicas em Ortopedia. A fim de ser aplicada a situações clínicas, o sistema deve ser um sistema fechado para manter a esterilidade, mantendo a conveniência. Uma modificação particular apresentada neste artigo envolve homogeneização do lipoaspirates. Lipoaspirates tamanhos pequenos são digeridos relativamente mais rápido do que os maiores que estão resultando na repartição desigual de tecido adiposo. Além disso, estes lipoaspirates de tamanhos maiores pode produzir tecidos fibrosos que podem entupir as seringas e agulhas durante a execução conjunta de injeções9,10. Para evitar esses problemas, o lipoaspirates pode ser homogeneizado por corte e picagem a lipoaspirates antes da incubação com colagenase. O SVF derivadas de tecido adiposo resultante pode conter mais uniforme da matriz extracelular (ECM) em comparação com lipoaspirates que não são homogeneizadas11. O ECM quebrado contido o SVF pode funcionar como um andaime12.
Em 2009, foi autorizada pela Korean Food and Drug Administration (KFDA) quando processado dentro de uma instalação médica com processamento mínimo, por um médico13SVF autóloga derivadas de tecido adiposo. Depois, SVF autóloga derivadas de tecido adiposo tem sido utilizada como um agente potencial para melhorar as funções do joelho em pacientes de osteoartrite (OA) potencialmente regenerando tecido de cartilagem, como10,14,15 , 16 , 17 , 18 .
Em 2011, Pak mostrou pela primeira vez que derivadas de tecido adiposo as células-tronco (ASCs) contidas no SVF derivadas de tecido adiposo podem melhorar as funções de joelho potencialmente regenerar o tecido da cartilagem, como em pacientes humanos de OA quando injetado com rico em plaquetas plasma (PRP) 14. Além disso, Pak et al relataram dados de segurança em 2013 envolvendo 91 pacientes. A taxa de eficácia média relatada nesses dados de segurança foi 67%15. Posteriormente, estudos adicionais por Pak et al mostraram joelho melhorou funções potencialmente devido a regeneração do tecido de cartilagem, como em pacientes com um menisco lacrimal e condromalacia patelas10,16,17 ,18. Com base em artigos relatados, é sabido que o número de células-tronco contida em 100 g de tecido adiposo processado pelo protocolo apresentado neste artigo pode variar de 1.000.000-40,000,000 dependendo características8, dos pacientes 19 , 20 , 21 , 22 , 23.
Aqui, apresentamos um protocolo clínico do joelho humano OA usando SVF autóloga derivadas de tecido adiposo com HA e PRP ativado com cloreto de cálcio. A primeira versão do presente protocolo clínico, envolvendo um sistema fechado, manual para manter a esterilidade, foi relatada em 201114. O protocolo idêntico foi otimizado, manutenção de esterilidade e foi relatado em 2013 e 201610,15. Aqui, o protocolo otimizado é apresentado. A visão esquemática do protocolo é apresentado na Figura 1.
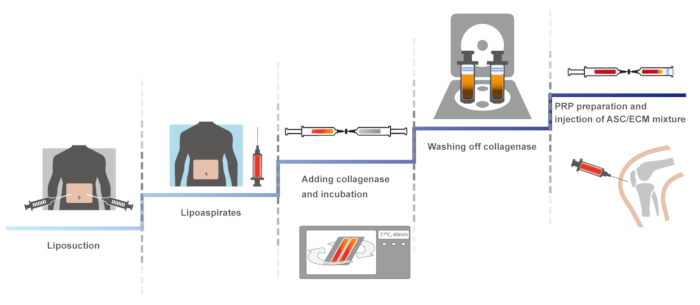
Figura 1: A visão esquemática do protocolo. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Em 2001, Zuk et al. células-tronco isoladas de tecido adiposo por quebrar a matriz de colágeno com colagenase6. Depois, o grupo mostrou que essas células-tronco isoladas de tecido adiposo pode transformar em cartilagem e outros tecidos da mesoderme, na origem, provando que essas células-tronco eram mesenquimais na origem.
Da mesma forma, o procedimento apresentado neste artigo é um protocolo modificado para aplicar o método semelhante para pacientes human…
Disclosures
The authors have nothing to disclose.
Acknowledgements
O autor reconhece que o apoio da equipe do Mipro clínica médica e o desenho de figura por Mariana/David Lee. Este trabalho foi apoiado por bolsas de investigação do Bio & programa de desenvolvimento de tecnologia médica da NRF financiada pelo MSIT (número NRF-2017M3A9E4078014); e o nacional Research Foundation da Coreia (NRF) financiado pelo Ministério da ciência e TIC (números NRF-2017R1A2B4002315 e NRF-2016R1C1B2010308).
Materials
| Material | |||
| 5% Betadine (povidone-iodine) | Firson Co., Ltd. | 657400260 | |
| 2% Lidocaine | Daehan Pharmaceutical Co. | 670603480 | |
| Tumescent solution | Myungmoon Pharm. Co. Ltd. | N01BB01 | The solution was composed of 500 mL normal saline, 40 mL 2% lidocaine, 20 mL 0.5% marcaine, and 0.5 mL epinephrine 1:1000. |
| Liberase TL and TM research grade | Roche Applied Science | 5401020001 | |
| D5LR | Dahan Pharm. Co., Ltd. | 645101072 | Dextrose 5% in lactated Ringer's solution |
| Anticoagulant citrate dextrose solution | Fenwal, Inc. | NDC:0942-0641 | The solution was composed of 0.8% citric acid, 0.22% sodium citrate, and 0.223% dextrose. |
| 3% (w/v) Calcium chloride | Choongwae Pharmaceutical Co. | 644902101 | |
| 0.5% (w/v) HA (Hyaluronic acid ) | Dongkwang pharm. Co., Ltd. | 645902030 | |
| 0.25% Ropivacaine | Huons Co., Ltd. | 670600150 | |
| Equipment | |||
| 3.0 mm Cannula | WOOJU Medical Instruments Co. | ML30200 | |
| 60-mL Luer-Lock syringe | BD (Becton Dickinson) | 309653 | |
| Centrifuge Barrel Kit | CPL Co., Ltd. | 30-0827044 | |
| Tissue homogenizer that contains blades | CPL Co., Ltd. | 30-0827045 | |
| Rotating incubator mixer | Medikan Co., Ltd | MS02060092 | |
| Centrifuge | Hanil Scientific Inc. | CE1133 | |
| Magnetic Resonance Imaging | Philips Medical Systems Inc. | 18068 | |
| Ultrasound Imaging System | Samsung Medison co., Ltd | CT-LK-V10-ICM-09.05.2007 |
References
- Arnoczky, S. P. Building a meniscus. Biologic considerations. Clinical Orthopaedics and Related Research. (367 Suppl), S244-S253 (1999).
- Barry, F. P. Mesenchymal stem cell therapy in joint disease. Novartis Foundation Symposium. 249, 86-241 (2003).
- Usuelli, F. G., et al. Adipose-derived stem cells in orthopaedic pathologies. British Medical Bulletin. 124 (1), 31-54 (2017).
- Zhang, H. N., Li, L., Leng, P., Wang, Y. Z., Lv, C. Y. Uninduced adipose-derived stem cells repair the defect of full-thickness hyaline cartilage. Chinese Journal of Traumatology. 12 (2), 92-97 (2009).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 13 (12), 4279-4295 (2002).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 7 (2), 211-228 (2001).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: tissue localization, characterization, and heterogeneity. Stem Cells International. 2012, 812693 (2012).
- Zhu, Y., et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochemistry and Function. 26 (6), 664-675 (2008).
- Bellei, B., Migliano, E., Tedesco, M., Caputo, S., Picardo, M. Maximizing non-enzymatic methods for harvesting adipose-derived stem from lipoaspirate: technical considerations and clinical implications for regenerative surgery. Scientific Reports. 7 (1), 10015 (2017).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of Cartilage in Human Knee Osteoarthritis with Autologous Adipose Tissue-Derived Stem Cells and Autologous Extracellular Matrix. BioResearch Open Access. 5 (1), 192-200 (2016).
- Alexander, R. W. Understanding Adipose-derived Stromal Vascular Fraction (AD-SVF) Cell Biology and Use on the Basis of Cellular, Chemical, Structural and Paracrine Components: A Concise Review. Journal of Prolotherapy. 4, e855-e869 (2012).
- Benders, K. E., et al. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 31 (3), 169-176 (2013).
- Korean Food and Drug Administration (KFDA). Cell therapy: Rules and Regulations. KFDA. , (2009).
- Pak, J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of Medical Case Reports. 5, 296 (2011).
- Pak, J., Chang, J. J., Lee, J. H., Lee, S. H. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskeletal Disorders. 14, 337 (2013).
- Pak, J., Lee, J. H., Kartolo, W. A., Lee, S. H. Cartilage Regeneration in Human with Adipose Tissue-Derived Stem Cells: Current Status in Clinical Implications. BioMed Research International. 2016, 4702674 (2016).
- Pak, J., Lee, J. H., Lee, S. H. A novel biological approach to treat chondromalacia patellae. PLoS One. 8 (5), e64569 (2013).
- Pak, J., Lee, J. H., Lee, S. H. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. BioMed Research International. 2014, 436029 (2014).
- Aust, L., et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 6 (1), 7-14 (2004).
- De Ugarte, D. A., et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs. 174 (3), 101-109 (2003).
- Guilak, F., et al. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. Journal of Cellular Physiology. 206 (1), 229-237 (2006).
- Mitchell, J. B., et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24 (2), 376-385 (2006).
- Oedayrajsingh-Varma, M. J., et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 8 (2), 166-177 (2006).
- . Liberase TL information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/05401020001?lang=en®ion=US (2018)
- . Liberase TM information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/Libtmro?lang=en®ion=US (2018)
- Childs, J. D., Piva, S. R. Psychometric properties of the functional rating index in patients with low back pain. European Spine Journal. 14 (10), 1008-1012 (2005).
- Price, D. D., McGrath, P. A., Rafii, A., Buckingham, B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17 (1), 45-56 (1983).
- Pilgaard, L., Lund, P., Rasmussen, J. G., Fink, T., Zachar, V. Comparative analysis of highly defined proteases for the isolation of adipose tissue-derived stem cells. Regenerative Medicine. 3 (5), 705-715 (2008).
- D’Ambrosi, R., Indino, C., Maccario, C., Manzi, L., Usuelli, F. G. Autologous Microfractured and Purified Adipose Tissue for Arthroscopic Management of Osteochondral Lesions of the Talus. Journal of Visualized Experiments. (131), e56395 (2018).
- Packer, J. D., Chang, W. T., Dragoo, J. L. The use of vibrational energy to isolate adipose-derived stem cells. Plastic Reconstructive Surgery-Global Open. 6 (1), e1620 (2018).
- Hanke, C. W., Bernstein, G., Bullock, S. Safety of tumescent liposuction in 15,336 patients. National survey results. Dermatologic Surgery. 21 (5), 459-462 (1995).
- Illouz, Y. G. Complications of liposuction. Clinics in Plastic Surgery. 33 (1), 129-163 (2006).
- Dixit, V. V., Wagh, M. S. Unfavourable outcomes of liposuction and their management. Indian Journal of Plastic Surgery. 46 (2), 377-392 (2013).
- Lehnhardt, M., et al. Major and lethal complications of liposuction: a review of 72 cases in Germany between 1998 and 2002. Plastic and Reconstructive Surgery. 121 (6), 396e-403e (2008).
- Iyer, S. S., Rojas, M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opinion on Biological Therapy. 8 (5), 569-581 (2008).
- Zhang, J., Middleton, K. K., Fu, F. H., Im, H. J., Wang, J. H. HGF mediates the anti-inflammatory effects of PRP on injured tendons. PLoS One. 8 (6), e67303 (2013).
- Li, N. Y., Yuan, R. T., Chen, T., Chen, L. Q., Jin, X. M. Effect of platelet-rich plasma and latissimus dorsi muscle flap on osteogenesis and vascularization of tissue-engineered bone in dogs. Journal of Oral and Maxillofacial Surgery. 67 (9), 1850-1858 (2009).
- Parsons, P., et al. The biological effect of platelet rich-plasma on the fracture healing process. The Journal of bone and joint surgery. British volume. 91-B, 293 (2009).
- Wu, W., Chen, F., Liu, Y., Ma, Q., Mao, T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. Journal of Oral and Maxillofacial Surgery. 65 (10), 1951-1957 (2007).
- Cooper, T. W., Eisen, A. Z., Stricklin, G. P., Welgus, H. G. Platelet-derived collagenase inhibitor: characterization and subcellular localization. Proceedings of the National Academy of Sciences of the United States of America. 82 (9), 2779-2783 (1985).
- Uzuki, M., Sawai, T. A. A comparison of the affinity of sodium hyaluronate of various molecular weights for degenerated cartilage: a histochemical study using hyaluronic acid binding protein. International Congress Series. 1223, 279-284 (2001).
- Pagano, C., et al. Molecular and morphometric description of adipose tissue during weight changes: a quantitative tool for assessment of tissue texture. International Journal of Molecular Medicine. 14 (5), 897-902 (2004).

