Assay ספקטרוסקופיה התנודות זריחה של אינטראקציות חלבון-חלבון באנשי קשר תא-תא
Summary
פרוטוקול זה מתאר פלורסצנטיות תנודות מבוסס-ספקטרוסקופיה בגישה לחקור אינטראקציות בין חלבונים מתווכים תא-תא אינטראקציות, כלומר חלבונים מותאם צמתי תא, ישירות בתאים חיים. אנו מספקים הנחיות מפורט על מכשיר כיול, חדרי קירור והקפאה, ניתוח, כולל תיקונים למקורות אפשריים החפץ.
Abstract
מגוון רחב של תהליכים ביולוגיים כרוך תא-תא אינטראקציות, מתווך בדרך כלל על ידי חלבונים המקיימים אינטראקציה בין תאים שכנים. עניין, רק כמה מבחני מסוגלים במיוחד חיטוט כזה אינטראקציות ישירות בתאים חיים. כאן, אנו מציגים assay כדי למדוד את הכריכה של חלבונים באה לידי ביטוי על פני השטח של התאים הסמוכים, תא-תא באנשי קשר. Assay זו מורכבת משני שלבים: ערבוב של תאים המבטאים את החלבונים עניין התמזגו חלבונים שונה פלורסנט, ואחריו קרינה פלואורסצנטית תנודות ספקטרוסקופיה מדידות-תא-תא אנשי קשר באמצעות לייזר קונפוקלי מיקרוסקופ סורק. נדגים את הכדאיות של זה וזמינותו בהקשר רלוונטי מבחינה ביולוגית על ידי מודד את האינטראקציה של החלבון קודמן דמוי עמילואיד 1 (APLP1) על פני תאים תאים צמתי. אנו מספקים פרוטוקולים מפורט על רכישת נתונים באמצעות טכניקות מבוססות קרינה פלואורסצנטית (סריקה קרינה פלואורסצנטית קרוס-המתאם ספקטרוסקופיה, קרוס-קורלציה למספר וניתוח בהירות) את הכיול כלי הנדרש. יתר על כן, נדון שלבים קריטיים ניתוח הנתונים וכיצד לזהות ולפתור וריאציות אות חיצוני, כדין, כגון אלה עקב photobleaching או תא תנועה.
באופן כללי, וזמינותו הציג ישימה לכל הומו – או אינטראקציית חלבון heterotypic תא-תא באנשי קשר, בין תאים סוגים זהים או שונים, יכול להיות מיושם על לייזר קונפוקלי מסחרי מיקרוסקופ סורק. דרישה חשובה היא היציבות של המערכת, אשר צריך להיות מספיק לחקור דינמיקה דיפוזיה של החלבונים עניין במשך מספר דקות.
Introduction
תהליכים ביולוגיים רבים להתרחש בכל האתרים של תא-תא אינטראקציות, למשל, תא-תא אדהזיה1,2,3, תא-cell fusion4 וזיהוי הסלולר5. אירועים כאלה חשובים במיוחד במהלך הפיתוח של אורגניזמים רב תאיים, תקשורת, למשל, במהלך תגובות מערכת החיסון. תהליכים אלה הם בדרך כלל בתיווך חלבונים אשר מותאמים על פני השטח, קרי, ב קרום פלזמה (PM) של תאים שכנים ומבצעת אינטראקציות ספציפיות-הקשר תא-תא כי הם בדיוק הזמן והמרחב מוסדר. במקרים רבים, אינטראקציות אלה ישירה הומו – או אינטראקציות חלבון heterotypic טרנס , אך עשוי גם לכלול יונים או ליגנדים מתנהג כמו linkers חוץ-תאי1. למרות חשיבות היסוד, יש מחסור של מבחני הבדיקה אינטראקציות חלבון-חלבון ספציפי אלה ישירות בסביבה הטבעית של תאים חיים. שיטות רבות דורשות גם לשבירת תאים (למשל, הביוכימי מבחני כגון co-immunoprecipitation6), קיבעון (למשל, כמה טכניקות במיקרוסקופ אופטי סופר רזולוציה ו מיקרוסקופ אלקטרונים של תא-תא קשר7), או שאינם ספציפיים, כגון: צבירת / מבחני אדהזיה8,9. כדי להתגבר על בעיה זו, טכניקות קרינה פלואורסצנטית יושמו מבוסס על קרינה פלואורסצנטית תהודה אנרגיה העברה (סריג)10 או קרינה פלואורסצנטית קומפלמנטציה11. עם זאת, כדי להשיג מספיק קטן המרחקים בין fluorophores, שיטות אלה דורשים תוויות פלורסנט בצד חוץ-תאי של חלבונים10, פוטנציאל מתנגש עם טרנס אינטראקציות.
כאן, אנו מציגים חלופי המבוסס על ידי קרינה פלואורסצנטית assay עבור אינטראקציות חלבון-חלבון תא-תא באנשי קשר. גישה זו משלבת גישות קרוס-המתאם קרינה פלואורסצנטית (סריקה קרינה פלואורסצנטית קרוס-המתאם ספקטרוסקופיה (sFCCS), מספר קרוס-המתאם ואת הבהירות (ccN & B)), ערבוב של תאים המבטאים בונה פיוז’ן של החלבון של . עניין, למשל, קולטן אדהזיה. קולטני ובדוקים בתאים שמעצבת שני מסומנות עם שני חלבונים פלורסנט spectrally מופרדים (FPs), מתאיים הצד (ראה איור 1 א’).
השיטות מועסקים מבוססים על ניתוח סטטיסטי של תנודות פלורסצנטיות המושרה על ידי התנועה דיפוזיה של פיוז’ן פלורסנט חלבונים דרך נפח מוקד של לייזר קונפוקלי מיקרוסקופ סורק. יותר בפירוט, וזמינותו רגשים פעפוע שיתוף של החלבונים עניין במחזור שני שכנים תא-תא באנשי קשר. אם החלבונים עוברים אינטראקציות טרנס , אלה מתחמי טרנס ויישא חלבונים פלורוסנט פולטות בשני ערוצים ספקטרלי, גורם תנודות פלורסצנטיות מתואם של שנינו פולטים. מצד שני, אם הכריכה לא מתרחשת, מספר תנודות של חלבונים מול PMs תהיה עצמאית, גורם תנודות לא מתואם. הרכישה יכול להתבצע בשתי דרכים: 1) sFCCS מבוסס על סריקה בצורת קו לאורך הקשר תא-תא, רגשים ביעילות את האינטראקציות במקום הממוקמים באזור הקשר. דרך ניתוח הטמפורלי של תנודות פלורסצנטיות, sFCCS מספקת גם מידע dynamics, קרי, מקדמי דיפוזיה של מתחמי חלבון; 2) ccN & B מבוססת על ניתוח pixel-wise של רצף של תמונות רכשה את האזורים קשר תא-תא. יש יכולת בדיקה של אינטראקציות מפה לאורך כל קשר עם איזור (ב מישור מוקד אחד), אך אינו מספק מידע על דינמיקה. שתי השיטות יכול להיות משולב עם ניתוח של הבהירות מולקולרית, קרי, האות הממוצע פלורסצנטיות הנפלטת ביחידת זמן אחת מתחמי חלבון באמצעי ולספק, לפיכך, הערכות של סטויכיומטריה של מתחמי חלבון- תא-תא אנשי קשר.
במאמר זה, אנו מספקים נתונים היסטוריים פרוטוקולים עבור הכנת הדוגמא, כיול המכשיר, רכישת נתונים וניתוח לבצע את הבדיקה הציג על לייזר קונפוקלי מסחרי מיקרוסקופ סורק. ניתן לבצע את הניסויים על כל כלי מצויד פוטון לספור או גלאי אנלוגי ולא אובייקטיבית עם מפתח נומרי גבוהה. אנו עוד יותר לדבר על שלבים קריטיים של הפרוטוקול, לספק ערכות תיקון עבור מספר תהליכי גורם תנודות אות artefactual, למשל, גלאי רעש, תנועה photobleaching או תא. פותח במקור כדי לחקור את האינטראקציות בין תאים חסיד, וזמינותו עשוי להיות שונה עבור השעיה תאים, או הותאם מודל ממברנה מערכות, למשל, unilamellar ענק שלפוחית (כשמרוגזים) או פלזמה ענקית קרום שלפוחית (GPMVs), המאפשר כימות של אינטראקציות בסביבות השומנים שונה או בהיעדר שלד התא מאורגן12,13.
סריקת קרינה פלואורסצנטית קרוס-המתאם ספקטרוסקופיה גירסה שונה של קרינה פלואורסצנטית קרוס-המתאם ספקטרוסקופיה14 , תוכננה במיוחד כדי לחקור דינמיקה דיפוזיה איטית השומנים ממברנות15. הוא מבוסס על רכישה סריקה קו בניצב רה מ המכיל את החלבונים פלואורסצנט עניין. כדי לחקור אינטראקציות של שני המינים חלבון שונה שכותרתו, הרכישה מתבצעת בשני ערוצים ספקטרלי באמצעות שני קווי לייזר, שני חלונות איתור עבור fluorophores spectrally מופרדים. בשל הדינמיקה דיפוזיה איטית של חלבונים ברה מ (D≤ ~ 1 /s2מיקרומטר), מידה קרוס-לדבר נטול יכול להתבצע על ידי לסירוגין את ערכת עירור משורת בשורה15. הניתוח מתחיל עם: 1) תיקון אלגוריתם יישור לתנועה לרוחב התא מבוסס על block-wise בממוצע של ~ 1000 שורות, 2) קביעת המיקום עם פלורסצנטיות המרביכלומר הממשלה מיקום האות, בכל בלוק, 3) הסטה של כל הבלוקים על נפוצות מקור12,15, בנפרד בכל אחד מהערוצים. לאחר מכן, מבחר אוטומטית של פיקסלים רה מ מתבצע על-ידי בחירה באזור המרכז התאמה לפי עקומת גאוס הסיכום של כל הקווים מיושר (קרי, מרכז ± 2.5σ). שילוב של האותות בכל שורה התשואות ממברנה פלורסצנטיות סדרת הזמן F(t) בכל אחד מהערוצים (g = ירוק ערוץ, r = הערוץ האדום). שים לב כי גודל פיקסל חייב להיות קטן מספיק, למשל, < 200 ננומטר, לשחזר את צורת הנקודה להפיץ את הפונקציה ולמצוא את המרכז שלו, המתאים למיקום של ראש הממשלה. בנוכחות photobleaching משמעותית, סדרת הזמן פלורסצנטיות בכל אחד מהערוצים ייתכן המודל עם פונקציה מעריכית-כפול ויש לאחר מכן תוקן עם הנוסחה הבאה:16
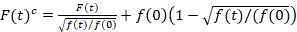 . (1)
. (1)
חשוב לציין כי נוסחה זו מתקנת ביעילות amplitudes והן דיפוזיה פעמים המתקבל ניתוח המתאם של F(t)c, לעומת הערכות פרמטר זה ניתן להשיג את שלא תוקנו F(t). ואז, הפונקציות אוטומטי – ואת הצלב-קורלציה (ACFs / CCFs) של קרינה פלואורסצנטית החישוב של אותות:
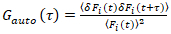 , (2).
, (2).
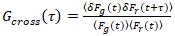 , (3).
, (3).
איפה אלפאFאני = Fאני(t) – 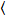 Fאני(t)
Fאני(t)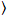 , ואני = g, r.
, ואני = g, r.
מודל דו מימדי דיפוזיה מצויד ואז המתאם לכל הפונקציות (CFs):
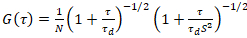 . (4)
. (4)
כאן, N מציין את מספר חלבונים פלורסנט אמצעי תצפית, τd הזמן דיפוזיה לכל ערוץ. מודל זה לוקח בחשבון כי בהגדרה ניסיוני המתואר, דיפוזיה של חלבונים ברה מ מתרחשת בתוך המטוס x-z, בניגוד נפוץ התצורה של המתאם פלורסצנטיות ספקטרוסקופיה (FCS) ניסויים ממברנות חיטוט דיפוזיה במישור x-y של נפח קונאפוקלית17. המותניים w0 והגורם מבנה S, המתארת את התארכות wz של אמצעי האחסון נקודתית ב- z, S = wz/w0, מתקבלים מ כיול נקודת FCS מדידה המבוצעת עם spectrally דומים צבעי והגדרות באותו האופטי באמצעות הערכים הזמינים כבר מקדם דיפוזיה Dצבע:
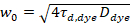 , (5).
, (5).
איפה τd, צבע זה הזמן נמדד פיזור ממוצע של מולקולות צבען, המתקבל מתאים למודל תלת מימדי דיפוזיה בנתונים, לוקח לתוך חשבון מעברים של השבר T של כל המולקולות N שלישיה המדינה עם קבוע הזמן ττ:
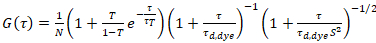 . (6)
. (6)
לבסוף, דיפוזיה (D), ערכי הבהירות מולקולרית (חדוה) והקבוע יחסית קרוס-הקורלציה של נתונים sFCCS (rel.cc.) מחושבים כדלהלן:
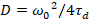 , (7).
, (7).
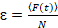 , (8).
, (8).
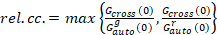 , (9).
, (9).
Gקרוס(0) איפה משרעת הפונקציה קרוס-קורלציה, 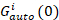 הוא משרעת הפונקציה autocorrelation בערוץ אני-th.
הוא משרעת הפונקציה autocorrelation בערוץ אני-th.
הגדרה זו של יחסי קרוס-המתאם, קרי שימוש מרבי במקום כלומר המשוואה 9, לוקח בחשבון את המספר המרבי של קומפלקסים של חלבונים שני מינים נוכח בריכוזים שונים הוא מוגבל על ידי מינים נוכח מספר נמוך יותר.
בהירות ומספר צלב-המתאם מבוסס על ניתוח רגע של עוצמת קרינה פלואורסצנטית לכל פיקסל של אוסף תמונות רכשה במשך הזמן במיקום קבוע במדגם, המורכב בדרך כלל ~ 100-200 מסגרות, עם שני ספקטרלי ערוצי ( g = ירוק ערוץ, r = הערוץ האדום). מהממוצע טמפורלית 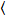 אני
אני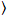 , ואני השונות
, ואני השונות 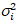 , הבהירות מולקולרית חדוהi ואת מספר nאני מחושבים ב כל פיקסל וערוץ ספקטרלי (אני = g, r)18:
, הבהירות מולקולרית חדוהi ואת מספר nאני מחושבים ב כל פיקסל וערוץ ספקטרלי (אני = g, r)18:
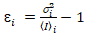 , (10).
, (10).
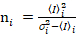 . (11)
. (11)
חשוב לציין כי המשוואות נתון חלים במקרה האידיאלי של גלאי ספירת פוטון אמיתי. עבור מערכות זיהוי אנלוגי, המשוואות הבאות חלות19,20:
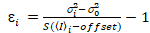 , (12).
, (12).
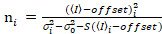 . (13)
. (13)
כאן, S הוא הגורם המרה בין פוטונים שזוהו הסעיפים דיגיטלי מוקלטות, 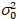 הוא רעש readout ואת היסט מתייחס ההיסט בעוצמה גלאי. באופן כללי, כמויות אלה צריכים להיות מכויל, עבור כל סוג הגלאי, המבוססת על מדידת השונות גלאי כפונקציה של עוצמת תאורה קבועה19, למשל, משטח מתכת רעיוני או פתרון דיי יבשים. היסט יכול להיקבע על ידי מדידת שיעור ספירה עבור דגימה ללא עירור אור. על ידי ביצוע רגרסיה ליניארית של השונות הקשורות גלאי
הוא רעש readout ואת היסט מתייחס ההיסט בעוצמה גלאי. באופן כללי, כמויות אלה צריכים להיות מכויל, עבור כל סוג הגלאי, המבוססת על מדידת השונות גלאי כפונקציה של עוצמת תאורה קבועה19, למשל, משטח מתכת רעיוני או פתרון דיי יבשים. היסט יכול להיקבע על ידי מדידת שיעור ספירה עבור דגימה ללא עירור אור. על ידי ביצוע רגרסיה ליניארית של השונות הקשורות גלאי 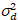 לעומת העוצמה (אני) העלילה, S ו
לעומת העוצמה (אני) העלילה, S ו 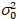 יכול להיות נחוש19:
יכול להיות נחוש19:
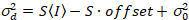 . (14)
. (14)
בסופו של דבר, הבהירות קרוס-המתאם מחושב בתוך כל פיקסל ולא מוגדר באופן כללי כמו21
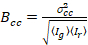 , (15).
, (15).
איפה 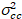 הוא קרוס-השונות
הוא קרוס-השונות 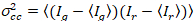 .
.
על מנת לסנן תנודות חיים ארוכים, כל ccN & B החישובים מבוצעים בעקבות קרון מטען סינון, באופן עצמאי עבור כל פיקסל22. בקצרה, ni, חדוהאני (אני = g, r) ו- Bcc מחושבים בהזזה מקטעים של למשל, 8-15 מסגרות. הערכים שהושג ובכך להיות בממוצע אז כדי להשיג הפיקסל האחרון מספר וערכי בהירות.
ניתוח סטויכיומטריה
כדי לאמוד את סטויכיומטריה של חלבון מתחמי תא-תא באנשי קשר, הבהירות מולקולרית ניתן בנפרד לנתח בכל אחד מהערוצים ספקטרליות עבור sFCCS או ccN & B נתונים. ב- sFCCS, מתקבל ערך הבהירות אחד לכל מדידה בכל ערוץ. ב ccN & B, היסטוגרמה הבהירות של פיקסלים כל הקשר תא-תא מתקבל, הערך הממוצע (או החציוני) יכול לשמש נציג בהירות למדידה. על ידי ביצוע הניתוח אותו על הפניה monomeric, כל ערכי הבהירות יכול להיות מנורמל להשיג ישירות מדינת oligomeric הממוצע מתחמי חלבון שזוהו. בנקודה זו, חשוב לתקן לנוכחות של FPs שאינו-פלורסנט שעלולים לגרום underestimation המדינה oligomeric. זה מתבצע בדרך כלל על ידי מודדים את הבהירות הפניה ההומו-dimeric חלבון23,24 באמצעות sFCS צבע אחד או מספר והבהירות (N & B).
Protocol
Representative Results
Discussion
ההליך ניסיוני המתוארים כאן מאפשר החקירה של חלבון טרנס אינטראקציות תא-תא באנשי קשר, העסקת פלורסצנטיות תנודות ספקטרוסקופיה טכניקות, כלומר sFCCS, ccN & B. שיטות אלה כוללות ניתוח סטטיסטי של תנודות פלורסצנטיות הנפלטים על ידי שני FPs spectrally מופרדים דבוקה protein(s) עניין אצל איש קשר של שני תאים סמוכים, …
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו מומן בחלקו על ידי דויטשה פתוח (DFG) להעניק 254850309. המחברים מודים Luckner מכירה את מאדלן על קריאה ביקורתית של כתב היד.
Materials
| DMEM growth medium | PAN-Biotech | P04-01548 | |
| DPBS w/o: Ca2+ and Mg2+ | PAN-Biotech | P04-36500 | |
| DPBS w: Ca2+ and Mg2+ | PAN-Biotech | P04-35500 | |
| Trypsin EDTA | PAN-Biotech | P10-023100 | |
| TurboFect Transfection Reagent | Thermo Fisher Scientific | R0531 | |
| HEK 293T cells | DSMZ | ACC 635 | |
| Alexa Fluor 488 NHS Ester | Thermo Fisher Scientific | A20000 | |
| Rhodamine B | Sigma-Alderich | 83689-1G | |
| Plasmid DNA | Addgene | NA | See reference 12 (Dunsing et. al., MBoC 2017),for a detailed description of all plasmids |
| 6-well plate | Starlab | CC7672-7506 | |
| 35-mm glass bottom dishes | CellVis | D35-14-1.5-N | |
| Zeiss LSM780 confocal | Carl Zeiss | NA | |
| MATLAB software package | MathWorks | 2015b | |
| Neubauer cell counting chamber | Marienfeld | 640110 |
References
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. . Molecular biology of the cell. , (2002).
- Tepass, U., Truong, K., Godt, D., Ikura, M., Peifer, M. Cadherins in embryonic and neural morphogenesis. Nature Reviews Molecular Cell Biology. 1 (2), 91-100 (2000).
- Harris, T. J. C., Tepass, U. Adherens junctions: from molecules to morphogenesis. Nature Reviews Molecular Cell Biology. 11 (7), 502-514 (2010).
- Hernández, J. M., Podbilewicz, B. The hallmarks of cell-cell fusion. Development. 144 (24), 4481-4495 (2017).
- Huppa, J. B., Davis, M. M. T-cell-antigen recognition and the immunological synapse. Nature Reviews Immunology. 3 (12), 973-983 (2003).
- Kaden, D., Voigt, P., Munter, L. -. M., Bobowski, K. D., Schaefer, M., Multhaup, G. Subcellular localization and dimerization of APLP1 are strikingly different from APP and APLP2. Journal of cell science. 122, 368-377 (2009).
- Yap, A. S., Michael, M., Parton, R. G. Seeing and believing: recent advances in imaging cell-cell interactions. F1000Research. 4, 273 (2015).
- Kashef, J., Franz, C. M. Quantitative methods for analyzing cell-cell adhesion in development. 발생학. 401 (1), 165-174 (2015).
- Soba, P., et al. Homo- and heterodimerization of APP family members promotes intercellular adhesion. The EMBO Journal. 24 (20), 3624-3634 (2005).
- Kim, S. A., Tai, C. -. Y., Mok, L. -. P., Mosser, E. A., Schuman, E. M. Calcium-dependent dynamics of cadherin interactions at cell-cell junctions. Proceedings of the National Academy of Sciences of the United States of America. 108 (24), 9857-9862 (2011).
- Feinberg, E. H., et al. GFP Reconstitution Across Synaptic Partners (GRASP) Defines Cell Contacts and Synapses in Living Nervous Systems. Neuron. 57 (3), 353-363 (2008).
- Dunsing, V., Mayer, M., Liebsch, F., Multhaup, G., Chiantia, S. Direct evidence of amyloid precursor-like protein 1 trans interactions in cell-cell adhesion platforms investigated via fluorescence fluctuation spectroscopy. Molecular biology of the cell. 28 (25), 3609-3620 (2017).
- Schneider, F., et al. Diffusion of lipids and GPI-anchored proteins in actin-free plasma membrane vesicles measured by STED-FCS. Molecular Biology of the Cell. 28 (11), 1507-1518 (2017).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature methods. 3 (2), 83-89 (2006).
- Ries, J., Schwille, P. Studying Slow Membrane Dynamics with Continuous Wave Scanning Fluorescence Correlation Spectroscopy. Biophysical Journal. 91 (5), 1915-1924 (2006).
- Ries, J., Chiantia, S., Schwille, P. Accurate Determination of Membrane Dynamics with Line-Scan FCS. Biophysical Journal. 96 (5), 1999-2008 (2009).
- Chiantia, S., Ries, J., Schwille, P. Fluorescence correlation spectroscopy in membrane structure elucidation. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1788 (1), 225-233 (2009).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical journal. 94 (6), 2320-2332 (2008).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy research and technique. 71 (1), 69-81 (2008).
- Unruh, J. R., Gratton, E. Analysis of Molecular Concentration and Brightness from Fluorescence Fluctuation Data with an Electron Multiplied CCD Camera. Biophysical Journal. 95 (11), 5385-5398 (2008).
- Digman, M. A., Wiseman, P. W., Choi, C., Horwitz, A. R., Gratton, E. Stoichiometry of molecular complexes at adhesions in living cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2170-2175 (2009).
- Hellriegel, C., Caiolfa, V. R., Corti, V., Sidenius, N., Zamai, M. Number and brightness image analysis reveals ATF-induced dimerization kinetics of uPAR in the cell membrane. The FASEB journal official publication of the Federation of American Societies for Experimental Biology. 25 (9), 2883-2897 (2011).
- Dunsing, V., Luckner, M., Zühlke, B., Petazzi, R. A., Herrmann, A., Chiantia, S. Optimal fluorescent protein tags for quantifying protein oligomerization in living cells. Scientific Reports. 8 (1), 10634 (2018).
- Chen, Y., Johnson, J., Macdonald, P., Wu, B., Mueller, J. D. Observing Protein Interactions and Their Stoichiometry in Living Cells by Brightness Analysis of Fluorescence Fluctuation Experiments. Methods in enzymology. 472, 345-363 (2010).
- . Absolute Diffusion Coefficients: Compilation of Reference Data for FCS Calibration Available from: https://www.picoquant.com/images/uploads/page/files/7353/appnote_diffusioncoeffients.pdf (2010)
- Foo, Y. H., Naredi-Rainer, N., Lamb, D. C., Ahmed, S., Wohland, T. Factors affecting the quantification of biomolecular interactions by fluorescence cross-correlation spectroscopy. Biophysical journal. 102 (5), 1174-1183 (2012).
- Baum, M., Erdel, F., Wachsmuth, M., Rippe, K. Retrieving the intracellular topology from multi-scale protein mobility mapping in living cells. Nature Communications. 5, 4494 (2014).
- Wohland, T., Rigler, R., Vogel, H. The standard deviation in fluorescence correlation spectroscopy. Biophysical journal. 80 (6), 2987-2999 (2001).
- Ries, J., et al. Automated suppression of sample-related artifacts in Fluorescence Correlation Spectroscopy. Optics Express. 18 (11), 11073 (2010).
- Ries, J., Schwille, P. New concepts for fluorescence correlation spectroscopy on membranes. Physical Chemistry Chemical Physics. 10 (24), 3487 (2008).
- Mayer, M. C., et al. Amyloid precursor-like protein 1 (APLP1) exhibits stronger zinc-dependent neuronal adhesion than amyloid precursor protein and APLP2. Journal of Neurochemistry. 137 (2), 266-276 (2016).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Trullo, A., Corti, V., Arza, E., Caiolfa, V. R., Zamai, M. Application limits and data correction in number of molecules and brightness analysis. Microscopy Research and Technique. 76 (11), 1135-1146 (2013).
- Nolan, R., et al. nandb-number and brightness in R with a novel automatic detrending algorithm. Bioinformatics. 33 (21), 3508-3510 (2017).
- Hammond, G. R. V., Sim, Y., Lagnado, L., Irvine, R. F. Reversible binding and rapid diffusion of proteins in complex with inositol lipids serves to coordinate free movement with spatial information. The Journal of cell biology. 184 (2), 297-308 (2009).
- Hendrix, J., Dekens, T., Schrimpf, W., Lamb, D. C. Arbitrary-Region Raster Image Correlation Spectroscopy. Biophysical journal. 111 (8), 1785-1796 (2016).
- Hendrix, J., et al. Live-cell observation of cytosolic HIV-1 assembly onset reveals RNA-interacting Gag oligomers. The Journal of cell biology. 210 (4), 629-646 (2015).
- Hendrix, J., Schrimpf, W., Höller, M., Lamb, D. C. Pulsed Interleaved Excitation Fluctuation Imaging. Biophysical Journal. 105 (4), 848-861 (2013).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5 (1), 5412 (2014).
- Chojnacki, J., et al. Envelope glycoprotein mobility on HIV-1 particles depends on the virus maturation state. Nature Communications. 8 (1), 545 (2017).
- Godin, A. G., et al. Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis. Proceedings of the National Academy of Sciences of the United States of America. 108 (17), 7010-7015 (2011).
- Müller, J. D., Chen, Y., Gratton, E. Resolving Heterogeneity on the Single Molecular Level with the Photon-Counting Histogram. Biophysical Journal. 78 (1), 474-486 (2000).
- Kim, S. A., Heinze, K. G., Bacia, K., Waxham, M. N., Schwille, P. Two-Photon Cross-Correlation Analysis of Intracellular Reactions with Variable Stoichiometry. Biophysical Journal. 88 (6), 4319-4336 (2005).
- Jenkins, E., et al. Reconstitution of immune cell interactions in free-standing membranes. Journal of cell science. 132 (4), (2018).

