Spatio-temporelle contrôlée Translocation nucléaire des invités dans les cellules vivantes à l’aide de colles moléculaires en cage comme des balises Photoactivatable
Summary
Ce protocole décrit la translocation nucléaire déclenchée à la lumière des clients dans l’utilisation des balises de “cage” colle moléculaire des cellules vivantes. Cette méthode est prometteuse pour administration de médicaments sélectifs site nucléaire de ciblage.
Abstract
Le noyau de la cellule est l’un des principaux organites comme une cible de délivrance de médicaments subcellulaires, depuis la modulation de la réplication des gènes et expression est efficace pour le traitement de diverses maladies. Ici, nous démontrons la translocation nucléaire déclenchée à la lumière des invités à l’aide de cage tags colle moléculaire (Cagedcolle-R), dont plusieurs pendentifs ion (Gu+) de guanidinium sont protégés par un groupe de photoclivables anionique (butyrate-substitués nitroveratryloxycarbonyl ; BA CONV). Invités le tag Cagedcolle-R sont absorbées dans la vie des cellules par endocytose et restent dans les endosomes. Toutefois, dès lors, Cagedcolle-R est converti en uncaged moléculaire colle (colle-RUncaged) transportant plusieurs pendentifs Gu+ , qui facilite l’évasion endosomal et translocation nucléaire subséquente des invités. Cette méthode est prometteuse pour site sélectif nucléaire ciblage administration de médicaments, puisque les invités marquées peuvent migrer dans le cytoplasme, suivi par le noyau de la cellule uniquement lorsque photoirradiated. Avec cage Tags de colle-R peuvent livrer macromoléculaires invités tels que boîtes quantiques (QDs) ainsi que de petites molécules hôtes. Avec cage Étiquettes de colle-R peuvent être uncaged avec non seulement les rayons UV, mais aussi les deux photons proche infrarouge (NIR) lumière qui peut pénétrer profondément dans les tissus.
Introduction
Le noyau de la cellule, qui contient des informations génétiques, est l’un des principaux organites comme une cible de délivrance de médicaments subcellulaires, depuis modulation de la réplication des gènes et expression est efficace pour le traitement de diverses maladies dont le cancer et génétique les troubles de1,2,3. Pour nucléaire livraison de médicaments, conjugaison de peptide balises telles que la localisation nucléaire signaux (NLS)4,5,6 a été largement étudiée. Toutefois, afin de réduire les effets secondaires indésirables, contrôle spatio-temporelle de la translocation nucléaire est nécessaire.
Auparavant, lumière déclenchée la translocation des protéines dans le noyau de la cellule a été réalisée à l’aide de “cage” NLS7,8,9. NLS migre dans le noyau de la cellule en se liant aux protéines de transport cytoplasmique6. Dans les méthodes signalées, protéines de commentaires portant “cage” NLS sont directement incorporés dans le cytoplasme par microinjection8 ou exprimées dans les cellules cibles à l’aide d’un code génétique expansion technique9. Par conséquent, une méthode qui peut atteindre l’absorption cellulaire et translocation nucléaire photoinduit est avantageuse pour des applications pratiques.
Ici, nous décrivons la translocation nucléaire déclenchée à la lumière des invités dans les cellules vivantes à l’aide de balises dendritiques colle moléculaire en cage (Cagedcolle-R, Figure 1). Les colles moléculaire solubles dans l’eau10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 portant plusieurs pendentifs Gu+ a été développé, qui adhèrent fermement à protéines11,12,13,14,15, 16,17, acides nucléiques18,19,20, de membranes phospholipidiques21et argile nanofeuillets22,23 à la formation de multiples ponts salins entre leurs pendentifs Gu+ et oxyanionic des groupes sur les cibles. Les pendentifs de Gu+ du Cagedcolle-R sont protégés par un groupe de photoclivables anionique, nitroveratryloxycarbonyl substitués butyrate (convBA). Invités le tag Cagedcolle-R sont absorbées dans la vie des cellules par endocytose et séjour dans les endosomes (Figure 2). Dès lors, les groupes de conv BAdu Cagedcolle-R sont détachés pour produire une uncaged moléculaire colle (colle-RUncaged) transportant plusieurs pendentifs Gu+ , qui facilite ensuite la migration de l’invité étiquetée dans le cytoplasme, suivi par le noyau de la cellule (Figure 2). La balise de colle-R Cagedpeut être uncaged par l’exposition aux UV ou deux photons proche infrarouge (NIR) lumière sans phototoxicité grave. Nous démontrons l’administration nucléaire spatio-temporelle controlee de macromoléculaires invités ainsi que des invités de petites molécules avec Cagedtags de colle-R, en utilisant des points quantiques (QDs) et un colorant fluorescent (nitrobenzoxadiazole ; NBD), respectivement, à titre d’exemples.
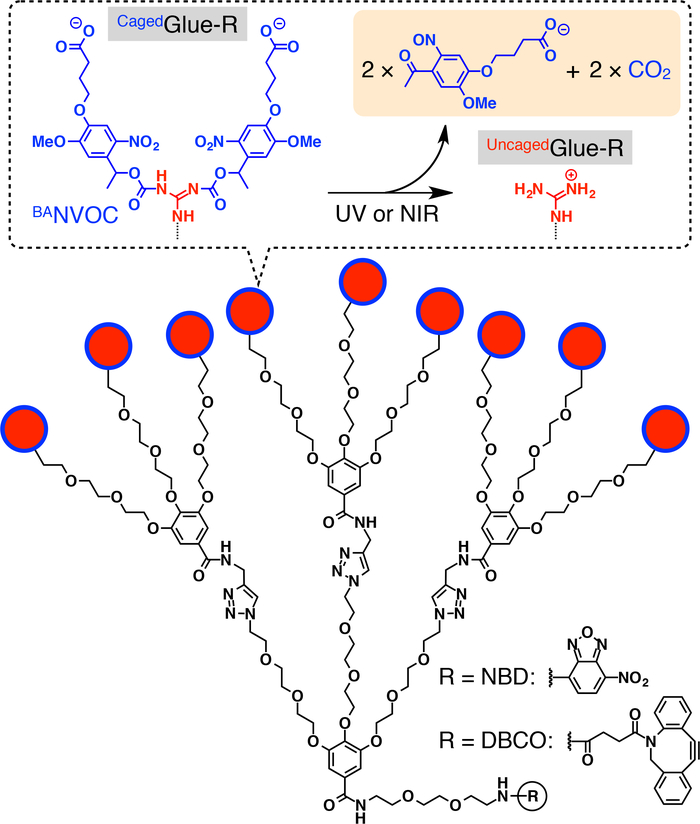
Figure 1 : Structures schématiques Cagedcolle-r Les 9 pendentifs ion (Gu+) de guanidinium de Cagedcolle-R sont protégés par un groupe de nitroveratryloxycarbonyl substitués butyrate (convBA). Les groupes de conv BAsont clivés par irradiation UV ou lumière NIR deux photons. Le noyau central de Cagedcolle-R est fonctionnalisé avec nitrobenzoxadiazole (NBD) ou dibenzocylooctyne (DBCO). Réimprimé avec la permission de référence20. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
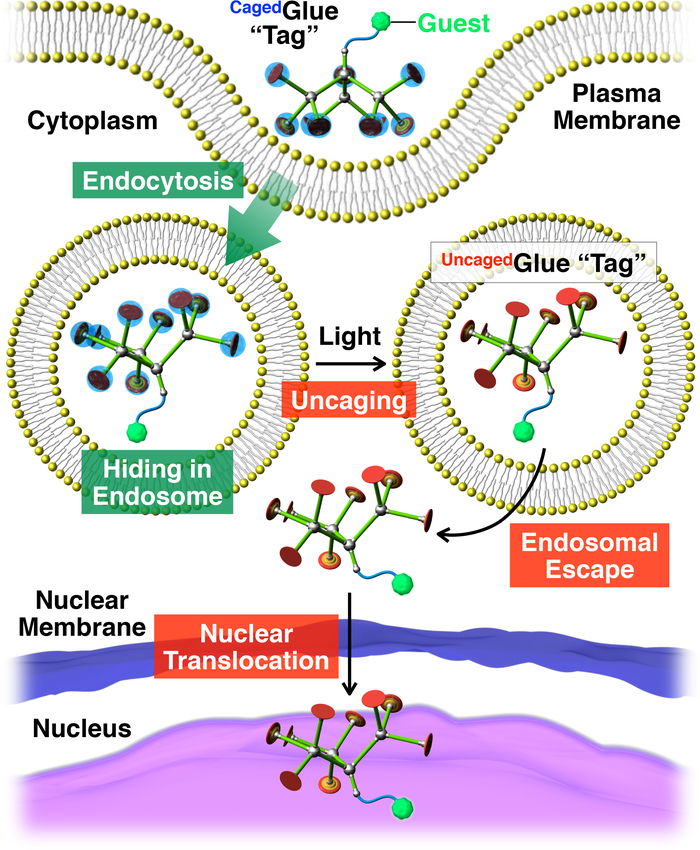
Figure 2 : Illustration schématique de la translocation nucléaire déclenchée à la lumière des invités conjugué avec une balise de colle-R Caged. L’invité /Cagedconjugué de colle-R est absorbé dans la vie des cellules par endocytose. Dès lors, la balise de colle-R Cagedest uncaged pour produire une balise de colle-R Uncagedqui peut faciliter l’évasion endosomal de l’invité étiquetée. Par la suite, l’invité tagged migre dans le noyau de la cellule. Réimprimé avec la permission de référence20. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Les enquêtes précédentes de lumière déclenchée la translocation des protéines dans le noyau de la cellule ont été obtenus à l’aide de “cage” NLS7,8,9. Comme mentionné précédemment, ces méthodes nécessitent des techniques supplémentaires pour incorporer les NLS-protéines dans le cytoplasme. En revanche, notre balise de colle-R Cagedpermet non seulement translocation nucléaire induite par la photo, m…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous reconnaissons le centre pour l’intégration de NanoBio, l’Université de Tokyo. Ce travail a été soutenu par la subvention pour jeunes scientifiques (B) (26810046) à K.O. et partiellement pris en charge par subvention de recherche spécialement favorisé (25000005) à Mr T.A. Merci les bourses de recherche de la société japonaise pour la Promotion of Science (JSPS ) pour les jeunes scientifiques et le programme Leading Graduate Schools (GPLLI).
Materials
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. 생화학. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).

