Spatiotemporally नियंत्रित परमाणु Photoactivatable टैग के रूप में बंदी आणविक गोंद का उपयोग कर कोशिकाओं में रहने वाले मेहमानों के Translocation
Summary
इस प्रोटोकॉल का वर्णन प्रकाश में मेहमानों के जीवित ट्रिगर परमाणु translocation का उपयोग कर कोशिकाओं को बंदी आणविक गोंद टैग । इस विधि साइट के लिए वादा कर रहा है-चयनात्मक परमाणु लक्ष्यीकरण दवा वितरण ।
Abstract
कोशिका नाभिक एक उपसेलुलर दवा वितरण लक्ष्य के रूप में सबसे महत्वपूर्ण organelles में से एक है, जीन प्रतिकृति और अभिव्यक्ति के मॉडुलन के बाद से विभिन्न रोगों के इलाज के लिए प्रभावी है । यहां, हम प्रदर्शन प्रकाश का उपयोग कर मेहमानों के परमाणु translocation को बंदी बनाकर आणविक गोंद (पिंजरागोंद-आर) टैग, जिसका एकाधिक guanidinium आयन (गुजरात+) पेंडेंट एक anionic photocleavable समूह द्वारा संरक्षित है (butyrate-प्रतिस्थापित nitroveratryloxycarbonyl; BA NVOC) । मेहमानों के साथ टैग की गईं पिंजरा गोंद आर endocytosis के माध्यम से जीवित कोशिकाओं में ले रहे है और endosomes में रहते हैं । हालांकि, photoirradiation पर, पिंजरागोंद आर uncage आणविक गोंद में परिवर्तित (पिंजरा गोंद-आर) एकाधिक गुजरात+ पेंडेंट, जो endosomal भागने और मेहमानों के बाद परमाणु translocation की सुविधा ले जा रहा है । इस विधि साइट चयनात्मक परमाणु लक्ष्यीकरण दवा वितरण के लिए वादा किया है, क्योंकि टैग मेहमानों कोशिका द्रव्य में सेल नाभिक द्वारा पीछा किया ही जब photoirradiated में स्थानांतरित कर सकते हैं । पिंजरा लगाया गोंद-R टैग macromolecular मेहमानों जैसे क्वांटम डॉट्स (QDs) और साथ ही छोटे अणु मेहमानों को वितरित कर सकते हैं । पिंजरा लगाया गोंद आर टैग न केवल यूवी प्रकाश, लेकिन यह भी दो फोटॉन के पास अवरक्त (NIR) प्रकाश है, जो गहराई से ऊतक में घुसना कर सकते है के साथ अनबंदी किया जा सकता है ।
Introduction
कोशिका नाभिक, जो आनुवंशिक जानकारी वहन करती है, एक सेलुलर दवा वितरण लक्ष्य के रूप में सबसे महत्वपूर्ण organelles में से एक है, जीन प्रतिकृति और अभिव्यक्ति के मॉडुलन के बाद से कैंसर और आनुवंशिक सहित विभिन्न रोगों के इलाज के लिए प्रभावी है विकारों1,2,3. दवाओं के परमाणु वितरण के लिए, परमाणु स्थानीयकरण संकेतों (एनएलएस)4,5,6 के रूप में पेप्टाइड टैग की विकार व्यापक रूप से जांच की गई है । हालांकि, अवांछित दुष्प्रभावों को कम करने के लिए, परमाणु translocation के spatiotemporal नियंत्रण आवश्यक है ।
पहले, सेल नाभिक में प्रोटीन के प्रकाश ट्रिगर translocation एनएलएस7,8,9बंदी का उपयोग कर प्राप्त किया गया है । एनएलएस सेल नाभिक में cytoplasmic परिवहन प्रोटीन6के लिए बाध्य द्वारा विस्थापित । रिपोर्ट के तरीके में, अतिथि प्रोटीन असर बंदी एनएलएस सीधे microinjection द्वारा कोशिका द्रव्य में शामिल कर रहे है8 या लक्ष्य कोशिकाओं में व्यक्त की एक आनुवंशिक कोड विस्तार तकनीक9का उपयोग कर । इसलिए, एक तरीका है कि दोनों सेलुलर और फोटो प्रेरित परमाणु translocation प्राप्त कर सकते है व्यावहारिक अनुप्रयोगों के लिए लाभप्रद है ।
इस के साथ साथ, हम प्रकाश का वर्णन वृक्ष बंदी आणविक गोंद (पिंजरेमें गोंद-R, चित्रा 1) टैग का उपयोग कर कोशिकाओं में रहने वाले मेहमानों के परमाणु translocation ट्रिगर । पानी में घुलनशील आणविक गोंद10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 असर एकाधिक गुजरात+ पेंडेंट पहले विकसित किया गया है, जो कसकर प्रोटीन का पालन11,12,13,14,15, 16,17, न्यूक्लिक एसिड18,19,20, फॉस्फोलिपिड झिल्ली21, और क्ले nanosheets22,23 के माध्यम से लक्ष्य पर अपने गुजरात+ पेंडेंट और oxyanionic समूहों के बीच कई नमक पुलों का गठन । गुजरात+ पिंजरा गोंद के पेंडेंट-R एक anionic photocleavable समूह, butyrate-प्रतिस्थापित nitroveratryloxycarbonyl (BANVOC) द्वारा संरक्षित कर रहे हैं । मेहमानों के साथ टैग की गईं पिंजरा गोंद आर endocytosis के माध्यम से जीवित कोशिकाओं में ले रहे है और endosomes (चित्रा 2) में रहते हैं । photoirradiation पर, बापिंजरा गोंद के NVOC समूहों-r एक uncage में आणविक गोंद (पिंजरा गोंद-आर)एकाधिक गुजरात+ पेंडेंट, जो तो टैग अतिथि के प्रवास की सुविधा को लेकर उपज को अलग कर रहे है सेल नाभिक (चित्रा 2) द्वारा पीछा कोशिका द्रव्य में । पिंजरागोंद आर टैग यूवी या दो गंभीर phototoxicity के बिना अवरक्त (NIR) प्रकाश के लिए जोखिम से uncageed जा सकता है । हम macromolecular मेहमानों के spatiotemporally नियंत्रित परमाणु वितरण के रूप में के रूप में अच्छी तरह के रूप में पिंजरा गोंद आर टैग के साथ छोटे अणु मेहमानों का प्रदर्शन, क्वांटम डॉट्स (QDs) और एक फ्लोरोसेंट डाई का उपयोग कर (nitrobenzoxadiazole; NBD), क्रमशः उदाहरण के रूप में ।
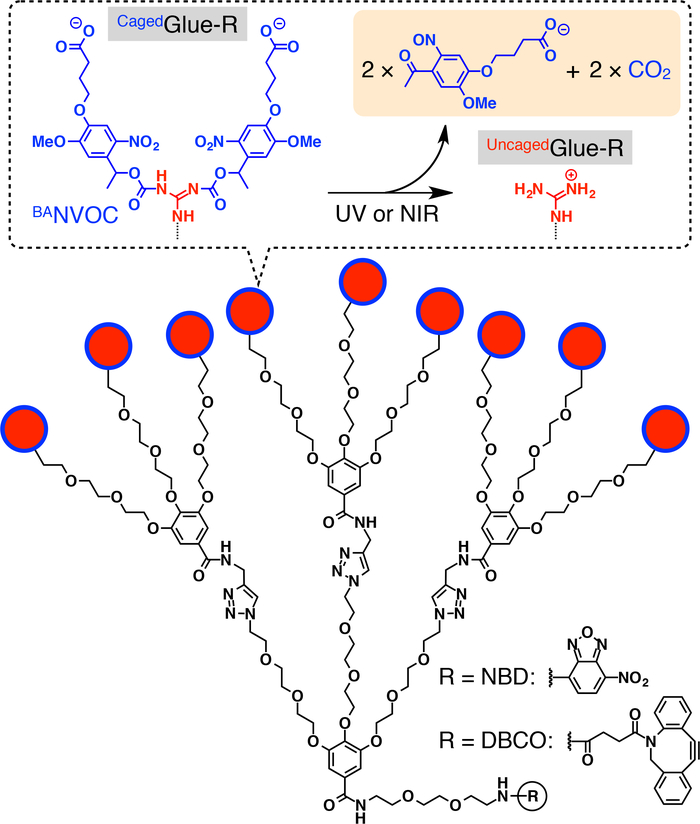
चित्रा 1: पिंजरा गोंद के योजनाबद्ध संरचनाओं आर । पिंजरा गोंद के 9 guanidinium आयन (गुजरात+) पेंडेंट-R एक butyrate-स्थानापन्न nitroveratryloxycarbonyl (BANVOC) समूह द्वारा संरक्षित हैं. बीएNVOC समूहों यूवी या दो फोटॉन NIR प्रकाश के साथ विकिरण से सट रहे हैं । बंदीगोंद के फोकल कोर-R या तो nitrobenzoxadiazole (NBD) या dibenzocylooctyne (DBCO) के साथ कार्यात्मक है । संदर्भ20से अनुमति के साथ पुनर्मुद्रित । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
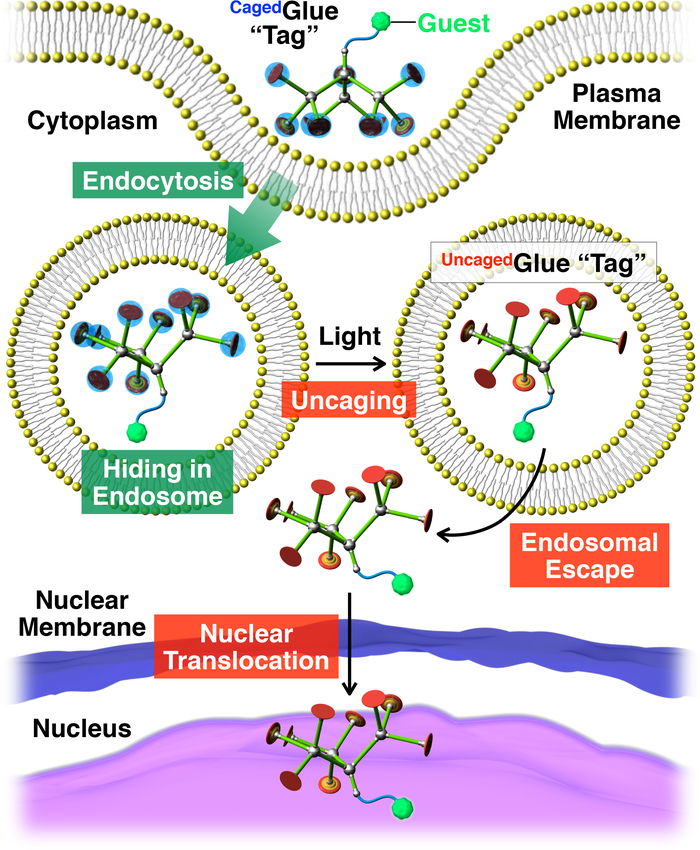
चित्रा 2: प्रकाश के योजनाबद्ध चित्रण-मेहमानों संयुग्मित के एक पिंजरा गोंद आर टैग के साथ परमाणु translocation ट्रिगर । अतिथि/पिंजरागोंद-R संयुग्मी endocytosis के माध्यम से जीवित कोशिकाओं में ले लिया है । photoirradiation पर, पिंजरागोंद आर टैग के लिए एक uncage में गोंद-r टैग, जो टैग अतिथि के endosomal भागने की सुविधा कर सकते है uncage में है । इसके बाद, टैग किए गए अतिथि कक्ष नाभिक में माइग्रेट होता है । संदर्भ20से अनुमति के साथ पुनर्मुद्रित । कृपया यहां क्लिक करें इस आंकड़े का एक बड़ा संस्करण को देखने के लिए ।
Protocol
Representative Results
Discussion
सेल नाभिक में प्रकाश ट्रिगर प्रोटीन की translocation के पिछले जांच के पिंजरा एनएलएस7,8,9का उपयोग कर प्राप्त किया गया है । जैसा कि पहले उल्लेख किया है, इन तरीकों अतिरिक्त तकनीक क?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
हम NanoBio एकीकरण, टोक्यो विश्वविद्यालय के लिए केंद्र स्वीकार करते हैं । यह काम अनुदान द्वारा समर्थित किया गया था युवा वैज्ञानिकों के लिए सहायता (ख) (२६८१००४६) K.O. करने के लिए और आंशिक रूप से अनुदान द्वारा समर्थित विशेष रूप से पदोन्नत अनुसंधान के लिए सहायता (२५०००००५) T.A. R.M. धन्यवाद विज्ञान के संवर्धन के लिए जापान समाज के अनुसंधान फैलोशिप (JSPS ) युवा वैज्ञानिकों और अग्रणी स्नातक स्कूलों (GPLLI) के लिए कार्यक्रम के लिए ।
Materials
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. 생화학. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).

