Høy-gjennomstrømning DNA plasmider multipleksing og Transfeksjoner bruke akustisk Nanodispensing teknologi
Summary
Denne protokollen beskriver høy gjennomstrømming plasmider transfeksjoner av pattedyrceller i en 384-brønn plate ved hjelp av akustisk dråpe utstøting teknologi. Den tidkrevende, feilutsatte DNA-uttaket og-multipleksing, men også den transfeksjoner reagens uttaket, er programvare drevne og utføres av en nanodispenser enhet. Cellene blir deretter sådd i disse forhåndsutfylte brønnene.
Abstract
Cell transfeksjoner, uunnværlig for mange biologiske studier, krever kontrollerende mange parametre for en nøyaktig og vellykket prestasjon. Oftest utføres ved lav gjennomstrømning, er det dessuten tidkrevende og feil utsatt, enda mer når multipleksing flere plasmider. Vi utviklet en enkel, rask og nøyaktig metode for å utføre celle transfeksjoner i en 384 brønn plate layout ved hjelp av ADE-teknologi (akustisk dråpe utstøting). Den nanodispenser enheten som brukes i denne studien er basert på denne teknologien og gir presis nanovolume levering i høy hastighet fra en kilde brønn plate til en destinasjon en. Det kan dispensere og multiplex DNA og transfeksjoner reagens i henhold til et forhåndsutformet regneark. Her presenterer vi en optimal protokoll for å utføre ADE-baserte høykapasitets plasmider transfeksjoner som gjør det mulig å oppnå en effektivitet på opptil 90% og en nesten 100% cotransfection i cotransfection eksperimenter. Vi utvider innledende arbeid ved å foreslå en brukervennlig, regneark BAS ert makro som kan håndtere opptil fire plasmider/brønner fra et bibliotek som inneholder opptil 1 536 forskjellige plasmider, og et nettbrettbasert pipettering førings program. Makroen utformer de nødvendige malene for kildeplaten (e) og genererer filer som er klare til bruk for nanodispenser og nettbrettbasert program. De fire-trinn transfeksjoner protokollen innebærer i) en fortynningsvæske dispensere med en klassisk flytende handler, II) plasmider distribusjon og multipleksing, III) en transfeksjoner reagens dispensere av nanodispenser, og IV) celle plating på ferdigfylt brønner. Den beskrevne programvarebasert kontroll av ADE-plasmider multipleksing og transfeksjoner gjør at selv nonspecialists i felten kan utføre en pålitelig celle transfeksjoner på en rask og sikker måte. Denne metoden muliggjør rask identifisering av optimale innstillinger for en gitt celle type og kan forandres til høyere skala og manuelle tilnærminger. Protokollen Letter søknadene, som Human ORFeome protein (sette av åpen lesing rammens [ORFs] inne en Genova) gjengivelsen eller CRISPR-Cas9-basert gen funksjonen godkjenningen, inne nonpooled screening strategisk.
Introduction
Metoden som presenteres her beskriver i detalj hvordan man utfører DNA plasmider multipleksing og transfeksjoner i pattedyrceller ved høy gjennomstrømning ved hjelp av en akustisk-basert væske nanodispenser i en 384-brønn plate, selv for nonspecialists i feltet. Denne nylig publiserte metoden1 gjør det mulig å utføre så mye som 384 uavhengige plasmider DNA-multipleksing og transfeksjoner forhold i ett eksperiment, på mindre enn 1 time. enkle eller cotransfection eksperimenter var vellykkede, og nådde en nær 100% cotransfection innenfor transfekterte celler befolkningen. Denne protokollen gjør transfeksjoner enklere fordi de fleste av de kjedelige, tidkrevende og feilutsatte trinnene nå er programvare drevne (se figur 1 for en generell oversikt). Det er gjort ytterligere anstrengelser for å utvikle dedikerte verktøy for å forbedre brukervennligheten og samtidig unngå menneskelige feil under den generelle prosessen og for å fremme vellykket transfeksjoner selv for nonspecialists i felten. Den beskrevne protokollen inkluderer en “brukervennlig” makro regneark som vi utviklet for å administrere 384 uavhengige transfeksjoner forhold med multipleksing muligheter på opptil fire plasmider i hver brønn. Makroen automatisk utvikler mal av kilden tallerken () å belaste det ventet DNA plasmider kvantum fra igangsetting lager løsninger og filene krevde å kjøre det nanodispenser programvare på eksperimentelle tegning det er blitt angitt. Siden den manuelle uttaket av DNA i en 384 kilde plate er kjedelig og utsatt for feil, har vi også utviklet en dedikert nettbrettbasert applikasjon som veileder brukeren under uttaket av DNA-løsningen i henhold til malen.
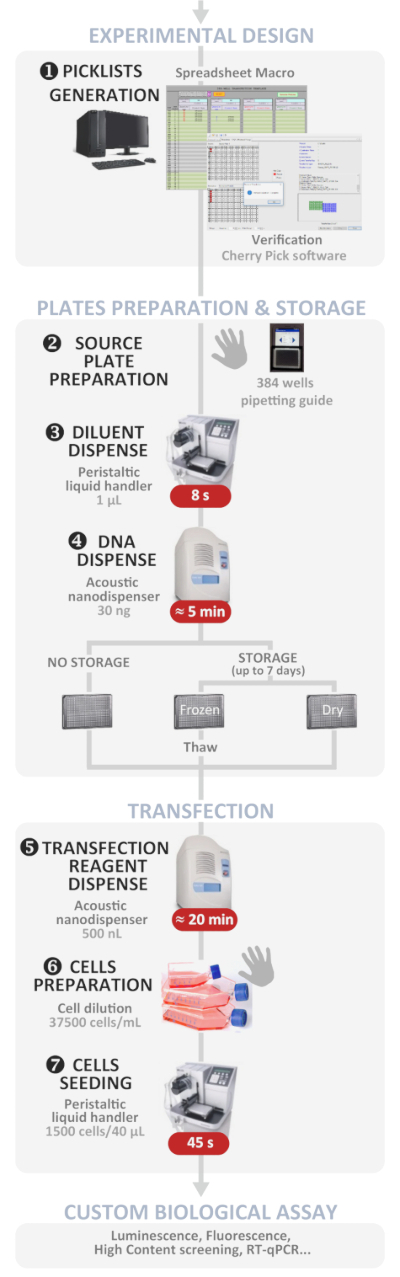
Figur 1: eksperimentell arbeidsflyt. Skjematisk representasjon av den optimale automatiserte høy gjennomstrømming Reverse transfeksjoner protokoll (fra eksperimentell design til tilpassede biologiske analysen). Manuelle trinn indikeres av hånd symbolet, og omtrentlig tid for hvert trinn er skrevet i en rød boks. Vennligst klikk her for å se en større versjon av dette tallet.
Mange celle-baserte eksperimenter starter med plasmider DNA transfeksjoner, og selv om mange dedikerte reagenser har vært og fortsatt er under utvikling for å forbedre transfeksjoner effektivitet og/eller lette prosedyren, gjenstår mye å gjøre2,3 , 4. DNA plasmider celle transfeksjoner innebærer flere trinn for å nå høy effektivitet, for eksempel en innledende komplekse opptak, endosomal rømme, og cytoplasmatiske transport til nucleus5,6. I tillegg til kalsium nedbør eller fysiske teknikker som electroporation eller microinjection bruker dedikerte enheter7, moderne kjemiske metoder har fokusert på å forbedre DNA celle levering mens senke celle cytoxicity8, 9i. Bruken av lipider eller kationiske polymerer som danner liposome komplekser og, mer nylig, har nonliposomal polymer kjemi systemer gjort transfeksjoner enklere og mer effektiv10. Til tross for denne utviklingen, krever celle transfeksjoner fortsatt spesifikke ferdigheter for å være nøyaktig utført som de fleste av disse fysiske eller kjemiske transfeksjoner protokoller krever forskere å manuelt forberede hver DNA transfeksjoner reaksjons tilstand, og dermed svekke gjennomstrømming. For å omgå dette problemet har omvendt transfeksjoner protokoller blitt utviklet ved hjelp av kjemiske transfeksjoner reagenser11,12,13, slik at brukeren kan teste eller kombinere flere plasmider på en raskere måte. I disse protokollene dannes nukleinsyre syre komplekser med transfeksjoner reagenser før seeding cellene i komplekser. Imidlertid er disse omvendte protokoller fortsatt begrenset av manuell håndtering av DNA-løsninger og ved kombinasjonen av hver av de selvstendige forhold. Selv om det er mulig å utføre dem i en 96-brønn plateformat, vil DNA-preparatet og utleverer være kjedelige, og det vil trolig være feil. Når ulike mengder av flere DNA plasmider er nødvendig og multiplekset med hverandre, celle transfeksjoner blir enda vanskeligere å oppnå og mer tidkrevende, og menneskelige feil blir ganske uunngåelig. Skalering opp til 384-brønn plateformat i en omvendt transfeksjoner tilnærming, til tross for få multiplekset DNA transfeksjoner forhold, blir en umulig utfordring på grunn av følgende årsaker. i) volumene av DNA-mengder, transfeksjoner reagens eller reaksjons blanding er lavere enn 1 μL for hver brønn. II) multipleksing av plasmider for 384 selvstendige forhold blir ekstremt komplisert. Leveransen i hver av 384 brønner er også III) svært tidkrevende og IV) utsatt for feil. Faktisk, utlevering den riktige løsningen i de forventede brønnene er vanskelig å håndtere fordi de lave volumene som allerede er utlevert ikke tillater visuell overvåkning mellom de tomme og allerede fylte brønner. v) til slutt, det er en høy risiko for tørking av blandingen ved fordampning før cellene tilsettes på grunn av den tiden som trengs for å utføre de nødvendige dispenser trinnene. Oppsummert, den begrensende faktoren for å sette opp høy gjennomstrømming DNA plasmider transfeksjoner analyser synes å være miniatyrisering av analysen, som innebærer lavt volum multipleksing og styring som ikke kan håndteres manuelt lenger, men er også neppe oppnåelig i en pålitelig måte av klassisk peristatic flytende handlers.
Som et bevis på problemer med å automatize slike analyser og få høy gjennomstrømming, bare noen forsøk på å automatisere transfeksjoner har blitt publisert så langt: en 96-brønn plateformat ved hjelp av en kommersiell væske håndteringsenhet og kalsium fosfat nedbør14 og, mer nylig, en lipoplex reagens, og en mikrovæskebasert chip muliggjør 280 uavhengige transfections15 men krever spesialiserte ferdigheter på dette feltet. En annen metode, acoustophoresis, slik at flytende Levitation og fører til væske manipulasjon og miksing, ble brukt til å utføre DNA transfeksjoner i 24-til 96-brønn plateformater16. Til tross for gjennomførbart, denne adgang lide fra en ytterst lav produksjon idet det blander av celler med DNA transfeksjoner blanding behøver en 60 s inkubasjons for enhver enkelt punkt tidligere seeding. Dette innebærer en varighet på minst 96 min for en komplett 96-brønn plate. Videre er denne protokollen langt unna å være mottagelig for den samlede biologer ‘ publikum som dette arbeidet ble gjort med en in-House designet og produsert enhet som for øyeblikket ikke er tilgjengelig på markedet. Tvert imot, i de siste årene, en lett å bruke programvare drevet akustisk-basert dispenser teknologi har dukket opp med nanovolume dispenser enheter. Ved hjelp av fokusert akustisk energi, disse enhetene lar tett kontrollert utstøting av små flytende volumer fra 2,5 nL til 500 nL fra en kilde plate til en destinasjon en17. Denne teknologien, kalt akustisk dråpe utstøting (ADE), har mange fordeler: den er helautomatisk, kontaktløse, tipless, nøyaktig, presis og svært reproduserbar, og den har en høy gjennomstrømming på18. Først viet til å levere dimethyl sulfoxide (DMSO) løsninger, har innstillingene blitt forbedret for å dispensere vandige buffere19. Akustisk nanodispensers, så synes egnet for omvendt celle transfeksjoner protokoller og kunne omgå de fleste av de nevnte manuelle begrensninger. Siden ingen plasmider transfeksjoner forsøk tidligere ble beskrevet ved hjelp av denne teknologien, har vi nylig evaluert egnetheten av et akustisk BAS ert doseringssystem for å utføre omvendt celle transfeksjoner.
Dra nytte av nanodispenser gjennomstrømning og brukervennlighet, optimalisert vi en omvendt transfeksjoner protokoll for HeLa celler ved kryss-testing flere parametre som kan påvirke DNA transfeksjoner på en 384-brønn, enkelt plate, nemlig den totale DNA-beløpet og av kilde DNA, start konsentrasjon, fortynnings volum, transfeksjoner reagens og antall sprednings celler. Den utviklede protokollen omgår de ovennevnte manuelle begrensningene av celle transfeksjoner og presenterer flere fordeler fremfor andre automatiserte transfeksjoner forsøk. Først er det miniatyriserte, og dermed gir for kostnadseffektiv transfeksjoner reagens ved å spare DNA plasmider preparater og transfeksjoner reagens. Dernest er det mye mer høy gjennomstrømming og reproduserbar enn den manuelle protokollen (selv for nybegynnere), som transfeksjoner av en hel 384-brønn plate kan oppnås på mindre enn 1 t. Til slutt er det programvare drevet, slik at kontroll av det utlevert DNA-beløpet og multipleksing av flere plasmider. Takket være den nanodispenser programvaren (tabell over materialer), kan brukeren faktisk utarbeide en studieplan for å kontrollere volumene som skal føres ut fra en definert kilde brønn plate til en destinasjon.
Protokollen som presenteres her er i hovedsak ment for de som har tilgang til en nanodispenser og ønsker å sette opp transfeksjoner eksperimenter med høy gjennomstrømming, men også for de som ønsker å raskt optimalisere sine transfeksjoner parametere for en gitt celle type ved bruke denne protokollen til å kryss-teste flere parametere med høy gjennomstrømming. Vi har faktisk vist at optimaliserte parametre identifisert med denne nanoskala protokollen kan forandres til større skala og manuelle transfeksjoner eksperimenter. Til slutt, som transfeksjoner reagens som brukes i den foreliggende protokollen tillater DNA eller siRNA transfeksjoner i henhold til produsenten, er protokollen også av interesse for de som sikter på å utføre array tilnærminger for gen overuttrykte eller knockdown. Destinasjons platene forhåndsutfylt med DNA kan bevares inntil 7 dager før bruk i en transfeksjoner analyse uten tap av effekt, noe som er en annen fordel med følgende protokoll for denne typen program.
Protocol
Representative Results
Discussion
Etablering og optimalisering av en nøyaktig høy gjennomstrømming transfeksjoner metode for en gitt cellelinje krever forskere til å følge noen viktige parametre som er beskrevet i denne delen. Vi oppfordrer sterkt starter med de anbefalte verdiene i hele protokollen som disse innstillingene optimalisert for jakten celler viste seg også å være effektiv for HEK celler. Men, som de beste parametrene kan avhenge av cellelinjer og transfeksjoner reagenser, kan optimale forhold defineres ved å variere celle nummer, fo…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne avslørte en kvittering på følgende økonomisk støtte til forskning, forfatterskap, og/eller publisering av denne artikkelen: INSERM, lille University, lille Pasteur Institute, Conseil Régional du Nord, og PRIM-HCV1 og 2 (Pôle de Recherche Interdisciplinaire Sur Le Médicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), Feder (12001407 (D-AL) Equipex Imaginex BioMed) og det europeiske samfunnet (ERC-STG INTRACELLTB n ° 260901). Forfatterne ønsker å takke Dr. S. Moureu, Dr. B. Villemagne, Dr. R. Ferru-Clément, og Dr. H. Groult for deres kritiske gjennomgang og rettelser av manuskriptet.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
References
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

