In Silico Modeling Method for Computational Aquatic Toxicology of Endocrine Disruptors: A Software-Based Approach Using QSAR Toolbox
Summary
Die quantitative Struktur-Aktivitäts-Beziehungsmodellierung (QSAR) ist eine repräsentative bioinformatische Methode im toxikologischen Screening. Dieses Protokoll zeigt, wie die Risiken von endokrinen Disruptoren (EDs) in aquatischen Umgebungen rechnerisch bewertet werden. Mit Hilfe der OECD QSAR Toolbox implementiert das Protokoll einen in silico assay zur Analyse der Toxizität von EDs bei Fischen.
Abstract
Computational Analysen toxikologischer Prozesse ermöglichen ein hochdurchsatzreiches Screening chemischer Substanzen und die Vorhersage ihrer Endpunkte in biologischen Systemen. Insbesondere wurden quantitative Struktur-Aktivitäts-Beziehungsmodelle (QSAR) zunehmend angewendet, um die Umweltauswirkungen einer Vielzahl toxischer Stoffe zu bewerten. In den letzten Jahren sind einige der stärker hervorgehobenen Arten von Giftstoffen endokrine Disruptoren (EDs, die Chemikalien sind, die jeden hormonbedingten Stoffwechsel stören können). Da EDs die Entwicklung und Fortpflanzung von Tieren erheblich beeinflussen können, ist eine schnelle Vorhersage der nachteiligen Auswirkungen von EDs mit Silico-Techniken erforderlich. Diese Studie stellt eine in silico-Methode zur Erstellung von Vorhersagedaten über die Auswirkungen repräsentativer EDs bei Wirbeltieren, insbesondere Fischarten, vor. Das Protokoll beschreibt ein Beispiel anhand des automatisierten Workflows der QSAR Toolbox Software, die von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) entwickelt wurde, um akute Ökotoxizitätsvorhersagen von EDs zu ermöglichen. Als Ergebnis werden folgende Ermittelt: (1) Berechnung der numerischen Korrelationen zwischen der Konzentration für 50% der Letalität (LC50) und dem Octanol-Wasser-Partitionskoeffizienten (Kow), (2) Ausgangsleistungen, bei denen die LC50 Die in Experimenten ermittelten Werte werden mit denen verglichen, die durch Berechnungen generiert wurden, und (3) die Abhängigkeit der Östrogenrezeptorbindungsaffinität von der Beziehung zwischen Kow und LC50.
Introduction
Neue Entwicklungen in Informatik und Computertechnik haben die biologischen Wissenschaften mit quantitativen Methoden befähigt, die hohe Präzision und Zuverlässigkeit bieten1. Insbesondere Algorithmen, die in der molekularen Taxonomie und Der Objektklassifizierung verwendet werden, haben zu quantitativen Struktur-Aktivitäts-Beziehungsmodellen (QSAR)2geführt. Diese Modelle korrelieren automatisch die chemischen Strukturen und biologischen Aktivitäten einer bestimmten chemischen Datenbank und implementieren ein schnelles Silico-Screening einer breiten Palette chemischer Substrate entsprechend ihrer medizinischen oder toxikologischen Aktivität3. QSAR-Werkzeuge können prädiktive Toxizitätsprofile als Funktion von Merkmalsvektoren molekularer Deskriptoren (d. h. physikalisch-chemischer Parameter) von Chemikalien von Interesse erzeugen, um numerisch kategoriale Endpunkte zu erstellen4. Normalerweise wird jeder quantitative Endpunkt als 2D-Streudiagramm im Vergleich zu Änderungen in Deskriptorwerten angezeigt. Ein QSAR-Modell wird dann mit (mehreren) linearen Regressionsanalysen generiert. Nachdem ein Dataset vollständig zum Erstellen eines QSAR-Modells (der so genannte Trainingssatz) ausgenutzt wurde, wird das Modell statistisch überprüft, indem die Endpunkte einer Gruppe von Chemikalien vorhergesagt werden, die nicht im Trainingssatz enthalten sind (der so genannte Testsatz). Das Modell kann dann verwendet werden, um die biologischen Aktivitäten von ungetesteten Verbindungen3vorherzusagen.
Unter vielen schädlichen Chemikalien, endokrine Disruptoren (EDs) wurden als eine Gruppe von Giftstoffen hervorgehoben, die in zahlreichen Hormon-bezogenen Stoffwechsel bei Säugetieren stören können, Amphibien, und Fische5,6. EDs sind dafür bekannt, eine Vielzahl von Nebenwirkungen zu induzieren, wie Krebs und Fehlbildungen, indem sie normale hormonelle Bahnen blockieren oder verändern oder abnormale Hormonsynthese/-degradationssignale aktivieren. Infolgedessen können diese hormonimitierenden Chemikalien endokrine Systeme stören, so dass die biologische Entwicklung und Fortpflanzung von Wildtierpopulationen behindert wird. Insbesondere die ökotoxikologischen Wirkungen von EDs wurden bei Wasserwirbeltieren, die nahezu identische Hormonrezeptorstrukturen haben, umfassend untersucht wie bei Säugetieren, einschließlich Menschen. Da alle hormonellen Aktionen bei niedrigen Dosen in vivo auftreten, ist die Vorhersage der potenziellen Toxizitäten von ED-Kandidaten mit schnellen Silico-Screening stoltoisierend für die öffentliche und ökologische Gesundheit.
QSAR-Modelle, die auf der Toxikologie von EDs basieren, wurden sowohl unter Verwendung von 2D- als auch 3D-Deskriptoren (bekannt als 2D- und 3D-QSAR) durchgeführt, die die ED-Ligand-Bindungsaffinitäten von Östrogen-, Androgen- und Progesteronrezeptoren7offenbaren. Trotz der hochpräzisen Vorteile von 3D QSAR, bei denen konforme und elektrostatische Wechselwirkungen berücksichtigt werden, behält 2D QSAR seine eigene Robustheit in direkten mathematischen Algorithmen, schnellen Berechnungen und extrem niedrigen Rechenlasten. Darüber hinaus sind 2D-QSAR-Modelle flexibel für den Einsatz in einer Vielzahl von Anwendungen und erzielen gleichzeitig eine relativ genaue Vorhersageleistung.
Die OECD QSAR Toolbox ist derzeit eines der am häufigsten genutzten Computer-Software-Tools und bietet frei verfügbare und vorgefertigte QSAR-Modelle8,9. Der Profiler verwendet 2D-Deskriptordatenbanken. Seit der Veröffentlichung der ersten Version im Jahr 2008 wird die Software in den Bereichen chemische und biologische Industrie, öffentliche Gesundheit und Umweltsicherheit zur vollständigen oder teilweisen Analyse der potenziellen Risiken natürlicher und synthetischer Verbindungen eingesetzt, besondere Interessen in der Karzinogenese10,11,12, Mutagenität13,14,15, und Entwicklungstoxizität16. Die Anwendung auf die aquatische Toxikologie wurde ebenfalls nachgewiesen, mit Schwerpunkt bioakkumation und biotransformation17.
Die QSAR Toolbox hat sich als nützlich bei der Vorhersage der kurzfristigen Toxizität einer breiten Palette von Chemikalien17, sowie der Östrogenrezeptor (ER) Bindung Affinitäten von EDs18. Die akuten Ökotoxizitäten von EDs bei Wirbeltieren wurden jedoch nicht mit der QSAR Toolbox analysiert. In dieser Studie wird ein typisches und leichtes Protokoll vorgestellt, um QSAR-Modellierung über die akuten Nebenwirkungen von EDs mit einem Schwerpunkt bei Fischarten durchzuführen. Die Studie zeigt, dass die QSAR Toolbox eine hochzugängliche Software zur Berechnung und Vorhersage der Letalität/Sterblichkeit von Wasserwirbeltieren für einige repräsentative EDs ist. Statistische Behandlungsmethoden für die abgeleiteten silico-Datensätze werden vorgestellt. Abbildung 1 zeigt das Gesamtschema für den allgemeinen Betrieb der QSAR Toolbox. Der in Abbildung 2 dargestellte Arbeitsablauf enthält einfache Anweisungen zum Betrieb des in silico-Assays, um die akute Ökotoxizität von Zielstoffen wie endokrin störenden Chemikalien vorherzusagen.
Protocol
Representative Results
Discussion
Die Vielseitigkeit der OECD QSAR Toolbox als analytische Software für die Ökotoxikologie wird hier mit besonderem Interesse an den negativen Auswirkungen endokrine störender Chemikalien auf Wasserwirbeltiere gezeigt. Darüber hinaus wurde ein einfaches und standardisiertes Protokoll zur Vorhersage der akuten Toxizität (96-h LC50) von 74 repräsentativen EDs (Tabelle 1) für Fischarten nachgewiesen. Dies wurde durch die Anwendung von Kategoriebildungs-, Datenlückenfüllungs- und ER-Profilierungsmodulen erreicht, die in die QSAR Toolbox eingebettet sind (Abbildung 1, Abbildung 2).
Die lineare Korrelation zwischen Log10LC50 und Log10KOW mit einer negativen Steigung (wie in DerZusatzabbildung S1dargestellt) ist seit langem als Standard-quantitative Beziehung in QSAR-Analysen25bekannt, wobei eine höhere Toxizität wird gezeigt, je hydrophober eine bestimmte Chemikalie ist. Wie aus einer einfachen Berechnung ersehen kann, ist die allgemeine mathematische Beziehung, die Gleichung S1 und Gleichung S2 (Ergänzende Information) enthält, ein konvertierter Ausdruck aus der folgenden Leistungsfunktion26:
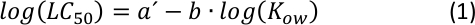

Aus der Darstellung von (Gleichung 2) kann die Charakterisierung eines Zwischenbereichs von KOW26 durch Anpassung der Parameter a und b möglich sein, wobei eine bestimmte Variation der Hydrophobie (oder Hydrophilie) die Endpunkt der akuten Toxizität.
Vergleichende Analysen zwischen den Rechenvorhersagen und experimentellen Beobachtungen am LC50, wie in Abbildung 3 und Abbildung 4dargestellt, wurden in der Regel in Studien mit QSAR für verschiedene aquatische Giftstoffe, einschließlich technische nichtionische Tenside27, Triazol-Fungizide28und Pestizidmetaboliten21. Diese Art der retrospektiven Validierung liefert Informationen darüber, wie weit ein bestimmtes QSAR-Tool in Bezug auf die vergleichende Leistung mit experimentellen Ergebnissen reichen kann. In dieser Studie über die akute Toxizität bei Fischen wurde die QSAR Toolbox als Schutzvorhersage für über 90% der getesteten EDs in allen Fischen und bei einer einzigen Art, Pimephales promelas,nachgewiesen.
Weitere Identifizierung der drei Ausreißerchemikalien in Abbildung 3 und Abbildung 4, die im Durchschnitt und auf einem Minimum höhere vorhergesagte LC50 zeigten, ist erforderlich. Erstens ist das 3′,5,7-Trihydroxy-4′,6-Dimethoxyisoflavon eine Art von Flavonoid (genauer gesagt ein Isoflavon), das allgemein als sicher gilt und in pflanzlichen Arzneimitteln verwendet wird; jedoch, Es hat immer noch Östrogen-bezogene Bedenken29 und kann akute Toxizität wahrscheinlich durch oxidative Phosphorylierung Entkopplungverursachen 30. Als nächstes ist das 1,4-Benzenediol, Hydrochinon genannt, eine phenolische Verbindung, die eine unspezifische und zytotoxische Immunantwort bei Fischen31auslösen kann. Schließlich ist bekannt, dass das 4-Hexylphenol eine ausreichende positive östrogene Aktivität aufweist, um als ED32eingestuft zu werden. Es wurde gut untersucht, dass der Hauptgrund für die akute Toxizität von Hydrochinon die Reduktion-Oxidation (Redox) Radfahren ist. Das Hydrochinon wird zu Benzochinon oxidiert und wiederholt auf Semichinon oder Hydrochinon reduziert, mit erschöpfenden Kofaktoren und der Erzeugung reaktiver Sauerstoffspezies33. Die beiden anderen Chemikalien erfordern möglicherweise tiefergehende Untersuchungen, um ihre Wirkmechanismen in der akuten Ökotoxizität anhand molekularer Docking-Ansätze wie der von Panche et al.34verwendeten zu offenbaren, die nicht von der QSAR Toolbox abgedeckt werden können.
EDs stören das endokrine System vor allem durch physikalisch-chemische Wechselwirkungen mit Steroid-Rezeptoren wie Östrogen und Androgen-Rezeptoren, die von erheblichem Interesse in QSAR-ModellierungStudien35sind. In an betracht zu nehmen, ist die QSAR Toolbox robust in Bezug auf die einfache und schnelle Klassifizierung von ER-Bindungsaffinitäten für eine Reihe von Chemikalien, die nur auf den 2D-Deskriptoren molekularer Strukturen basieren. Als dieses ER-Profilersystem auf unsere ED-Liste angewendet wurde, wurde keine eindeutige Korrelation zwischen ER-Bindungsaffinität und Hydrophobie gefunden (Ergänzende Abbildung S2). Dieses Ergebnis kann durch die Tatsache erklärt werden, dass die Bildung eines Steroid-Rezeptor-Komplexes keine direkte Folge eines hydrophoben Bindungsbeitrags ist, sondern von einer konformen Veränderung der Wirkstoff-Rezeptorstruktur begleitet werden sollte36. Die Rezeptorbindung kann auch durch Wasserstoff-Bindung und -Stacking erfolgen.
Darüber hinaus kann die Position jeder chemischen Gruppe auf dem Molekül die Rezeptorbindung beeinflussen, auch wenn die Hydrophobie und die Anzahl der Wasserstoff-Bond-Akzeptoren-Spender gleich bleiben. Zweitens erzeugte der ER-Profiler gegenteilige Trends zwischen vorhergesagten und experimentellen LC 50-Mittelwerten mit zunehmender ER-Bindungsaffinität (Abbildung 5). Dies kann daran liegen, dass die Letalität der Eltern in einem akuten Toxizitätstest nicht auf ER-Bindung zurückzuführen ist, sondern in den meisten Fällen auf Narkose oder auf Redox-Zyklus im Falle von Hydrochinon. Beispielsweise ist eine umfassendere Analyse, einschließlich der chronischen Toxizität, erforderlich, damit ein größerer Satz von EDs prädiktive Einschränkungen der aktuellen Version der QSAR Toolbox definieren kann.
Diese vorläufige Forschung kann auch Auswirkungen auf die öffentliche Gesundheit haben, weil Steroide (Androgene, Östrogene, Gestagene, und Kortikoide) und ihre Rezeptoren ähnliche oder sogar identische makromolekulare Strukturen über Wirbeltiere aufweisen5. Diese Arten von analogen endokrineSignalsystemen können mit einem gemeinsamen Mechanismus in Schlüsselereignissen von EDs5arbeiten. Dennoch sind zusätzliche und ergänzende Methoden erforderlich, um diesen gewaltigen und komplexen Aspekt zu beleuchten [z. B. durch eine rechnerische Modellierung von Absorption, Verteilung, Stoffwechsel und Ausscheidung (ADME) und/oder negativen Ergebnissen. (AOP)]38. Da die meisten wissenschaftlichen und öffentlichen Bedenken hinsichtlich der nachteiligen Auswirkungen von EDs auf ihre chronischen Toxizitäten, die Verbesserung der Datenbanken und Algorithmen in der QSAR Toolbox und die Herstellung einer zuverlässigen Langzeitökotoxikologie Vorhersagen für EDs sind beide notwendig.
Dieses Papier zeigt die Anwendung der QSAR Toolbox zum Vergleich ökotoxikologischer LC50-Werte für Fische mit log10K ow-Werten von EDs. Während des gesamten Protokolls führt es zu schwachen Beziehungen zwischen den beiden Parametern, da es wurden durch frühere Studien (z.B. Kim et al.39) festgestellt, dass Log10Kow kein guter direkter Prädiktor von aquatischem LC50ist. Trotz dieser Einschränkung bietet dieses Protokoll eine allgemeine Überprüfung oder “Vignette”, um zu beschreiben, wie das Dashboard für einen bestimmten Zweck verwendet wird, da es eine gültige Anwendung ist, um die QSAR Toolbox zur Untersuchung von Korrelationen zwischen LC50 (oder ER-Bindung) zu verwenden. Affinität) und log10K ow, oder als Werkzeug für ein schnelles akutes Ökotoxizitätsscreening. Es sei jedoch darauf hingewiesen, dass (1) die Beleuchtung des Zusammenhangs zwischen Östrogenrezeptorbindung und chronischer Toxizität anstelle der akuten Toxizität (Tödlichkeit) relevanter ist, so dass klarere Korrelationen gefunden werden können, und (2) der Androgenrezeptor zusammen mit dem von Östrogen, spielt auch eine entscheidende Rolle bei der reproduktiven Toxizität. Daher ist es für die zukünftige Version der QSAR Toolbox erforderlich, die Vorhersagefunktionen im Lichte dieser beiden Punkte zu verbessern.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Forschung wurde vom National Research Council of Science & Technology (NST) von der südkoreanischen Regierung (MSIP) (Nr. CAP-17-01-KIST Europe) und Projekt 11911.
Materials
| Adobe Acrobat Reader DC | Adobe Systems Software Ireland Limited | NA | Required to view prediction and category report |
| Computer | System: Microsoft Corporation | NA | Recommended system properties: (i) system type: 64 bit, Microsoft Windows 7 or newer, (ii) processor: I5 at 2.4 GHz or faster processor or equivalent AMD CPU, (iii) Installed memory (RAM): 6 GB of RAM, (iv) Hard Disk Drive (HDD): 20 GB free hard drive space |
| Microsoft Editor | Microsoft Corporation | NA | Required to upload a substance list of CAS numbers (batch mode) to the OECD QSAR Toolbox as .txt file (text file) |
| Microsoft Excel 2016 | Microsoft Corporation | NA | Required to export data from OECD QSAR Toolbox as .cvs, .xls or .xlsx files |
| OECD QSAR Toolbox version 4.0 or newer | Organisation for Economic Co-operation and Development |
NA | Required to run OECD QSAR Toolbox Automated Workflows; free download: https://qsartoolbox.org/download/ |
| OriginPro 9 | OriginLab Corporation | NA | Optional program for data analysis; similar tools possible |
References
- Najarian, K., Najarian, S., Gharibzadeh, S., Eichelberger, C. N. . Systems Biology and Bioinformatics: A Computational Approach. , (2009).
- Fujita, T., Iwasa, J., Hansch, C. A new substituent constant, π, derived from partition coefficient. Journal of the American Chemical Society. 86, 5175-5180 (1964).
- Roy, K., Kar, S., Das, R. N. . Understanding the Basics of QSAR for Applications in Pharmaceutical Sciences and Risk Assessment. , (2015).
- Raies, A. B., Bajic, V. B. In silico toxicology: computational methods for the prediction of chemical toxicity. WIREs Computational Molecular Science. 6, 147-172 (2016).
- Hayes, T. B. Welcome to the revolution: integrative biology and assessing the impact of endocrine disruptors on environmental and public health. Integrative Compuational Biology. 45, 321-329 (2005).
- Schug, T. T., et al. Minireview: endocrine disruptors: past lessons and future directions. Molecular Endocrinology. 30, 833-847 (2016).
- Devillers, J., Marchand-Geneste, N., Carpy, A., Porcher, J. M. SAR and QSAR modeling of endocrine disruptors. SAR QSAR Environmental Research. 17, 393-412 (2006).
- Dimitrov, S. D., et al. QSAR Toolbox – workflow and major functionalities. SAR QSAR Environmental Research. 27, 203-219 (2016).
- Yordanova, D., et al. Automated and standardized workflows in the OECD QSAR Toolbox. Computational Toxicology. 10, 89-104 (2019).
- Mombelli, E., Devillers, J. Evaluation of the OECD (Q)SAR Application Toolbox and Toxtree for predicting and profiling the carcinogenic potential of chemicals. SAR QSAR Environmental Research. 21, 731-752 (2010).
- Devillers, J., Mombelli, E., Samsera, R. Structural alerts for estimating the carcinogenicity of pesticides and biocides. SAR QSAR Environmental Research. 22, 89-106 (2011).
- Li, C., et al. Identifying unknown by-products in drinking water using comprehensive two-dimensional gas chromatography-quadrupole mass spectrometry and in silico toxicity assessment. Chemosphere. 163, 535-543 (2016).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 1. Aromatic amines. SAR QSAR Environmental Research. 21, 753-769 (2010).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 2. α-β unsaturated aliphatic aldehydes. SAR QSAR Environmental Research. 21, 771-783 (2010).
- Kulkarni, S. A., Barton-Maclaren, T. S. Performance of (Q)SAR models for predicting Ames mutagenicity of aryl azo and benzidine based compounds. Journal of Environmental Science and Health Part C Environmental Carcinogenesis & Ecotoxicology Reviews. 32, 46-82 (2014).
- Craig, E. A., Wang, N. C., Zhao, Q. J. Using quantitative structure-activity relationship modeling to quantitatively predict the developmental toxicity of halogenated azole compounds. Journal of Applied Toxicology. 34, 787-794 (2014).
- Tebby, C., Mombelli, E., Pandard, P., Péry, A. R. Exploring an ecotoxicity database with the OECD (Q)SAR Toolbox and DRAGON descriptors in order to prioritise testing on algae, daphnids, and fish. Science of the Total Environment. 409, 3334-3343 (2011).
- Mombelli, E. Evaluation of the OECD (Q)SAR Application Toolbox for the profiling of estrogen receptor binding affinities. SAR QSAR Environmental Research. 23, 37-57 (2012).
- Verhaar, H. J. M., van Leeuwen, C. J., Hermens, J. L. M. Classifying environmental pollutants. 1: structure-activity relationships for prediction of aquatic toxicology. Chemosphere. 25, 471-491 (1992).
- Enoch, S. J., Hewitt, M., Cronin, M. T. D., Azam, S., Madden, J. C. Classification of chemicals according to mechanism of aquatic toxicity: an evaluation of the implementation of the Verhaar scheme in Toxtree. Chemosphere. 73, 243-248 (2008).
- Burden, N., Maynard, S. K., Weltje, L., Wheeler, J. R. The utility of QSARs in predicting acute fish toxicity of pesticide metabolites: a retrospective validation approach. Regulatory Toxicology and Pharmacology. 80, 241-246 (2016).
- Nendza, M., et al. Screening for potential endocrine disruptors in fish: evidence from structural alerts and in vitro and in vivo toxicological assays. Environmental Sciences Europe. 28, 26 (2016).
- Roncaglioni, A., Piclin, N., Pintore, M., Benfenati, E. Binary classification models for endocrine disrupter effects mediated through the estrogen receptor. SAR QSAR Environmental Research. 19, 697-733 (2008).
- Sosnovcová, J., Rucki, M., Bendová, H. Estrogen receptor binding affinity of food contact material components estimated by QSAR. Central European Journal of Public Health. 24, 241-244 (2016).
- Walker, J. D., Dearden, J. C., Schultz, T. W., Jaworska, J., Comber, M. H. I., Walker, J. D. QSARs for New Practitioners. QSARs for Pollution Prevention, Toxicity Screening, Risk Assessment, and Web Applications. , (2003).
- Sánchez-Bayo, F. From simple toxicological models to prediction of toxic effects in time). Ecotoxicology. 18, 343-354 (2009).
- Sjöström, M., Lindgren, &. #. 1. 9. 7. ;., Uppgård, L. L., Chen, F., Schüürmann, G. Joint Multivariate Quantitative Structure-Property and Structure-Activity Relationships for a Series of Technical Nonionic Surfactants. Quantitative Structure-Activity Relationships in Environmental Sciences-VII. , (1997).
- Ding, F., Guo, J., Song, W., Hu, W., Li, Z. Comparative quantitative structure-activity relationship (QSAR) study on acute toxicity of triazole fungicides to zebrafish. Chemistry Ecology. 27, 359-368 (2011).
- Galati, G., O’Brien, P. J. Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radical Biology in Medicine. 37, 287-303 (2004).
- Russom, C. L., Bradbury, S. P., Broderius, S. J. Predicting modes of action from chemical structure: acute toxicity in the fathead minnow (Pimephales promelas). Environmental Toxicology and Chemistry. 16, 948-967 (1997).
- Taysse, L., Troutaud, D., Khan, N. A., Deschaux, P. Structure-activity relationship of phenolic compounds (phenol, pyrocatechol and hydroquinone) on natural lymphocytotoxicity of carp (Cyprinus carpio). Toxicology. 98, 207-214 (1995).
- Nishihara, T., et al. Estrogenic activities of 517 chemicals by yeast two-hybrid assay. Journal of Health Science. 46, 282-298 (2000).
- Bolton, J. L., Trush, M. A., Penning, T. M., Dryhurst, G., Monks, T. J. Role of quinones in toxicology. Chemical Research in Toxicology. 13, 135-160 (2000).
- Panche, A. N., Diwan, A. D., Chandra, S. R. Flavonoids: an overview. Journal of Nutritional Science. 5, e47 (2016).
- Li, J., Gramatica, P. QSAR classification of estrogen receptor binders and pre-screening of potential pleiotropic EDCs. SAR QSAR Environmental Research. 21, 657-669 (2010).
- Bohl, M. . Molecular Structure and Biological Activity of Steroids. , (2017).
- Kaminuma, T., Takai-Igarashi, T., Nakano, T., Nakata, K. Modeling of signaling pathways for endocrine disruptors. BioSystems. 55, 23-31 (2000).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: a review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35, 2637-2646 (2016).
- Kim, J. W., et al. Acute toxicity of pharmaceutical and personal care products on freshwater crustacean (Thamnocephalus platyurus) and fish (Oryzias latipes). Journal of Toxicological Sciences. 34, 227-232 (2009).

