In Silico Modeling Method for Computational Aquatic Toxicology of Endocrine Disruptors: A Software-Based Approach Using QSAR Toolbox
Summary
La modellazione Quantitative structure-activity relationship (QSAR) è un metodo rappresentativo assistito dalla bioinformatica nello screening tossicologico. Questo protocollo dimostra come valutare computazionalmente i rischi di interferenti endocrini (ED) in ambienti acquatici. Utilizzando l’OCSE QSAR Toolbox, il protocollo implementa un test in silico per analizzare la tossicità delle ED nei pesci.
Abstract
Le analisi computazionali dei processi tossicologici consentono lo screening ad alto velocità di lavorazione delle sostanze chimiche e la previsione dei loro endpoint nei sistemi biologici. In particolare, i modelli quantitativi di relazione struttura-attività (QSAR) sono stati sempre più applicati per valutare gli effetti ambientali di una pletora di materiali tossici. Negli ultimi anni, alcuni altri tipi evidenziati di tossici sono interferenti endocrini (ED, che sono sostanze chimiche che possono interferire con qualsiasi metabolismo ormonale). Poiché gli ED possono influenzare in modo significativo lo sviluppo e la riproduzione degli animali, è necessario prevedere rapidamente gli effetti negativi dell’uso di ED nelle tecniche in silico. Questo studio presenta un metodo in silico per generare dati di previsione sugli effetti delle ED rappresentative nei vertebrati acquatici, in particolare nelle specie di pesci. Il protocollo descrive un esempio utilizzando il flusso di lavoro automatizzato del software QSAR Toolbox sviluppato dall’Organizzazione per la cooperazione e lo sviluppo economico (OCSE) per consentire previsioni di ecotossicità acuta delle ED. Di conseguenza, vengono determinati i seguenti: (1) calcolo delle correlazioni numeriche tra la concentrazione per il 50% della letalità (LC50) e il coefficiente di partizione octanol-acqua (Kow), (2) prestazioni di uscita in cui l’LC50 i valori determinati negli esperimenti vengono confrontati con quelli generati dai calcoli e (3) la dipendenza dell’affinità di legame del recettore degli estrogeni sulla relazione tra Kow e LC50.
Introduction
I nuovi sviluppi nell’informatica e nella tecnologia computazionale hanno potenziato le scienze biologiche con metodologie quantitative che offrono alta precisione e affidabilità1. In particolare, gli algoritmi utilizzati nella tassonomia molecolare e nella classificazione delle proprietà hanno portato a modelli di relazione quantitativa struttura-attività (QSAR)2. Questi modelli correlano automaticamente le strutture chimiche e le attività biologiche di un dato database chimico e implementano uno screening rapido in silico di una vasta gamma di substrati chimici in base alle loro azioni medicinali o tossicologiche3. Gli strumenti QSAR possono produrre profili di tossicità predittiva in funzione di vettori di caratteristiche di descrittori molecolari (cioè parametri fisici) di sostanze chimiche di interesse per creare numericamente endpoint categorici4. In genere, ogni endpoint quantitativo viene visualizzato come un grafico a dispersione 2D rispetto alle modifiche nei valori del descrittore. Viene quindi generato un modello QSAR utilizzando analisi di regressione lineare (multiple). Una volta che un set di dati è stato sfruttato appieno per costruire un modello QSAR (denominato set di training), il modello viene convalidato statisticamente stimando gli endpoint di un gruppo di sostanze chimiche non incluse nel set di training (denominato set di test). Il modello può quindi essere utilizzato per prevedere le attività biologiche dei composti non testati3.
Tra le molte sostanze chimiche nocive, interferenti endocrini (ED) sono stati evidenziati come un gruppo di tossici che possono interferire in numerosi metabolismo ormonale nei mammiferi, anfibi, e pesce5,6. ED sono noti per indurre una varietà di effetti avversi, come tumori e malformazioni, bloccando o alterando le normali vie ormonali o attivando segnali di sintesi/degradazione ormonale anormale. Di conseguenza, queste sostanze chimiche che imitano gli ormoni possono perturare i sistemi endocrini in modo tale da ostacolare lo sviluppo biologico e la riproduzione delle popolazioni animali selvatiche. In particolare, gli effetti ecotossicologici delle ED sono stati ampiamente studiati nei vertebrati acquatici, che hanno strutture del recettore ormonale quasi identiche a quelle dei mammiferi, compresi gli esseri umani. Poiché tutte le azioni ormonali si verificano a basse dosi in vivo, prevedere le potenziali tossicità dei candidati ED utilizzando rapidi screening in silico è fondamentale per la salute pubblica e ambientale.
Sono stati condotti modelli QSAR basati sulla tossicologia degli Ed, utilizzando descrittori 2D e 3D (noti rispettivamente come QSAR 2D e 3D), che rivelano le affinità leganti ligando ED di estrogeni, androgeni e recettori del progesterone7. Nonostante i vantaggi ad alta precisione di QSAR 3D, in cui vengono considerate le interazioni conformazionali ed elettrostatiche, 2D QSAR mantiene la propria robustezza in algoritmi matematici diretti, calcoli rapidi e carichi computazionali estremamente bassi. Inoltre, i modelli 2D-QSAR sono flessibili per l’uso in un’ampia gamma di applicazioni, ottenendo al contempo prestazioni di stima relativamente accurate.
L’OCSE QSAR Toolbox è attualmente uno degli strumenti software per computer più utilizzati, fornendo modelli QSAR liberamente disponibili e pre-costruiti8,9. Il profiler utilizza database descrittori 2D. Dal rilascio della prima versione nel 2008, il software è stato applicato nei settori delle industrie chimiche e biologiche, della salute pubblica e della sicurezza ambientale per un’analisi completa o parziale dei potenziali rischi dei composti naturali e sintetici, con interessi particolari in carcinogenesi10,11,12, mutagenicità13,14,15, e tossicità dello sviluppo16. È stata inoltre dimostrata l’applicazione alla tossicologia acquatica, con particolare attenzione alla bioaccumulazione e alla biotrasformazione17.
Il QSAR Toolbox si è dimostrato utile nel prevedere la tossicità a breve termine di una vasta gamma di sostanze chimiche17, così come le affinità di legame del recettore estrogeno (ER) di EDs18. Tuttavia, l’ecotossicità acuta delle ED nei vertebrati acquatici non è stata analizzata utilizzando QSAR Toolbox. In questo studio, viene presentato un protocollo tipico e facile per eseguire la modellazione QSAR sugli effetti avversi acuti delle ED con particolare attenzione alle specie ittiche. Lo studio mostra che il QSAR Toolbox è un software altamente accessibile per calcolare e prevedere la letalità/mortalità dei vertebrati acquatici per alcuni ED rappresentativi. La figura 1 mostra lo schema generale per il funzionamento generale del QSAR Toolbox. Il flusso di lavoro illustrato nella Figura 2 fornisce istruzioni semplici su come utilizzare il saggio in silico per prevedere l’ecotossicità acuta di sostanze bersaglio come le sostanze chimiche interferenti endocrine.
Protocol
Representative Results
Discussion
La versatilità della casella degli strumenti QSAR dell’OCSE come software analitico per l’ecotossicologia è mostrata qui con particolare interesse per gli effetti negativi delle sostanze chimiche interferenti endocrine sui vertebrati acquatici. Inoltre, è stato dimostrato un protocollo semplice e standard per prevedere la tossicità acuta (96-h LC50) di 74 ED rappresentativi (Tabella 1) per le specie ittiche. Ciò è stato ottenuto applicando la creazione di categorie, il riempimento delle lacune nei dati e i moduli di profilatura ER incorporati nella casella degli strumenti QSAR (Figura 1, Figura 2).
La correlazione lineare tra il log10LC50 e il log10KOW con una pendenza negativa (come mostrato nella Figura supplementare S1)è stata a lungo conosciuta come una relazione quantitativa standard nelle analisi QSAR25, dove maggiore tossicità, più idrofobica è una determinata sostanza chimica. Come si può vedere da un semplice calcolo, la relazione matematica generale che include l’equazione S1 e l’equazione S2 (Informazionisupplementari ) è un’espressione convertita dalla seguente funzione di potenza26:
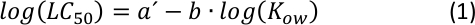

Dal grafico di (Equazione 2), caratterizzando un intervallo intermedio di KOW26 può essere possibile regolando i parametri a e b, dove una certa variazione di idrofobicità (o idrofilia) non cambia in modo significativo il della tossicità acuta.
Analisi comparative tra le previsioni computazionali e le osservazioni sperimentali sull’LC50, come mostrato nella Figura 3 e nella Figura 4, sono state in genere riportate negli studi del QSAR per vari tossici acquatici, tra cui surfactants tecnici nonionici27, triangolari fungicidi28e metaboliti pesticidi21. Questo tipo di convalida retrospettiva fornisce informazioni su quanto un determinato strumento QSAR può raggiungere in termini di prestazioni comparative ai risultati sperimentali. In questo studio di tossicità acuta nei pesci, il QSAR Toolbox è stato dimostrato di fornire previsioni protettive per oltre il 90% delle ED testate in tutti i pesci e in una singola specie, Pimephales promelas.
È necessario identificare ulteriormente le tre sostanze chimiche anomale nella Figura 3 e nella Figura4, che hanno mostrato in media l’LC50 previsto e al minimo, rispettivamente. In primo luogo, il 3′,5,7-triidy-4′,6-dimehoxyisoflavone è un tipo di flavonoide (più specificamente, un isoflavone), che è considerato generalmente sicuro e utilizzato in prodotti farmaceutici a base di erbe; tuttavia, ha ancora problemi legati agli estrogeni29 e può causare tossicità acuta probabilmente attraverso il fosfororylazione ossidativa disaccoppiamento30. Successivamente, il 1,4-benzenediolo, chiamato idroquinone, è un composto fenolico che può innescare una risposta immunitaria non specifica e citotossica nel pesce31. Infine, il 4-esilfenolo è stato conosciuto per esibire sufficiente attività estrogenica positiva per essere classificato come un ED32. È stato ben studiato che la ragione principale della tossicità acuta dell’idroquinone è il ciclo di riduzione-ossidazione (redox). L’idroquinone viene ossidato al benzoquinone e ridotto a semi-quinone o idroquinone ripetutamente, con cofattori impoveriti e generando specie reattive di ossigeno33. Le altre due sostanze chimiche possono richiedere indagini più approfondite per rivelare i loro meccanismi di azione nell’ecotossicità acuta utilizzando approcci di attracco molecolare come quello utilizzato da Panche et al.34, che non possono essere coperti dalla casella degli strumenti QSAR.
EDs interferire con il sistema endocrino principalmente attraverso interazioni fisico con recettori steroidei come recettori estrogeni e androgeni, che sono di notevole interesse negli studi di modellazione QSAR35. Considerando questo, il QSAR Toolbox è robusto in termini di facile e rapida classificazione delle affinità di legame ER per una serie di sostanze chimiche basate solo sui descrittori 2D delle strutture molecolari. Quando questo sistema di profiler ER è stato applicato alla nostra lista di ED, non è stata trovata una chiara correlazione tra affinità di legame ER e idrofobicità (Figura supplementare S2). Questo risultato può essere spiegato dal fatto che la formazione di un complesso steroide-recettore non è una conseguenza diretta di un contributo di legame idrofobico, ma dovrebbe essere accompagnata da un cambiamento conformazionale nella struttura del recettore del sito attivo36. Il legame del recettore può essere dovuto anche al legame dell’idrogeno e all’impilamento z-
Inoltre, la posizione di ogni gruppo chimico sulla molecola può influenzare il legame del recettore, anche se l’idrofobicità e il numero di accettatori-donatori di legame di idrogeno rimangono gli stessi. In secondo luogo, il profiler ER ha prodotto tendenze contrarie tra i livelli medi l’LC50 previsti e quelli sperimentali con un’affinità di legame ER crescente (Figura 5). Questo può essere dovuto al fatto che la letalità dei genitori in un test di tossicità acuta non è dovuta al legame CON, ma piuttosto alla narcosi nella maggior parte dei casi, o al ciclo di ridox nel caso dell’idroquinone. Ad esempio, è necessaria un’analisi più approfondita, inclusa la tossicità cronica, affinché un insieme più ampio di ED definisca limitazioni predittive della versione corrente di QSAR Toolbox.
Questa ricerca preliminare può anche avere implicazioni per la salute pubblica perché gli steroidi (androgeni, estrogeni, progestini, e corticoidi) e loro recettori presentano strutture macromolecolari simili o addirittura identiche tra vertebrati5. Questi tipi di sistemi di segnalazione endocrina analoghi possono funzionare utilizzandoun meccanismo comune negli eventi chiave di ED5 . Tuttavia, sono necessarie metodologie aggiuntive e complementari per illuminare questo aspetto vasto e complesso [ad esempio, eseguendo la modellazione computazionale dell’assorbimento, della distribuzione, del metabolismo e dell’escrezione (ADME) e/o dei risultati negativi (AOP)]38. Inoltre, poiché la maggior parte delle preoccupazioni scientifiche e pubbliche sollevate circa gli effetti negativi degli ED sono legate alle loro tossicità croniche, migliorando i database e gli algoritmi nel QSAR Toolbox e producendo un’ecotossiciologia affidabile a lungo termine previsioni per ed sono entrambe necessarie.
Questo documento dimostra l’applicazione di QSAR Toolbox per confrontare i valori di LC50 ecotossicologico per i pesci con i valori di log10Kow di EDs. è stato rivelato da studi precedenti (ad esempio, Kim et al.39) che il log10Kow non è un buon predittore diretto di LC50acquatico . Nonostante questa limitazione, questo protocollo fornisce una revisione generale o “vignetta” per descrivere come utilizzare il dashboard per un determinato scopo, poiché si tratta di un’applicazione valida per utilizzare la casella degli strumenti QSAR per analizzare le correlazioni tra LC50 (o binding ER affinità) e il log10Kow, o come strumento per uno screening rapido dell’ecotossicità acuta. Tuttavia, va notato che (1) illuminare il legame tra il legame del recettore estrogeno e la tossicità cronica, piuttosto che la tossicità acuta (letalità), è più rilevante in modo che possano essere trovate correlazioni più chiare e (2) il recettore degli androgeni, insieme con quello degli estrogeni, svolge anche un ruolo fondamentale nella tossicità riproduttiva. Pertanto, è necessario per la versione futura di QSAR Toolbox per migliorare le funzioni di stima alla luce di questi due punti.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata sostenuta dalla sovvenzione del National Research Council of Science & Technology (NST) dal governo sudcoreano (MSIP) (N.. CAP-17-01-KIST Europe) e il progetto 11911.
Materials
| Adobe Acrobat Reader DC | Adobe Systems Software Ireland Limited | NA | Required to view prediction and category report |
| Computer | System: Microsoft Corporation | NA | Recommended system properties: (i) system type: 64 bit, Microsoft Windows 7 or newer, (ii) processor: I5 at 2.4 GHz or faster processor or equivalent AMD CPU, (iii) Installed memory (RAM): 6 GB of RAM, (iv) Hard Disk Drive (HDD): 20 GB free hard drive space |
| Microsoft Editor | Microsoft Corporation | NA | Required to upload a substance list of CAS numbers (batch mode) to the OECD QSAR Toolbox as .txt file (text file) |
| Microsoft Excel 2016 | Microsoft Corporation | NA | Required to export data from OECD QSAR Toolbox as .cvs, .xls or .xlsx files |
| OECD QSAR Toolbox version 4.0 or newer | Organisation for Economic Co-operation and Development |
NA | Required to run OECD QSAR Toolbox Automated Workflows; free download: https://qsartoolbox.org/download/ |
| OriginPro 9 | OriginLab Corporation | NA | Optional program for data analysis; similar tools possible |
References
- Najarian, K., Najarian, S., Gharibzadeh, S., Eichelberger, C. N. . Systems Biology and Bioinformatics: A Computational Approach. , (2009).
- Fujita, T., Iwasa, J., Hansch, C. A new substituent constant, π, derived from partition coefficient. Journal of the American Chemical Society. 86, 5175-5180 (1964).
- Roy, K., Kar, S., Das, R. N. . Understanding the Basics of QSAR for Applications in Pharmaceutical Sciences and Risk Assessment. , (2015).
- Raies, A. B., Bajic, V. B. In silico toxicology: computational methods for the prediction of chemical toxicity. WIREs Computational Molecular Science. 6, 147-172 (2016).
- Hayes, T. B. Welcome to the revolution: integrative biology and assessing the impact of endocrine disruptors on environmental and public health. Integrative Compuational Biology. 45, 321-329 (2005).
- Schug, T. T., et al. Minireview: endocrine disruptors: past lessons and future directions. Molecular Endocrinology. 30, 833-847 (2016).
- Devillers, J., Marchand-Geneste, N., Carpy, A., Porcher, J. M. SAR and QSAR modeling of endocrine disruptors. SAR QSAR Environmental Research. 17, 393-412 (2006).
- Dimitrov, S. D., et al. QSAR Toolbox – workflow and major functionalities. SAR QSAR Environmental Research. 27, 203-219 (2016).
- Yordanova, D., et al. Automated and standardized workflows in the OECD QSAR Toolbox. Computational Toxicology. 10, 89-104 (2019).
- Mombelli, E., Devillers, J. Evaluation of the OECD (Q)SAR Application Toolbox and Toxtree for predicting and profiling the carcinogenic potential of chemicals. SAR QSAR Environmental Research. 21, 731-752 (2010).
- Devillers, J., Mombelli, E., Samsera, R. Structural alerts for estimating the carcinogenicity of pesticides and biocides. SAR QSAR Environmental Research. 22, 89-106 (2011).
- Li, C., et al. Identifying unknown by-products in drinking water using comprehensive two-dimensional gas chromatography-quadrupole mass spectrometry and in silico toxicity assessment. Chemosphere. 163, 535-543 (2016).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 1. Aromatic amines. SAR QSAR Environmental Research. 21, 753-769 (2010).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 2. α-β unsaturated aliphatic aldehydes. SAR QSAR Environmental Research. 21, 771-783 (2010).
- Kulkarni, S. A., Barton-Maclaren, T. S. Performance of (Q)SAR models for predicting Ames mutagenicity of aryl azo and benzidine based compounds. Journal of Environmental Science and Health Part C Environmental Carcinogenesis & Ecotoxicology Reviews. 32, 46-82 (2014).
- Craig, E. A., Wang, N. C., Zhao, Q. J. Using quantitative structure-activity relationship modeling to quantitatively predict the developmental toxicity of halogenated azole compounds. Journal of Applied Toxicology. 34, 787-794 (2014).
- Tebby, C., Mombelli, E., Pandard, P., Péry, A. R. Exploring an ecotoxicity database with the OECD (Q)SAR Toolbox and DRAGON descriptors in order to prioritise testing on algae, daphnids, and fish. Science of the Total Environment. 409, 3334-3343 (2011).
- Mombelli, E. Evaluation of the OECD (Q)SAR Application Toolbox for the profiling of estrogen receptor binding affinities. SAR QSAR Environmental Research. 23, 37-57 (2012).
- Verhaar, H. J. M., van Leeuwen, C. J., Hermens, J. L. M. Classifying environmental pollutants. 1: structure-activity relationships for prediction of aquatic toxicology. Chemosphere. 25, 471-491 (1992).
- Enoch, S. J., Hewitt, M., Cronin, M. T. D., Azam, S., Madden, J. C. Classification of chemicals according to mechanism of aquatic toxicity: an evaluation of the implementation of the Verhaar scheme in Toxtree. Chemosphere. 73, 243-248 (2008).
- Burden, N., Maynard, S. K., Weltje, L., Wheeler, J. R. The utility of QSARs in predicting acute fish toxicity of pesticide metabolites: a retrospective validation approach. Regulatory Toxicology and Pharmacology. 80, 241-246 (2016).
- Nendza, M., et al. Screening for potential endocrine disruptors in fish: evidence from structural alerts and in vitro and in vivo toxicological assays. Environmental Sciences Europe. 28, 26 (2016).
- Roncaglioni, A., Piclin, N., Pintore, M., Benfenati, E. Binary classification models for endocrine disrupter effects mediated through the estrogen receptor. SAR QSAR Environmental Research. 19, 697-733 (2008).
- Sosnovcová, J., Rucki, M., Bendová, H. Estrogen receptor binding affinity of food contact material components estimated by QSAR. Central European Journal of Public Health. 24, 241-244 (2016).
- Walker, J. D., Dearden, J. C., Schultz, T. W., Jaworska, J., Comber, M. H. I., Walker, J. D. QSARs for New Practitioners. QSARs for Pollution Prevention, Toxicity Screening, Risk Assessment, and Web Applications. , (2003).
- Sánchez-Bayo, F. From simple toxicological models to prediction of toxic effects in time). Ecotoxicology. 18, 343-354 (2009).
- Sjöström, M., Lindgren, &. #. 1. 9. 7. ;., Uppgård, L. L., Chen, F., Schüürmann, G. Joint Multivariate Quantitative Structure-Property and Structure-Activity Relationships for a Series of Technical Nonionic Surfactants. Quantitative Structure-Activity Relationships in Environmental Sciences-VII. , (1997).
- Ding, F., Guo, J., Song, W., Hu, W., Li, Z. Comparative quantitative structure-activity relationship (QSAR) study on acute toxicity of triazole fungicides to zebrafish. Chemistry Ecology. 27, 359-368 (2011).
- Galati, G., O’Brien, P. J. Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radical Biology in Medicine. 37, 287-303 (2004).
- Russom, C. L., Bradbury, S. P., Broderius, S. J. Predicting modes of action from chemical structure: acute toxicity in the fathead minnow (Pimephales promelas). Environmental Toxicology and Chemistry. 16, 948-967 (1997).
- Taysse, L., Troutaud, D., Khan, N. A., Deschaux, P. Structure-activity relationship of phenolic compounds (phenol, pyrocatechol and hydroquinone) on natural lymphocytotoxicity of carp (Cyprinus carpio). Toxicology. 98, 207-214 (1995).
- Nishihara, T., et al. Estrogenic activities of 517 chemicals by yeast two-hybrid assay. Journal of Health Science. 46, 282-298 (2000).
- Bolton, J. L., Trush, M. A., Penning, T. M., Dryhurst, G., Monks, T. J. Role of quinones in toxicology. Chemical Research in Toxicology. 13, 135-160 (2000).
- Panche, A. N., Diwan, A. D., Chandra, S. R. Flavonoids: an overview. Journal of Nutritional Science. 5, e47 (2016).
- Li, J., Gramatica, P. QSAR classification of estrogen receptor binders and pre-screening of potential pleiotropic EDCs. SAR QSAR Environmental Research. 21, 657-669 (2010).
- Bohl, M. . Molecular Structure and Biological Activity of Steroids. , (2017).
- Kaminuma, T., Takai-Igarashi, T., Nakano, T., Nakata, K. Modeling of signaling pathways for endocrine disruptors. BioSystems. 55, 23-31 (2000).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: a review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35, 2637-2646 (2016).
- Kim, J. W., et al. Acute toxicity of pharmaceutical and personal care products on freshwater crustacean (Thamnocephalus platyurus) and fish (Oryzias latipes). Journal of Toxicological Sciences. 34, 227-232 (2009).

