内分泌破壊物質の計算水毒性学のためのシリコモデリング法:QSARツールボックスを用いたソフトウェアベースのアプローチ
Summary
定量的構造活性関係(QSAR)モデリングは、毒物学的スクリーニングにおける代表的なバイオインフォマティクス支援方法である。このプロトコルは、水生環境における内分泌破壊物質(ED)のリスクを計算的に評価する方法を示しています。OECD QSARツールボックスを利用して、プロトコルは魚のESの毒性を分析するためのシリコアッセイを実装します。
Abstract
毒物学的プロセスの計算分析により、化学物質のハイスループットスクリーニングと生物学的システムにおけるエンドポイントの予測が可能になります。特に、大量の有害物質の環境影響を評価するために、定量的構造活性関係(QSAR)モデルがますます適用されています。近年、いくつかのより強調されたタイプの毒性物質は内分泌破壊物質(ED、ホルモン関連の代謝を妨げる可能性のある化学物質である)である。EDは動物の発達や繁殖に大きな影響を与える可能性があるため、シリコ技術を用いたEDの悪影響を迅速に予測する必要があります。本研究では、水生脊椎動物、特に魚種における代表的なEDの影響に関する予測データを生成するシリコ法を提示する。このプロトコルは、経済協力開発機構(OECD)が開発したQSARツールボックスソフトウェアの自動化ワークフローを利用して、EDの急性生態毒性予測を可能にする例を説明する。その結果、(1)致死率の50%の濃度(LC50)とオクタノール水分位係数(Kow)の間の数値相関の計算、(2)LC50の出力性能が決定される。実験で決定された値は、計算によって生成されたものと比較され、(3)KowとLC50との関係に対するエストロゲン受容体結合親和性の依存性。
Introduction
情報学と計算技術の新しい発展は、高精度と信頼性を提供する定量的な方法論で生物科学に力を与えました1.特に、分子分類および特性分類に使用されるアルゴリズムは、定量的構造活性関係(QSAR)モデル2をもたらした。これらのモデルは、特定の化学データベースの化学構造および生物学的活性を自動的に相関させ、その薬効または毒性作用3に従って広範囲の化学基質のシリコスクリーニングを迅速に実施する。QSARツールは、目的とする化学物質の分子記述子の特徴ベクター(すなわち、物理化学的パラメータ)の機能として予測毒性プロファイルを生成し、カテゴリーエンドポイント4を数値的に作成することができる。通常、各定量的なエンドポイントは、記述子値の変更と 2D 散布図として表示されます。次に、(複数の) 線形回帰解析を使用して QSAR モデルが生成されます。データセットが完全に利用され、QSAR モデル (トレーニング セットと呼ばれる) を構築すると、モデルはトレーニング セットに含まれていない化学物質のグループのエンドポイント (テスト セットと呼ばれる) を予測することによって統計的に検証されます。このモデルは、未テスト化合物3の生物学的活性を予測するために使用することができる。
多くの有害な化学物質の中で、内分泌破壊物質(ED)は、哺乳類、両生類、および魚5、6における多数のホルモン関連代謝を妨げる可能性のある毒性物質のグループとして強調されている。EDsは、正常なホルモン経路を遮断または変更したり、異常なホルモン合成/分解シグナルを活性化することによって、癌や奇形などの様々な副作用を誘発することが知られている。その結果、これらのホルモン模倣化学物質は、野生動物集団の生物学的発達と繁殖が妨げられるような内分泌系を乱す可能性がある。特に、ヒトを含む哺乳類とほぼ同じホルモン受容体構造を有する水生脊椎動物において、EDの生態毒性効果が広範囲に研究されている。すべてのホルモン作用は生体内の低用量で起こるので、シリコスクリーニングの迅速な使用を使用してED候補の潜在的な毒性を予測することは、公衆および環境保健にとって重要である。
EDの毒性学に基づくQSARモデルは、2Dおよび3D記述子(それぞれ2Dおよび3D QSARとして知られている)を利用して行われており、エストロゲン、アンドロゲン、およびプロゲステロン受容体7のEDリガンド結合親和性を明らかにした。立体構造と静電の相互作用が考慮される 3D QSAR の高精度の利点にもかかわらず、2D QSAR は直接数学的アルゴリズム、迅速な計算、および非常に低い計算負荷で独自の堅牢性を保持します。さらに、2D-QSARモデルは、比較的正確な予測性能を達成しながら、幅広いアプリケーションでの使用に柔軟です。
OECD QSARツールボックスは、現在、最も利用されているコンピュータソフトウェアツールの一つであり、自由に利用可能で、事前に構築されたQSARモデル8、9を提供しています。そのプロファイラは、2D 記述子データベースを使用します。2008年の最初のバージョンのリリース以来、ソフトウェアは、天然および合成化合物の潜在的なリスクの完全または部分的な分析のために、化学および生物産業、公衆衛生、および環境安全の分野で適用され、発癌10、11、12、変異体13、14、15、および発達毒性16に関する特別な関心。水生毒性学への応用も実証されており、生体蓄積および生体変換17に焦点を当てている。
QSARツールボックスは、幅広い化学物質17の短期的毒性、ならびにESDs18のエストロゲン受容体(ER)結合親和性を予測するのに有用であることが証明されている。しかし、水生脊椎動物におけるEDの急性生態毒性は、QSARツールボックスを用いて分析されていない。本研究では、魚種に焦点を当てたEDの急性有害性に関するQSARモデリングを行う典型的な、顔のプロトコルが提示される。この研究は、QSARツールボックスが、いくつかの代表的なEDの水生脊椎動物の致死率/死亡率を計算および予測するための非常にアクセス性の高いソフトウェアであることを示している。図 1は、QSAR ツールボックスの一般的な操作の全体的なスキームを示しています。図2に示すワークフローは、内分泌破壊化学物質などの標的物質の急性生態毒性を予測するために、シリコアッセイを操作する方法について簡単な指示を提供します。
Protocol
Representative Results
Discussion
生態毒性学の分析ソフトウェアとしてのOECD QSARツールボックスの汎用性は、水生脊椎動物に対する内分泌破壊化学物質の悪影響に特に関心を持ってここに示されています。さらに、魚種に対する74の代表的なED(表1)の急性毒性(96-h LC50)を予測するための簡易かつ標準的なプロトコルが実証された。これは、カテゴリ構築、データ ギャップ充填、および QSAR ツールボックスに埋め込まれた ER プロファイリング モジュールを適用することによって実現されました (図1、図2)。
負の傾きのあるログ10LC50と log10KOWの線形相関 (補足図 S1に示すように) は、QSAR 分析25の標準的な定量関係として長い間知られていました。より高い毒性は、与えられた化学物質がより疎水性であることを示す。単純な計算から分かるように、式S1と式S2(補足情報)を含む一般的な数学的関係は、以下の力関数26から変換された式である:
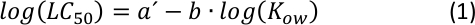

(式分2)のプロットから、KOW26の中間範囲を特徴特徴付け、及びb及びb及びb及びbを調整することにより、疎化性(または親水性)の一定ばばばばばばばばばばばしてはがれ、疎化性(または親水性)の一定ばばばばばばばばばばばばばばばばばばばばばばばばばばばばばばおり、疎和性(または親水性)の一定ばばばばばばばばばばばばばばばばばばばは、疎化(または親水性)の一定ばば急性毒性のエンドポイント。
図3と図4に示すように、LC50の計算予測と実験観測との比較分析は、典型的には、様々な水生毒性物質に関するQSARの研究で報告されている。技術的なニオニオニック界面活性剤27、トリアゾール殺菌剤28、および農薬代謝産物21。このタイプの遡及検証は、特定の QSAR ツールが実験結果との比較パフォーマンスの観点からどの程度到達できるかに関する情報を提供します。魚の急性毒性のこの研究では、QSARツールボックスは、すべての魚と単一の種でテストされたEDの90%以上の保護予測を提供することが証明されました,ピメファレスプロメラ.
図3および図4の3つの外れ値化学物質をさらに同定し、平均および最低で高い予測LC50を示した。まず、3′,5,7-トリヒドロキシ-4’、6-ジメトキシソフラボンはフラボノイドの一種(より具体的には、イソフラボン)であり、一般的に安全であると考えられ、ハーブ医薬品で使用される。しかし、それはまだエストロゲン関連の懸念29を有し、おそらく酸化リン酸化を通じて急性毒性を引き起こす可能性があります30.次に、ヒドロキノンと呼ばれる1,4−ベンゼンネジオールは、魚31において非特異的および細胞傷害性免疫応答を引き起こすことができるフェノール化合物である。最後に、4-ヘキシルフェノールは、ED32として分類されるのに十分な陽性エストロゲン活性を示することが知られている。ヒドロキノンの急性毒性の主な理由は、還元酸化(酸化)サイクリングであることがよく研究されています。ヒドロキノンはベンゾキノンに酸化され、副因子を枯渇させ、活性酸素種33を生成して、繰り返しセミキノンまたはヒドロキノンに還元される。他の2つの化学物質は、QSARツールボックスではカバーできないPanche et al.34で使用されるような分子ドッキングアプローチを使用して、急性生態毒性における作用機序を明らかにするために、より深い調査を必要とする可能性があります。
EDは、主にエストロゲンおよびアンドロゲン受容体などのステロイド受容体との物理化学的相互作用を介して内分泌系を妨害し、これはQSARモデリング研究35にかなりの関心を持っている。これを考慮すると、QSARツールボックスは、分子構造の2D記述子のみに基づく化学物質のセットに対するER結合親和性の表面的かつ迅速な分類の点で堅牢です。このERプロファイラシステムを我々のEDのリストに適用したところ、ER結合親和性と疎水性との間に明確な相関関係は見出されなかった(補足図S2)。この結果は、ステロイド受容体複合体の形成が疎水性結合寄与の直接的な結果ではないが、活性部位受容体構造36の立体構造変化を伴うべきであるという事実によって説明され得る。受容体結合はまた、水素結合およびπ積み重ねに起因し得る。
さらに、分子上の各化学基の位置は、疎水性および水素結合受入器ドナーの数が同じままであっても、受容体結合に影響を与える可能性がある。第二に、ERプロファイラは、予測されたLC50と実験LC50の間の逆の傾向を生み出し、ER結合親和性を増加させる(図5)。これは、急性毒性試験における親の致死性は、ER結合によるものではなく、ほとんどの場合ナルコシス、またはヒドロキノンの場合の酸化還元サイクルによるものである可能性がある。たとえば、慢性毒性を含むより広範な分析は、現在のバージョンの QSAR ツールボックスの予測制限を定義するために、より大きな一連の ED に必要です。
ステロイド(アンドロゲン、エストロゲン、プロゲスチン、コルチコイド)とその受容体は脊椎動物5全体で類似または同一の高分子構造を示すので、この予備的な研究はまた、公衆衛生に影響を与える可能性があります。これらのタイプの類似内分泌シグナル伝達システムは、EDs5の主要事象において共通のメカニズムを使用して動作してもよい。それにもかかわらず、この広大で複雑な側面を照らすには、追加的で補完的な方法論が必要です[例えば、吸収、分布、代謝、排泄(ADME)、および/または有害な結果の計算モデリングを行うことによって)経路 (AOP)]38.さらに、EDの悪影響に関する科学的および一般の懸念のほとんどは、その慢性毒性に関連しているため、QSARツールボックスのデータベースとアルゴリズムを改善し、信頼性の高い長期的な生態毒性学を生み出します。両方の E の予測が必要です。
このホワイト ペーパーでは、QSAR Toolbox の適用を示し、魚の生態毒性 LC50値を、ログ10Kow値の ED の値と比較します。ログ10Kowが水生LC50の良好な直接予測変数ではないことを以前の研究(例えば、Kim et al.39)によって明らかにされた。この制限にもかかわらず、このプロトコルは、LC50(またはERバインディング)間の相関関係を調査するためにQSARツールボックスを使用する有効なアプリケーションであるため、特定の目的のためにダッシュボードを使用する方法を説明する一般的なレビューまたは「ビネット」を提供します。アフィニティ)およびログ10K ow、または急速な急性生態毒性スクリーニングのためのツールとして。それにもかかわらず、(1)急性毒性(致死性)ではなく、エストロゲン受容体結合と慢性毒性との間のリンクを照らすことは、より明確な相関関係が見出され得るように、(2)アンドロゲン受容体を一緒に照らすことに留意すべきである。エストロゲンのそれと, また、生殖毒性に重要な役割を果たしています。.したがって、将来のバージョンの QSAR ツールボックスでは、これらの 2 つの点に照らして予測関数を改善する必要があります。
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、韓国政府の科学技術研究評議会(NST)の助成金(いいえ)によって支援されました。CAP-17-01-KIST ヨーロッパ)およびプロジェクト 11911.
Materials
| Adobe Acrobat Reader DC | Adobe Systems Software Ireland Limited | NA | Required to view prediction and category report |
| Computer | System: Microsoft Corporation | NA | Recommended system properties: (i) system type: 64 bit, Microsoft Windows 7 or newer, (ii) processor: I5 at 2.4 GHz or faster processor or equivalent AMD CPU, (iii) Installed memory (RAM): 6 GB of RAM, (iv) Hard Disk Drive (HDD): 20 GB free hard drive space |
| Microsoft Editor | Microsoft Corporation | NA | Required to upload a substance list of CAS numbers (batch mode) to the OECD QSAR Toolbox as .txt file (text file) |
| Microsoft Excel 2016 | Microsoft Corporation | NA | Required to export data from OECD QSAR Toolbox as .cvs, .xls or .xlsx files |
| OECD QSAR Toolbox version 4.0 or newer | Organisation for Economic Co-operation and Development |
NA | Required to run OECD QSAR Toolbox Automated Workflows; free download: https://qsartoolbox.org/download/ |
| OriginPro 9 | OriginLab Corporation | NA | Optional program for data analysis; similar tools possible |
References
- Najarian, K., Najarian, S., Gharibzadeh, S., Eichelberger, C. N. . Systems Biology and Bioinformatics: A Computational Approach. , (2009).
- Fujita, T., Iwasa, J., Hansch, C. A new substituent constant, π, derived from partition coefficient. Journal of the American Chemical Society. 86, 5175-5180 (1964).
- Roy, K., Kar, S., Das, R. N. . Understanding the Basics of QSAR for Applications in Pharmaceutical Sciences and Risk Assessment. , (2015).
- Raies, A. B., Bajic, V. B. In silico toxicology: computational methods for the prediction of chemical toxicity. WIREs Computational Molecular Science. 6, 147-172 (2016).
- Hayes, T. B. Welcome to the revolution: integrative biology and assessing the impact of endocrine disruptors on environmental and public health. Integrative Compuational Biology. 45, 321-329 (2005).
- Schug, T. T., et al. Minireview: endocrine disruptors: past lessons and future directions. Molecular Endocrinology. 30, 833-847 (2016).
- Devillers, J., Marchand-Geneste, N., Carpy, A., Porcher, J. M. SAR and QSAR modeling of endocrine disruptors. SAR QSAR Environmental Research. 17, 393-412 (2006).
- Dimitrov, S. D., et al. QSAR Toolbox – workflow and major functionalities. SAR QSAR Environmental Research. 27, 203-219 (2016).
- Yordanova, D., et al. Automated and standardized workflows in the OECD QSAR Toolbox. Computational Toxicology. 10, 89-104 (2019).
- Mombelli, E., Devillers, J. Evaluation of the OECD (Q)SAR Application Toolbox and Toxtree for predicting and profiling the carcinogenic potential of chemicals. SAR QSAR Environmental Research. 21, 731-752 (2010).
- Devillers, J., Mombelli, E., Samsera, R. Structural alerts for estimating the carcinogenicity of pesticides and biocides. SAR QSAR Environmental Research. 22, 89-106 (2011).
- Li, C., et al. Identifying unknown by-products in drinking water using comprehensive two-dimensional gas chromatography-quadrupole mass spectrometry and in silico toxicity assessment. Chemosphere. 163, 535-543 (2016).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 1. Aromatic amines. SAR QSAR Environmental Research. 21, 753-769 (2010).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 2. α-β unsaturated aliphatic aldehydes. SAR QSAR Environmental Research. 21, 771-783 (2010).
- Kulkarni, S. A., Barton-Maclaren, T. S. Performance of (Q)SAR models for predicting Ames mutagenicity of aryl azo and benzidine based compounds. Journal of Environmental Science and Health Part C Environmental Carcinogenesis & Ecotoxicology Reviews. 32, 46-82 (2014).
- Craig, E. A., Wang, N. C., Zhao, Q. J. Using quantitative structure-activity relationship modeling to quantitatively predict the developmental toxicity of halogenated azole compounds. Journal of Applied Toxicology. 34, 787-794 (2014).
- Tebby, C., Mombelli, E., Pandard, P., Péry, A. R. Exploring an ecotoxicity database with the OECD (Q)SAR Toolbox and DRAGON descriptors in order to prioritise testing on algae, daphnids, and fish. Science of the Total Environment. 409, 3334-3343 (2011).
- Mombelli, E. Evaluation of the OECD (Q)SAR Application Toolbox for the profiling of estrogen receptor binding affinities. SAR QSAR Environmental Research. 23, 37-57 (2012).
- Verhaar, H. J. M., van Leeuwen, C. J., Hermens, J. L. M. Classifying environmental pollutants. 1: structure-activity relationships for prediction of aquatic toxicology. Chemosphere. 25, 471-491 (1992).
- Enoch, S. J., Hewitt, M., Cronin, M. T. D., Azam, S., Madden, J. C. Classification of chemicals according to mechanism of aquatic toxicity: an evaluation of the implementation of the Verhaar scheme in Toxtree. Chemosphere. 73, 243-248 (2008).
- Burden, N., Maynard, S. K., Weltje, L., Wheeler, J. R. The utility of QSARs in predicting acute fish toxicity of pesticide metabolites: a retrospective validation approach. Regulatory Toxicology and Pharmacology. 80, 241-246 (2016).
- Nendza, M., et al. Screening for potential endocrine disruptors in fish: evidence from structural alerts and in vitro and in vivo toxicological assays. Environmental Sciences Europe. 28, 26 (2016).
- Roncaglioni, A., Piclin, N., Pintore, M., Benfenati, E. Binary classification models for endocrine disrupter effects mediated through the estrogen receptor. SAR QSAR Environmental Research. 19, 697-733 (2008).
- Sosnovcová, J., Rucki, M., Bendová, H. Estrogen receptor binding affinity of food contact material components estimated by QSAR. Central European Journal of Public Health. 24, 241-244 (2016).
- Walker, J. D., Dearden, J. C., Schultz, T. W., Jaworska, J., Comber, M. H. I., Walker, J. D. QSARs for New Practitioners. QSARs for Pollution Prevention, Toxicity Screening, Risk Assessment, and Web Applications. , (2003).
- Sánchez-Bayo, F. From simple toxicological models to prediction of toxic effects in time). Ecotoxicology. 18, 343-354 (2009).
- Sjöström, M., Lindgren, &. #. 1. 9. 7. ;., Uppgård, L. L., Chen, F., Schüürmann, G. Joint Multivariate Quantitative Structure-Property and Structure-Activity Relationships for a Series of Technical Nonionic Surfactants. Quantitative Structure-Activity Relationships in Environmental Sciences-VII. , (1997).
- Ding, F., Guo, J., Song, W., Hu, W., Li, Z. Comparative quantitative structure-activity relationship (QSAR) study on acute toxicity of triazole fungicides to zebrafish. Chemistry Ecology. 27, 359-368 (2011).
- Galati, G., O’Brien, P. J. Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radical Biology in Medicine. 37, 287-303 (2004).
- Russom, C. L., Bradbury, S. P., Broderius, S. J. Predicting modes of action from chemical structure: acute toxicity in the fathead minnow (Pimephales promelas). Environmental Toxicology and Chemistry. 16, 948-967 (1997).
- Taysse, L., Troutaud, D., Khan, N. A., Deschaux, P. Structure-activity relationship of phenolic compounds (phenol, pyrocatechol and hydroquinone) on natural lymphocytotoxicity of carp (Cyprinus carpio). Toxicology. 98, 207-214 (1995).
- Nishihara, T., et al. Estrogenic activities of 517 chemicals by yeast two-hybrid assay. Journal of Health Science. 46, 282-298 (2000).
- Bolton, J. L., Trush, M. A., Penning, T. M., Dryhurst, G., Monks, T. J. Role of quinones in toxicology. Chemical Research in Toxicology. 13, 135-160 (2000).
- Panche, A. N., Diwan, A. D., Chandra, S. R. Flavonoids: an overview. Journal of Nutritional Science. 5, e47 (2016).
- Li, J., Gramatica, P. QSAR classification of estrogen receptor binders and pre-screening of potential pleiotropic EDCs. SAR QSAR Environmental Research. 21, 657-669 (2010).
- Bohl, M. . Molecular Structure and Biological Activity of Steroids. , (2017).
- Kaminuma, T., Takai-Igarashi, T., Nakano, T., Nakata, K. Modeling of signaling pathways for endocrine disruptors. BioSystems. 55, 23-31 (2000).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: a review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35, 2637-2646 (2016).
- Kim, J. W., et al. Acute toxicity of pharmaceutical and personal care products on freshwater crustacean (Thamnocephalus platyurus) and fish (Oryzias latipes). Journal of Toxicological Sciences. 34, 227-232 (2009).

