No método de modelagem silico para Toxicologia aquática computacional de Disruptores endócrinos: uma abordagem baseada em software usando o QSAR Toolbox
Summary
A modelagem quantitativa da relação estrutura-atividade (QSAR) é um método representativo assistido por Bioinformática na triagem toxicológica. Este protocolo demonstra como avaliar computacionalmente os riscos de Disruptores endócrinos (EDs) em ambientes aquáticos. Utilizando a caixa de ferramentas da OCDE QSAR, o protocolo implementa um ensaio de silico para análise da toxicidade de EDs em peixes.
Abstract
Análises computacionais de processos toxicológicos possibilitam a triagem de substâncias químicas de alto débito e previsão de seus Endpoints em sistemas biológicos. Em particular, os modelos quantitativos de relação estrutura-atividade (QSAR) têm sido cada vez mais aplicados para avaliar os efeitos ambientais de uma infinidade de materiais tóxicos. Nos últimos anos, alguns tipos mais destacados de tóxicos são os Disruptores endócrinos (EDs, que são produtos químicos que podem interferir com qualquer metabolismo hormonal-relacionado). Como os EDs podem afetar significativamente o desenvolvimento e a reprodução dos animais, é necessário prever rapidamente os efeitos adversos de EDs usando em técnicas de silico. Este estudo apresenta um método em silico para gerar dados de predição sobre os efeitos de EDs representativos em vertebrados aquáticos, particularmente espécies de peixes. O protocolo descreve um exemplo utilizando o fluxo de trabalho automatizado do software QSAR Toolbox desenvolvido pela organização para a cooperação e desenvolvimento econômico (OCDE) para permitir previsões de ecotoxicidade aguda de EDs. Como resultado, são determinados os seguintes: (1) cálculo das correlações numéricas entre a concentração para 50% de letalidade (LC50) e coeficiente de partição octanol-água (Kow), (2) performances de saída em que o LC50 os valores determinados em experimentos são comparados àqueles gerados por cálculos, e (3) a dependência da afinidade de ligação do receptor de estrogênio na relação entre Kow e LC50.
Introduction
Novos desenvolvimentos em informática e tecnologia computacional capacitaram as ciências biológicas com metodologias quantitativas que oferecem alta precisão e confiabilidade1. Em particular, os algoritmos utilizados na taxonomia molecular e classificação de propriedade resultaram em modelos quantitativos de relação entre estrutura e atividade (QSAR)2. Estes modelos correlacionam automaticamente as estruturas químicas e as atividades biológicas de um dado banco de dados químico e implementam rápida na triagem silico de uma ampla gama de substratos químicos de acordo com suas ações medicinais ou toxicológicas3. As ferramentas QSAR podem produzir perfis de toxicidade preditiva como uma função de vetores de característica de descritores moleculares (ou seja, parâmetros físico-químicos) de produtos químicos de interesse para criar numericamente pontos de extremidade categóricos4. Normalmente, cada ponto de extremidade quantitativo é exibido como um gráfico de dispersão 2D versus alterações nos valores do descritor. Um modelo QSAR é então gerado usando análises de regressão linear (múltiplas). Depois que um conjunto de dados foi totalmente explorado para construir um modelo QSAR (chamado de conjunto de treinamento), o modelo é validado estatisticamente prevendo os pontos de extremidade de um grupo de produtos químicos não incluídos no conjunto de treinamento (chamado de conjunto de teste). O modelo pode então ser usado para prever as atividades biológicas de compostos não testados3.
Entre muitos produtos químicos prejudiciais, os Disruptores endócrinos (EDs) foram destacados como um grupo de tóxicos que podem interferir em metabolismos hormone-relacionados numerosos nos mamíferos, nos anfíbios, e nos peixes5,6. Os EDs são conhecidos por induzir uma variedade de efeitos adversos, como cânceres e malformações, bloqueando ou alterando vias hormonais normais ou ativando sinais anormais de síntese/degradação hormonal. Como consequência, estes hormônio-imitando produtos químicos podem perturbar sistemas endócrinos de tal forma que o desenvolvimento biológico e reprodução de animais selvagens populações são dificultados. Em particular, os efeitos ecotoxicológicos dos EDs têm sido extensivamente investigados em vertebrados aquáticos, que têm estruturas de receptores hormonais quase idênticas às dos mamíferos, incluindo os humanos. Porque todas as ações hormonais ocorrem em doses baixas in vivo, prevendo as toxicidades potenciais de candidatos de ED usando rápido na triagem de silico é fundamental para a saúde pública e ambiental.
Modelos QSAR baseados na toxicologia de EDs têm sido conduzidos utilizando ambos os descritores 2D e 3D (conhecidos como QSAR 2D e 3D, respectivamente), que revelam as afinidades de ligação de ligante ED de estrogênio, andrógeno e receptores de progesterona7. Apesar das vantagens de alta precisão do QSAR 3D, em que as interações conformacionais e eletrostáticas são consideradas, o QSAR 2D retém sua própria robustez em algoritmos matemáticos diretos, cálculos rápidos e cargas computacionais extremamente baixas. Além disso, os modelos 2D-QSAR são flexíveis para uso em uma ampla gama de aplicações, ao mesmo tempo que atingem um desempenho de predição relativamente preciso.
A caixa de ferramentas da OCDE QSAR é atualmente uma das ferramentas de software de computador mais utilizadas, fornecendo modelos QSAR disponíveis e pré-construídos8,9. Seu Profiler usa bancos de dados de descritor 2D. Desde o lançamento da primeira versão em 2008, o software tem sido aplicado nas áreas de indústrias químicas e biológicas, saúde pública e segurança ambiental para análise completa ou parcial dos riscos potenciais de compostos naturais e sintéticos, com interesses especiais em carcinogénese10,11,12, mutagenicidade13,14,15e toxicidade do desenvolvimento16. A aplicação à Toxicologia aquática também tem sido demonstrada, com foco na bioacumulação e biotransformação17.
A caixa de ferramentas QSAR foi comprovada útil na predição da toxicidade de curto prazo de uma ampla gama de produtos químicos17, bem como as afinidades de ligação do receptor de ESTROGÊNIO (er) de EDs18. No entanto, as ecotoxicidades agudas de EDs em vertebrados aquáticos não foram analisadas usando a caixa de ferramentas QSAR. Neste estudo, um protocolo típico e facile é apresentado para executar a modelagem de QSAR nos efeitos adversos agudos de EDs com um foco em espécies de peixes. O estudo mostra que o QSAR Toolbox é um software altamente acessível para calcular e prever a letalidade/mortalidade de vertebrados aquáticos para algumas EDs representativas. os métodos de tratamento estatístico para os conjuntos de dados derivados em silico são apresentados. Figura 1 mostra o esquema geral para a operação geral da caixa de ferramentas QSAR. O fluxo de trabalho mostrado na Figura 2 fornece instruções diretas sobre como operar o ensaio em silico para prever a ecotoxicidade aguda de substâncias-alvo, como produtos químicos de desregulação endócrina.
Protocol
Representative Results
Discussion
A versatilidade da caixa de ferramentas QSAR da OCDE como software analítico para Ecotoxicologia é mostrada aqui com interesse específico nos efeitos adversos dos produtos químicos de desregulação endócrina em vertebrados aquáticos. Além, um protocolo simples e padrão foi demonstrado para prever a toxicidade aguda (96-h LC50) de 74 representante EDs (tabela 1) para espécies de peixes. Isso foi conseguido aplicando-se a construção de categorias, preenchimento de lacunas de dados e módulos de perfilamento de er incorporados na caixa de ferramentas QSAR (Figura 1, Figura 2).
A correlação linear entre o log10LC50 e o log10Kow com uma inclinação negativa (como mostrado na Figura complementar S1) tem sido conhecida como uma relação quantitativa padrão nas análises QSAR25, onde maior toxicidade é mostrada a mais hidrofóbica um dado químico é. Como pode ser visto a partir de um cálculo simples, a relação matemática geral que inclui a equação S1 e a equação S2 (informações complementares) é uma expressão convertida da seguinte função de poder26:
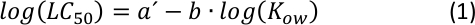

A partir da parcela de (equação 2), caracterizar um intervalo intermediário de Kow26 pode ser possível ajustando os parâmetros a e b, onde uma certa variação na hidrofobicidade (ou hidrofilicidade) não altera significativamente a desfecho de toxicidade aguda.
As análises comparativas entre as predições computacionais e as observações experimentais na LC50, como mostra a Figura 3 e a Figura 4, têm sido tipicamente relatadas em estudos de QSAR para vários tóxicos aquáticos, incluindo surfactantes técnicos não iônicos27, fungicidas triazol28e metabólitos do pesticida21. Este tipo de validação retrospectiva fornece informações sobre o quão longe uma determinada ferramenta QSAR pode chegar em termos de desempenho comparativo para resultados experimentais. Neste estudo de toxicidade aguda em peixes, a caixa de ferramentas QSAR foi comprovada para fornecer previsões protetoras para mais de 90% de EDs testadas em todos os peixes e em uma única espécie, Pimephales vairão gordo.
Além disso, identificar os três produtos químicos outlier na Figura 3 e na Figura 4, que mostraram maior previsto LC50 em média e no mínimo, respectivamente, é necessária. Primeiramente, o 3 ‘, 5, 7-trihydroxy-4 ‘, 6-dimethoxyisoflavone é um tipo de flavonóide (mais especificamente, um Isoflavone), que seja considerado para ser geralmente seguro e usado em produtos farmacêuticos ervais; no entanto, ele ainda tem preocupações relacionadas ao estrogênio29 e pode causar toxicidade aguda provavelmente através de fosforilação oxidativa desengate30. Em seguida, o 1,4-benzenediol, denominado hidroquinona, é um composto fenólico que pode desencadear uma resposta imune não-específica e citotóxica em peixes31. Finalmente, o 4-hexilfenol tem sido conhecido por apresentar uma atividade estrogênica positiva suficiente para ser classificado como um ED32. Tem sido bem estudado que a principal razão da toxicidade aguda da hidroquinona é a redução-oxidação (redox) ciclismo. A hidroquinona é oxidada à benzoquinona e reduzida de volta à semiquinona ou hidroquinona repetidamente, com cofatores de depletização e gerando espécies reativas de oxigênio33. Os outros dois produtos químicos podem exigir investigações mais profundas para revelar seus mecanismos de ação na ecotoxicidade aguda usando abordagens de encaixe molecular, como a usada por panche et al.34, que não podem ser cobertas pela caixa de ferramentas QSAR.
EDs interferir com o sistema endócrino, principalmente através de interações físico-químicas com receptores de esteroides, tais como os receptores de estrogênio e andrógeno, que são de interesse considerável em estudos de modelagem QSAR35. Considerando isso, o QSAR Toolbox é robusto em termos de classificação facile e rápida de afinidades de ligação de ER para um conjunto de produtos químicos baseados apenas nos descritores 2D de estruturas moleculares. Quando este sistema de perfilador de ER foi aplicado à nossa lista de EDs, nenhuma correlação clara foi encontrada entre a afinidade de ligação de ER e a hidrofobicidade (Figura complementar S2). Este resultado pode ser explicado pelo fato de que a formação de um complexo receptor de esteroides não é uma consequência direta de uma contribuição de ligação hidrofóbica, mas deve ser acompanhada por uma mudança conformacional na estrutura do receptor do local ativo36. A ligação do receptor pode ser também devido ao hidrogênio-ligação e π-empilhamento.
Adicionalmente, a posição de cada grupo químico na molécula pode afetar a ligação do receptor, mesmo que a hidrofobicidade e o número de aceitadores de ligação de hidrogênio-doadores permaneçam os mesmos. Em segundo lugar, o profiler de ER produziu tendências contrárias entre os níveis médios previstos e experimentais do LC50 com afinidade de ligação de er crescente (Figura 5). Isso pode ser porque a letalidade dos pais em um teste de toxicidade aguda não se deve à associação de ER, mas sim à narcose na maioria dos casos, ou ao ciclagem redox no caso da hidroquinona. Por exemplo, uma análise mais extensa, incluindo a toxicidade crônica, é necessária para um conjunto maior de EDs definir limitações preditivas da versão atual da caixa de ferramentas QSAR.
Esta pesquisa preliminar também pode ter implicações para a saúde pública porque esteroides (andrógenos, estrogênios, progestines e corticoides) e seus receptores exibem estruturas macromoleculares semelhantes ou mesmo idênticas em vertebrados5. Estes tipos de sistemas de sinalização endócrina análoga podem operar-se usando um mecanismo comum em eventos chaves de EDs5. No entanto, são necessárias metodologias adicionais e complementares para iluminar esse aspecto vasto e complexo [por exemplo, realizando modelagem computacional de absorção, distribuição, metabolismo e excreção (ADME), e/ou desfecho adverso via (AOP)]38. Além disso, porque a maioria das preocupações científicas e públicas levantadas sobre os efeitos adversos dos EDs estão relacionadas com suas toxicidades crônicas, melhorando as bases de dados e algoritmos na caixa de ferramentas QSAR e produzindo confiável Ecotoxicologia a longo prazo previsões para EDs são ambos necessários.
Este artigo demonstra a aplicação do QSAR Toolbox para comparar os valores de LC50 ecotoxicológicos para peixes com valores de log10Kow de EDs. ao longo do protocolo, ele resulta em relações fracas entre os dois parâmetros, como tem foi revelado por estudos prévios (por exemplo, Kim et al.39) que o log10Kow não é um bom preditor direto do LC aquático50. Apesar dessa limitação, este protocolo fornece uma revisão geral ou “vinheta” para descrever como usar o Dashboard para uma determinada finalidade, uma vez que é um aplicativo válido para usar a caixa de ferramentas QSAR para investigar correlações entre LC50 (ou er Binding afinidade) e log10Kow, ou como uma ferramenta para a triagem rápida de ecotoxicidade aguda. No entanto, deve-se notar que (1) iluminar a ligação entre o receptor de estrogênio obrigatório e toxicidade crônica, em vez de toxicidade aguda (letalidade), é mais relevante para que correlações mais claras podem ser encontradas, e (2) o receptor de andrógeno, juntos com o de estrogênio, também desempenha um papel crítico na toxicidade reprodutiva. Portanto, é necessário que a versão futura da caixa de ferramentas QSAR melhore as funções de previsão à luz desses dois pontos.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta pesquisa foi apoiada pelo Conselho Nacional de pesquisa de ciência & tecnologia (NST) concessão pelo governo sul-coreano (MSIP) (não. CAP-17-01-KIST Europe) e projeto 11911.
Materials
| Adobe Acrobat Reader DC | Adobe Systems Software Ireland Limited | NA | Required to view prediction and category report |
| Computer | System: Microsoft Corporation | NA | Recommended system properties: (i) system type: 64 bit, Microsoft Windows 7 or newer, (ii) processor: I5 at 2.4 GHz or faster processor or equivalent AMD CPU, (iii) Installed memory (RAM): 6 GB of RAM, (iv) Hard Disk Drive (HDD): 20 GB free hard drive space |
| Microsoft Editor | Microsoft Corporation | NA | Required to upload a substance list of CAS numbers (batch mode) to the OECD QSAR Toolbox as .txt file (text file) |
| Microsoft Excel 2016 | Microsoft Corporation | NA | Required to export data from OECD QSAR Toolbox as .cvs, .xls or .xlsx files |
| OECD QSAR Toolbox version 4.0 or newer | Organisation for Economic Co-operation and Development |
NA | Required to run OECD QSAR Toolbox Automated Workflows; free download: https://qsartoolbox.org/download/ |
| OriginPro 9 | OriginLab Corporation | NA | Optional program for data analysis; similar tools possible |
References
- Najarian, K., Najarian, S., Gharibzadeh, S., Eichelberger, C. N. . Systems Biology and Bioinformatics: A Computational Approach. , (2009).
- Fujita, T., Iwasa, J., Hansch, C. A new substituent constant, π, derived from partition coefficient. Journal of the American Chemical Society. 86, 5175-5180 (1964).
- Roy, K., Kar, S., Das, R. N. . Understanding the Basics of QSAR for Applications in Pharmaceutical Sciences and Risk Assessment. , (2015).
- Raies, A. B., Bajic, V. B. In silico toxicology: computational methods for the prediction of chemical toxicity. WIREs Computational Molecular Science. 6, 147-172 (2016).
- Hayes, T. B. Welcome to the revolution: integrative biology and assessing the impact of endocrine disruptors on environmental and public health. Integrative Compuational Biology. 45, 321-329 (2005).
- Schug, T. T., et al. Minireview: endocrine disruptors: past lessons and future directions. Molecular Endocrinology. 30, 833-847 (2016).
- Devillers, J., Marchand-Geneste, N., Carpy, A., Porcher, J. M. SAR and QSAR modeling of endocrine disruptors. SAR QSAR Environmental Research. 17, 393-412 (2006).
- Dimitrov, S. D., et al. QSAR Toolbox – workflow and major functionalities. SAR QSAR Environmental Research. 27, 203-219 (2016).
- Yordanova, D., et al. Automated and standardized workflows in the OECD QSAR Toolbox. Computational Toxicology. 10, 89-104 (2019).
- Mombelli, E., Devillers, J. Evaluation of the OECD (Q)SAR Application Toolbox and Toxtree for predicting and profiling the carcinogenic potential of chemicals. SAR QSAR Environmental Research. 21, 731-752 (2010).
- Devillers, J., Mombelli, E., Samsera, R. Structural alerts for estimating the carcinogenicity of pesticides and biocides. SAR QSAR Environmental Research. 22, 89-106 (2011).
- Li, C., et al. Identifying unknown by-products in drinking water using comprehensive two-dimensional gas chromatography-quadrupole mass spectrometry and in silico toxicity assessment. Chemosphere. 163, 535-543 (2016).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 1. Aromatic amines. SAR QSAR Environmental Research. 21, 753-769 (2010).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 2. α-β unsaturated aliphatic aldehydes. SAR QSAR Environmental Research. 21, 771-783 (2010).
- Kulkarni, S. A., Barton-Maclaren, T. S. Performance of (Q)SAR models for predicting Ames mutagenicity of aryl azo and benzidine based compounds. Journal of Environmental Science and Health Part C Environmental Carcinogenesis & Ecotoxicology Reviews. 32, 46-82 (2014).
- Craig, E. A., Wang, N. C., Zhao, Q. J. Using quantitative structure-activity relationship modeling to quantitatively predict the developmental toxicity of halogenated azole compounds. Journal of Applied Toxicology. 34, 787-794 (2014).
- Tebby, C., Mombelli, E., Pandard, P., Péry, A. R. Exploring an ecotoxicity database with the OECD (Q)SAR Toolbox and DRAGON descriptors in order to prioritise testing on algae, daphnids, and fish. Science of the Total Environment. 409, 3334-3343 (2011).
- Mombelli, E. Evaluation of the OECD (Q)SAR Application Toolbox for the profiling of estrogen receptor binding affinities. SAR QSAR Environmental Research. 23, 37-57 (2012).
- Verhaar, H. J. M., van Leeuwen, C. J., Hermens, J. L. M. Classifying environmental pollutants. 1: structure-activity relationships for prediction of aquatic toxicology. Chemosphere. 25, 471-491 (1992).
- Enoch, S. J., Hewitt, M., Cronin, M. T. D., Azam, S., Madden, J. C. Classification of chemicals according to mechanism of aquatic toxicity: an evaluation of the implementation of the Verhaar scheme in Toxtree. Chemosphere. 73, 243-248 (2008).
- Burden, N., Maynard, S. K., Weltje, L., Wheeler, J. R. The utility of QSARs in predicting acute fish toxicity of pesticide metabolites: a retrospective validation approach. Regulatory Toxicology and Pharmacology. 80, 241-246 (2016).
- Nendza, M., et al. Screening for potential endocrine disruptors in fish: evidence from structural alerts and in vitro and in vivo toxicological assays. Environmental Sciences Europe. 28, 26 (2016).
- Roncaglioni, A., Piclin, N., Pintore, M., Benfenati, E. Binary classification models for endocrine disrupter effects mediated through the estrogen receptor. SAR QSAR Environmental Research. 19, 697-733 (2008).
- Sosnovcová, J., Rucki, M., Bendová, H. Estrogen receptor binding affinity of food contact material components estimated by QSAR. Central European Journal of Public Health. 24, 241-244 (2016).
- Walker, J. D., Dearden, J. C., Schultz, T. W., Jaworska, J., Comber, M. H. I., Walker, J. D. QSARs for New Practitioners. QSARs for Pollution Prevention, Toxicity Screening, Risk Assessment, and Web Applications. , (2003).
- Sánchez-Bayo, F. From simple toxicological models to prediction of toxic effects in time). Ecotoxicology. 18, 343-354 (2009).
- Sjöström, M., Lindgren, &. #. 1. 9. 7. ;., Uppgård, L. L., Chen, F., Schüürmann, G. Joint Multivariate Quantitative Structure-Property and Structure-Activity Relationships for a Series of Technical Nonionic Surfactants. Quantitative Structure-Activity Relationships in Environmental Sciences-VII. , (1997).
- Ding, F., Guo, J., Song, W., Hu, W., Li, Z. Comparative quantitative structure-activity relationship (QSAR) study on acute toxicity of triazole fungicides to zebrafish. Chemistry Ecology. 27, 359-368 (2011).
- Galati, G., O’Brien, P. J. Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radical Biology in Medicine. 37, 287-303 (2004).
- Russom, C. L., Bradbury, S. P., Broderius, S. J. Predicting modes of action from chemical structure: acute toxicity in the fathead minnow (Pimephales promelas). Environmental Toxicology and Chemistry. 16, 948-967 (1997).
- Taysse, L., Troutaud, D., Khan, N. A., Deschaux, P. Structure-activity relationship of phenolic compounds (phenol, pyrocatechol and hydroquinone) on natural lymphocytotoxicity of carp (Cyprinus carpio). Toxicology. 98, 207-214 (1995).
- Nishihara, T., et al. Estrogenic activities of 517 chemicals by yeast two-hybrid assay. Journal of Health Science. 46, 282-298 (2000).
- Bolton, J. L., Trush, M. A., Penning, T. M., Dryhurst, G., Monks, T. J. Role of quinones in toxicology. Chemical Research in Toxicology. 13, 135-160 (2000).
- Panche, A. N., Diwan, A. D., Chandra, S. R. Flavonoids: an overview. Journal of Nutritional Science. 5, e47 (2016).
- Li, J., Gramatica, P. QSAR classification of estrogen receptor binders and pre-screening of potential pleiotropic EDCs. SAR QSAR Environmental Research. 21, 657-669 (2010).
- Bohl, M. . Molecular Structure and Biological Activity of Steroids. , (2017).
- Kaminuma, T., Takai-Igarashi, T., Nakano, T., Nakata, K. Modeling of signaling pathways for endocrine disruptors. BioSystems. 55, 23-31 (2000).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: a review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35, 2637-2646 (2016).
- Kim, J. W., et al. Acute toxicity of pharmaceutical and personal care products on freshwater crustacean (Thamnocephalus platyurus) and fish (Oryzias latipes). Journal of Toxicological Sciences. 34, 227-232 (2009).

