В Силико Моделирование Метод для вычислительной водной токсикологии эндокринных разрушители: Программно-ориентированный подход с использованием SAR Toolbox
Summary
Моделирование взаимоотношения между структурой и активностью (ЗСАР) является репрезентативным методом, с помощью биоинформатики при токсикологическом скрининге. Этот протокол демонстрирует, как вычислительно оценивать риски эндокринных разрушители (ED) в водных средах. Используя инструментарий ОЭСР в САР, протокол реализует анализ силико для анализа токсичности EDs в рыбе.
Abstract
Вычислительный анализ токсикологических процессов позволяет высокопрокладываемый скрининг химических веществ и прогнозирование их конечных точек в биологических системах. В частности, для оценки воздействия на окружающую среду множества токсичных материалов все шире применяются модели взаимоотношения между структурами и деятельностью (КСАР). В последние годы, некоторые более подчеркнул типов токсикантов эндокринных разрушители (ЭД, которые являются химическими веществами, которые могут вмешиваться в любой гормон, связанных метаболизм). Поскольку ЭДу может существенно повлиять на развитие и размножение животных, требуется быстрое прогнозирование неблагоприятных последствий ПРИМЕНЕНИЯ ЕД в методах силико. Это исследование представляет собой метод силико для получения данных прогнозирования о воздействии репрезентативных EDs в водных позвоночных, особенно видов рыб. Протокол описывает пример использования автоматизированного рабочего процесса программного обеспечения SAR Toolbox, разработанного Организацией экономического сотрудничества и развития (ОЭСР) для обеспечения острого прогнозирования экотоксичности ИД. В результате определяются следующие: (1) расчет численных корреляций между концентрацией на 50% летальности (LC50) икоэффициентом октанолов-водного перегородки (K ow), (2) выходные характеристики, в которых LC50 значения, определяемые в экспериментах, сравниваются с значениями, генерируемыми вычислениями, и (3) зависимостью связывающей сродства рецепторов эстрогена на взаимосвязи между Kow и LC50.
Introduction
Новые разработки в области информатики и вычислительных технологий дали биологические науки количественные методики, которые предлагают высокую точность и надежность1. В частности, алгоритмы, используемые в молекулярной таксономии и классификации собственности, привели к количественным моделям отношения структуры и деятельности (ЗААР)2. Эти модели автоматически коррелируют химические структуры и биологическую деятельность данной химической базы данных и осуществляют быстрыйсилико-скрининг широкого спектра химических субстратов в соответствии с их лекарственными или токсикологическими действиями 3. Инструменты SAR могут создавать профили прогностической токсичности в качестве функции векторов функций молекулярных дескрипторов (т.е. физикохимических параметров) химических веществ, представляющих интерес для численного создания категориальных конечных точек4. Обычно каждая количественная конечная точка отображается как 2D рассеяние против изменений значений дескриптора. Затем модель SAR генерируется с помощью (многолинейного) линейного анализа регрессии. После того, как набор данных был полностью использован для построения модели SAR (так называемый набор обучения), модель статистически проверяется путем прогнозирования конечных точек группы химических веществ, не включенных в учебный набор (называемый набором испытаний). Затем модель может быть использована для прогнозированиябиологической активности непроверенных соединений 3.
Среди многих вредных химических веществ, эндокринные разрушители (ЭД) были выделены как группа токсикантов, которые могут вмешиваться в многочисленные гормоны, связанные метаболизма у млекопитающих, земноводных и рыбы5,6. EDs, как известно, вызывают различные побочные эффекты, такие как рак и пороки развития, блокируя или изменяя нормальные гормональные пути или активации аномальных гормонов синтеза / деградации сигналов. Как следствие, эти гормон-мимикрирующие химические вещества могут возмущать эндокринную систему таким образом, что биологическое развитие и размножение популяций диких животных затруднено. В частности, экотоксикологические эффекты EDs были широко исследованы в водных позвоночных, которые имеют почти идентичные структуры рецепторов гормонов, чтобы у млекопитающих, в том числе людей. Поскольку все гормональные действия происходят в низких дозах in vivo, прогнозирование потенциальной токсичности ED-кандидатов, использующих быстрый скрининг силико, имеет решающее значение для здоровья населения и окружающей среды.
Модели SAR, основанные на токсикологии ЭД, были проведены с использованием как 2D, так и 3D дескрипторов (известных как 2D и 3D SAR, соответственно), которые показывают, что СВЯЗующие сходства ЭД-лиганд эстроген, андроген и рецепторы прогестерона7. Несмотря на высокоточные преимущества 3D-SAR, в которых рассматриваются конформационные и электростатические взаимодействия, 2D ЗСАР сохраняет собственную надежность в прямых математических алгоритмах, быстрых расчетах и крайне низких вычислительных нагрузках. Кроме того, модели 2D-SAR являются гибкими для использования в широком диапазоне приложений при достижении относительно точной производительности прогнозирования.
ОЭСР SAR Toolbox в настоящее время является одним из наиболее используемых компьютерных программных средств, обеспечивая свободно доступные и предварительно построенные моделиSAR 8,9. Его профайлер использует базы данных 2D дескриптора. С момента выпуска первой версии в 2008 году, программное обеспечение было применено в области химической и биологической промышленности, общественного здравоохранения и экологической безопасности для полного или частичного анализа потенциальных рисков природных и синтетических соединений, с особые интересы в канцерогенезе10,11,12,мутагенность13,14,15,и развитие токсичности16. Применение водной токсикологии также было продемонстрировано, с акцентом на биоаккумуляции и биотрансформации17.
Инструментарий SAR оказался полезным в прогнозировании краткосрочной токсичности широкого спектра химических веществ17, а также рецептор эстрогена (ER) связывающей сродства EDs18. Тем не менее, острая экотоксичальности EDs у водных позвоночных не была проанализирована с помощью инструментария ЗСАР. В этом исследовании представлен типичный и поверхностный протокол для выполнения моделирования ОРВ на острые неблагоприятные последствия ЕД с акцентом на виды рыб. Исследование показывает, что инструментарий ЗСАР является высокодоступным программным обеспечением для расчета и прогнозирования летальности/смертности водных позвоночных для некоторых репрезентативных ЕД. На рисунке 1 показана общая схема общей работы инструментария ЗСАР. Рабочий процесс, показанный на рисунке 2, дает простые инструкции о том, как управлять анализом силико для прогнозирования острой экотоксичности целевых веществ, таких как эндокринные химические вещества.
Protocol
Representative Results
Discussion
Универсальность инструментария ОЭСР в качестве аналитического программного обеспечения для экотоксикологии проявляется здесь с особым интересом к неблагоприятным последствиям эндокринных химических веществ для водных позвоночных. Кроме того, был продемонстрирован простой и стандартный протокол для прогнозирования острой токсичности (96-х LC50) 74 репрезентативных ЭДу(таблица 1) для видов рыб. Это было достигнуто за счет применения здания категории, заполнения пробелов данных и модулей профилирования ER, встроенных в инструментарий SAR(рисунок 1, рисунок 2).
Линейная корреляция между журналом10LC50 и журнал10KOW с отрицательным склоном (как показано на дополнительном рисунке S1) уже давно известна как стандартное количественное соотношение в анализе SAR25, где более высокая токсичность показана более гидрофобной данного химического вещества. Как видно из простого расчета, общее математическое отношение, которое включает в себя уравнение S1 и Equation S2 (Дополнительнаяинформация) является преобразованным выражением из следующей функции питания26:
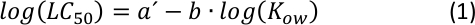

Из сюжета (Equation 2), характеризующий промежуточный диапазон KOW26 может быть возможно путем корректировки параметров a и b, где определенное изменение гидрофобности (или гидрофилии) существенно не меняет конечной точки острой токсичности.
Сравнительный анализ между вычислительными прогнозами и экспериментальными наблюдениями на LC50, как показано на рисунке 3 и рисунке 4, как правило, сообщалось в исследованиях САР для различных водных токсикантов, в том числе технические ненионные сурфактанты27,триазолфные фунгициды28и метаболиты пестицидов21. Этот тип ретроспективной проверки предоставляет информацию о том, как далеко может зайти данный инструмент ОАРС с точки зрения сравнительной производительности экспериментальных результатов. В этом исследовании острой токсичности у рыбы, было доказано, что инструментарий ЗСАР дает защитные прогнозы для более чем 90% проверенных ED s во всех рыб и в одном виде, Pimephales promelas.
Далее выявление трех выбросов химических веществ на рисунке 3 и рисунок 4, который показал более высокий прогнозируемый LC50 в среднем и, как минимум, соответственно, не требуется. Во-первых, 3′,5,7-trihydroxy-4′,6-диметоксизофлавон является одним из вида флавоноида (более конкретно, изофлавон), который считается в целом безопасным и используется в травяных фармацевтических препаратов; однако, он по-прежнему имеет эстроген связанных с проблемами29 и может вызвать острую токсичность, вероятно, через окислительный фосфорилирование разъединение30. Далее, 1,4-бензенедиол, называемый гидрохинон, является фенольным соединением, которое может вызвать неспецифический и цитотоксический иммунный ответ у рыбы31. Наконец, 4-гексилфенол, как известно, проявляют достаточную положительную эстрогенную активность, чтобы быть классифицированы как ED32. Хорошо изучено, что основной причиной острой токсичности гидрохинона является сокращение окисления (редокс) велоспорта. Гидрохинон окисляется до бензохинона и сводится к полу-хинон или гидрохинон неоднократно, с истощением кофакторов и генерации реактивных видов кислорода33. Два других химических вещества могут потребовать более глубоких исследований, чтобы выявить их механизмы действия в острой экотоксичности с использованием молекулярных подходов стыковки, таких как те, которые используются Panche et al.34, которые не могут быть покрыты инструментарием ЗСАР.
EDs вмешиваться в эндокринную систему в основном через физико-химических взаимодействий со стероидными рецепторами, такими как эстрогена и андрогенных рецепторов, которые представляют значительный интерес в исследованиях моделирования ЗСАР35. Учитывая это, инструментарий ЗСАР является надежным с точки зрения легкой и быстрой классификации связывающей ER сходства для набора химических веществ, основанных только на 2D дескрипторах молекулярных структур. Когда эта система ER профайлер был применен к нашему списку EDs, не было найдено четкой корреляции между ER связывания сродство и гидрофобность(Дополнительный рисунок S2). Этот результат может быть объяснен тем, что образование стероидно-рецепторного комплекса не является прямым следствием гидрофобного вклада связи, но должно сопровождаться конформационным изменением в структуре рецепторов активного участка36. Связывание рецепторов также может быть связано с водородной связью и укладкой.
Кроме того, положение каждой химической группы на молекуле может повлиять на связывание рецепторов, даже если гидрофобность и количество водородных получателей-доноров остаются неизменными. Во-вторых, ER профайлер производства противоположных тенденций между прогнозируемым и экспериментальных LC50 средних уровней с увеличением ER связывания сродство(рисунок 5). Это может быть потому, что летальность родителей в острой токсичности тест не из-за ER связывания, а наркоз в большинстве случаев, или Redox езда на велосипеде в случае гидрохинона. Например, для определения прогностических ограничений текущей версии инструментария САР требуется более обширный анализ, включая хроническую токсичность.
Это предварительное исследование может также иметь последствия для общественного здравоохранения, потому что стероиды (андрогены, эстрогены, прогестиныи кортикоиды) и их рецепторы обладают аналогичными или даже идентичными макромолекулярными структурами по позвоночных 5. Эти типы аналогичных эндокринных систем сигнализации могут работать сиспользованием общего механизма в ключевых событиях EDs 5. Тем не менее, для освещения этого обширного и сложного аспекта требуются дополнительные и дополнительные методологии , например, путем выполнения вычислительного моделирования поглощения, распределения, метаболизма и выделения (ADME) и/или неблагоприятного исхода путь (AOP)38. Кроме того, поскольку большинство научных и общественных проблем, поднятых по поводу неблагоприятного воздействия ЕД, связаны с их хронической токсичностью, улучшение баз данных и алгоритмов в инструментарии САР и производство надежной долгосрочной экотоксикологии прогнозы для EDs оба необходимы.
В этом документе демонстрируется применение инструментария SAR для сравнения экотоксических значений LC50 для рыбы сзначениями ED10K. На протяжении всего протокола, это приводит к слабым отношениям между двумя параметрами, как это имеет были выявлены в предыдущих исследованиях (например, Ким и др.39), что журнал10Kow не является хорошим прямым предиктором водных LC50. Несмотря на это ограничение, этот протокол предоставляет общий обзор или “виньетка”, чтобы описать, как использовать панель мониторинга для данной цели, так как это действительное приложение для использования sar Toolbox для расследования корреляций между LC50 (или ER привязки сродство) и журнал10Kow, или в качестве инструмента для быстрого острого скрининга экотоксичности. Тем не менее, следует отметить, что (1) освещая связь между связыванием рецепторов эстрогена и хронической токсичностью, а не острой токсичностью (летальностью), более актуальна, так что более четкие корреляции могут быть найдены, и (2) рецептор андрогена, вместе с эстрогеном, также играет важную роль в репродуктивной токсичности. Таким образом, для будущей версии инструментария ЗСАР необходимо улучшить функции прогнозирования в свете этих двух точек.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование было поддержано Грантом Национального научного совета и технологий (NST) южнокорейского правительства (MSIP) (No. CAP-17-01-KIST Europe) и проект 11911.
Materials
| Adobe Acrobat Reader DC | Adobe Systems Software Ireland Limited | NA | Required to view prediction and category report |
| Computer | System: Microsoft Corporation | NA | Recommended system properties: (i) system type: 64 bit, Microsoft Windows 7 or newer, (ii) processor: I5 at 2.4 GHz or faster processor or equivalent AMD CPU, (iii) Installed memory (RAM): 6 GB of RAM, (iv) Hard Disk Drive (HDD): 20 GB free hard drive space |
| Microsoft Editor | Microsoft Corporation | NA | Required to upload a substance list of CAS numbers (batch mode) to the OECD QSAR Toolbox as .txt file (text file) |
| Microsoft Excel 2016 | Microsoft Corporation | NA | Required to export data from OECD QSAR Toolbox as .cvs, .xls or .xlsx files |
| OECD QSAR Toolbox version 4.0 or newer | Organisation for Economic Co-operation and Development |
NA | Required to run OECD QSAR Toolbox Automated Workflows; free download: https://qsartoolbox.org/download/ |
| OriginPro 9 | OriginLab Corporation | NA | Optional program for data analysis; similar tools possible |
References
- Najarian, K., Najarian, S., Gharibzadeh, S., Eichelberger, C. N. . Systems Biology and Bioinformatics: A Computational Approach. , (2009).
- Fujita, T., Iwasa, J., Hansch, C. A new substituent constant, π, derived from partition coefficient. Journal of the American Chemical Society. 86, 5175-5180 (1964).
- Roy, K., Kar, S., Das, R. N. . Understanding the Basics of QSAR for Applications in Pharmaceutical Sciences and Risk Assessment. , (2015).
- Raies, A. B., Bajic, V. B. In silico toxicology: computational methods for the prediction of chemical toxicity. WIREs Computational Molecular Science. 6, 147-172 (2016).
- Hayes, T. B. Welcome to the revolution: integrative biology and assessing the impact of endocrine disruptors on environmental and public health. Integrative Compuational Biology. 45, 321-329 (2005).
- Schug, T. T., et al. Minireview: endocrine disruptors: past lessons and future directions. Molecular Endocrinology. 30, 833-847 (2016).
- Devillers, J., Marchand-Geneste, N., Carpy, A., Porcher, J. M. SAR and QSAR modeling of endocrine disruptors. SAR QSAR Environmental Research. 17, 393-412 (2006).
- Dimitrov, S. D., et al. QSAR Toolbox – workflow and major functionalities. SAR QSAR Environmental Research. 27, 203-219 (2016).
- Yordanova, D., et al. Automated and standardized workflows in the OECD QSAR Toolbox. Computational Toxicology. 10, 89-104 (2019).
- Mombelli, E., Devillers, J. Evaluation of the OECD (Q)SAR Application Toolbox and Toxtree for predicting and profiling the carcinogenic potential of chemicals. SAR QSAR Environmental Research. 21, 731-752 (2010).
- Devillers, J., Mombelli, E., Samsera, R. Structural alerts for estimating the carcinogenicity of pesticides and biocides. SAR QSAR Environmental Research. 22, 89-106 (2011).
- Li, C., et al. Identifying unknown by-products in drinking water using comprehensive two-dimensional gas chromatography-quadrupole mass spectrometry and in silico toxicity assessment. Chemosphere. 163, 535-543 (2016).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 1. Aromatic amines. SAR QSAR Environmental Research. 21, 753-769 (2010).
- Devillers, J., Mombelli, E. Evaluation of the OECD QSAR Application Toolbox and Toxtree for estimating the mutagenicity of chemicals. Part 2. α-β unsaturated aliphatic aldehydes. SAR QSAR Environmental Research. 21, 771-783 (2010).
- Kulkarni, S. A., Barton-Maclaren, T. S. Performance of (Q)SAR models for predicting Ames mutagenicity of aryl azo and benzidine based compounds. Journal of Environmental Science and Health Part C Environmental Carcinogenesis & Ecotoxicology Reviews. 32, 46-82 (2014).
- Craig, E. A., Wang, N. C., Zhao, Q. J. Using quantitative structure-activity relationship modeling to quantitatively predict the developmental toxicity of halogenated azole compounds. Journal of Applied Toxicology. 34, 787-794 (2014).
- Tebby, C., Mombelli, E., Pandard, P., Péry, A. R. Exploring an ecotoxicity database with the OECD (Q)SAR Toolbox and DRAGON descriptors in order to prioritise testing on algae, daphnids, and fish. Science of the Total Environment. 409, 3334-3343 (2011).
- Mombelli, E. Evaluation of the OECD (Q)SAR Application Toolbox for the profiling of estrogen receptor binding affinities. SAR QSAR Environmental Research. 23, 37-57 (2012).
- Verhaar, H. J. M., van Leeuwen, C. J., Hermens, J. L. M. Classifying environmental pollutants. 1: structure-activity relationships for prediction of aquatic toxicology. Chemosphere. 25, 471-491 (1992).
- Enoch, S. J., Hewitt, M., Cronin, M. T. D., Azam, S., Madden, J. C. Classification of chemicals according to mechanism of aquatic toxicity: an evaluation of the implementation of the Verhaar scheme in Toxtree. Chemosphere. 73, 243-248 (2008).
- Burden, N., Maynard, S. K., Weltje, L., Wheeler, J. R. The utility of QSARs in predicting acute fish toxicity of pesticide metabolites: a retrospective validation approach. Regulatory Toxicology and Pharmacology. 80, 241-246 (2016).
- Nendza, M., et al. Screening for potential endocrine disruptors in fish: evidence from structural alerts and in vitro and in vivo toxicological assays. Environmental Sciences Europe. 28, 26 (2016).
- Roncaglioni, A., Piclin, N., Pintore, M., Benfenati, E. Binary classification models for endocrine disrupter effects mediated through the estrogen receptor. SAR QSAR Environmental Research. 19, 697-733 (2008).
- Sosnovcová, J., Rucki, M., Bendová, H. Estrogen receptor binding affinity of food contact material components estimated by QSAR. Central European Journal of Public Health. 24, 241-244 (2016).
- Walker, J. D., Dearden, J. C., Schultz, T. W., Jaworska, J., Comber, M. H. I., Walker, J. D. QSARs for New Practitioners. QSARs for Pollution Prevention, Toxicity Screening, Risk Assessment, and Web Applications. , (2003).
- Sánchez-Bayo, F. From simple toxicological models to prediction of toxic effects in time). Ecotoxicology. 18, 343-354 (2009).
- Sjöström, M., Lindgren, &. #. 1. 9. 7. ;., Uppgård, L. L., Chen, F., Schüürmann, G. Joint Multivariate Quantitative Structure-Property and Structure-Activity Relationships for a Series of Technical Nonionic Surfactants. Quantitative Structure-Activity Relationships in Environmental Sciences-VII. , (1997).
- Ding, F., Guo, J., Song, W., Hu, W., Li, Z. Comparative quantitative structure-activity relationship (QSAR) study on acute toxicity of triazole fungicides to zebrafish. Chemistry Ecology. 27, 359-368 (2011).
- Galati, G., O’Brien, P. J. Potential toxicity of flavonoids and other dietary phenolics: significance for their chemopreventive and anticancer properties. Free Radical Biology in Medicine. 37, 287-303 (2004).
- Russom, C. L., Bradbury, S. P., Broderius, S. J. Predicting modes of action from chemical structure: acute toxicity in the fathead minnow (Pimephales promelas). Environmental Toxicology and Chemistry. 16, 948-967 (1997).
- Taysse, L., Troutaud, D., Khan, N. A., Deschaux, P. Structure-activity relationship of phenolic compounds (phenol, pyrocatechol and hydroquinone) on natural lymphocytotoxicity of carp (Cyprinus carpio). Toxicology. 98, 207-214 (1995).
- Nishihara, T., et al. Estrogenic activities of 517 chemicals by yeast two-hybrid assay. Journal of Health Science. 46, 282-298 (2000).
- Bolton, J. L., Trush, M. A., Penning, T. M., Dryhurst, G., Monks, T. J. Role of quinones in toxicology. Chemical Research in Toxicology. 13, 135-160 (2000).
- Panche, A. N., Diwan, A. D., Chandra, S. R. Flavonoids: an overview. Journal of Nutritional Science. 5, e47 (2016).
- Li, J., Gramatica, P. QSAR classification of estrogen receptor binders and pre-screening of potential pleiotropic EDCs. SAR QSAR Environmental Research. 21, 657-669 (2010).
- Bohl, M. . Molecular Structure and Biological Activity of Steroids. , (2017).
- Kaminuma, T., Takai-Igarashi, T., Nakano, T., Nakata, K. Modeling of signaling pathways for endocrine disruptors. BioSystems. 55, 23-31 (2000).
- Lillicrap, A., et al. Alternative approaches to vertebrate ecotoxicity tests in the 21st century: a review of developments over the last 2 decades and current status. Environmental Toxicology and Chemistry. 35, 2637-2646 (2016).
- Kim, J. W., et al. Acute toxicity of pharmaceutical and personal care products on freshwater crustacean (Thamnocephalus platyurus) and fish (Oryzias latipes). Journal of Toxicological Sciences. 34, 227-232 (2009).

