一定の流れの原発性ヒト内皮細胞の肺炎球菌感染
Summary
本研究では、定義された流路条件におけるせん断応力下で分化したヒト一次内皮細胞の表面上で産生されるフォン・ヴィレブランド因子ストリングに対する肺炎球菌の視認性の顕微鏡的モニタリングについて述べている。このプロトコルは、微分免疫染色手順を適用することにより、特定の細胞構造の詳細な可視化および細菌の定量に拡張することができる。
Abstract
肺炎レンサ球菌と内皮細胞の表面との相互作用は、フォン・ヴィレブランド因子(VWF)などのメカノ感受性タンパク質を介して血流中に媒介される。この糖タンパク質は、せん断応力に応答して分子立体構造を変化させ、それによって宿主リガンド相互作用の広いスペクトルの結合部位を露出させる。一般に、定義されたせん断流の下で一次内皮細胞の培養は、血管の内層の生理学に似た安定で密接に連結された内皮層の形成と特異的な細胞分化を促進することが知られている.したがって、メカノ感受性タンパク質を含む細菌病原体と宿主血管系との相互作用の機能解析には、界面に影響を及ぼすことが知られている生理学的流動力をシミュレートできるポンプシステムの確立が必要である。血管細胞。
本研究で用いられるマイクロ流体デバイスは、定義された流量で流体の連続的かつパルスレスな再循環を可能にする。コンピュータ制御の空気圧ポンプシステムは、連続的、単方向、制御された媒体流れを生成することにより、内皮セル表面に定義されたせん断応力を適用します。細胞および細菌結合の形態学的変化は顕微鏡的視覚化のために設計されている特別なチャネルスライドを使用して流れの顕微鏡的に監視され、定量することができる。一般に、免疫標識と顕微鏡分析の前にサンプル固定を必要とする静的細胞培養感染とは対照的に、マイクロ流体スライドは、タンパク質、細菌、および細胞成分の蛍光ベースの検出の両方を可能にするサンプル固定後;連続免疫蛍光染色;リアルタイムで直接蛍光ベースの検出を行います。蛍光細菌および特異的蛍光標識抗体と組み合わせることで、この感染手順は、血管プロセスに関連する科学的応用の巨大なスペクトルのための効率的な多成分可視化システムを提供します。
Introduction
肺炎球菌感染症の病因は、プラスミノーゲンおよびVWF1、2などのヒト止血症の細胞外マトリックス化合物および成分の多様性との多面的相互作用によって特徴付けられます。3,4,5,6,7,8.マルチドメイン糖タンパク質VWFは、血管血栓形成9の部位における血栓細胞リクルートおよびフィブリンの組み込みを媒食することにより、バランスのとれた止血症の主要な調節体として機能する。出血制御および創傷治癒のための機能的、活性VWFの重要性は、フォン・ヴィレブランド病、一般的な遺伝性出血性疾患10によって実証される。
球状VWFは、最大14.0μg/mL11、10の濃度でヒト血液系を循環する。血管損傷に対して、内皮ワイベルパレードボディ(WBP)によるVWFの局所放出は著しく増加する11、12である。これまでの研究では、肺炎球菌がヒト内皮細胞に付着し、細孔形成毒素肺炎の産生が発光VWF分泌13を有意に刺激することが示されている。血流の流体力学的力は、メカノレスポンシブVWFドメインの構造開口部を誘導する。10 dyn/cmの流量で、VWFは、サブ子宮皮10、12に取り付けられたままの長さ数百マイクロメートルまでの長いタンパク質ストリングに多量化する。
肺炎球菌と内皮表面との相互作用においてせん断応力下で発生する多量体化VWF弦の機能を理解するために、マイクロ流体ベースの細胞培養感染アプローチが確立された。ソフトウェア制御空気圧ポンプシステムを備えたマイクロ流体装置を使用した。これにより、定義された流量を有する細胞培養培地の連続的な単方向再循環が可能にされた。それによって、システムは、特殊なチャネルスライド内に取り付けられたままの内皮細胞の表面に定義されたせん断応力を適用した。このアプローチにより、定義された一定の流れ条件下で分化した内皮細胞にVWF弦が生成される、ヒト血管系の血流中のせん断力のシミュレーションが可能となった。この目的のために、内皮細胞を特定のチャネルスライドで培養した(材料表参照)。マイクロ流体ポンプシステムは、コンフルエント内皮細胞層上の拡張VWF弦の形成に必要な高度に定義され、制御されたせん断応力状況を提供しました。ヒスタミン補充によりヒト臍静脈内皮細胞(HUVEC)を収縮的に増殖させたヒト臍静脈内皮細胞のVWF分泌の刺激後、弦形成は10dyn/cm2のせん断応力(・△)を加えることによって誘導された。せん断応力は、細胞層に作用する力として定義されます。コーニッシュetに従って計算される。al.14方程式 1:
ここで、dyn/cm2のせん断応力、ε = 粘度(dyn∙s)/cm2、h= チャネル高さの半分、w = チャネル幅の半分、および Φ = 流量 (mL/min) です。
方程式 1 の結果は、使用するさまざまなスライドの高さと幅によって異なります (「材料表」を参照)。本研究では、0.4μmのルアーチャンネルスライドを用い、チャンバースライド係数131.6を用いた(式2参照)。
37°Cでの媒体の粘度は0.0072 dyn∙s/cm²であり、10dyn/cm²のせん断応力を使用した。その結果、流量は10.5mL/分になります(式3を参照)。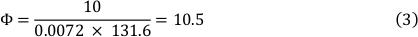
ここで、宿主血管系における細菌感染機構の調査及び可視化のための単方向層流システムを用いた微小流体細胞培養手順の適応及び進歩について詳細に説明する。内皮層上のVWF弦の生成は、連続的で安定したせん断応力15を適用することができる他のポンプシステムを使用することによって刺激することができる。
VWF弦形成の流れと刺激に合流する一次内皮細胞の培養後、赤色蛍光タンパク質(RFP)16を発現する肺炎球菌16を、一定の顕微鏡制御下で内皮細胞層に添加した。内皮細胞表面のVWF弦への細菌の付着は、VWF特異的蛍光標識抗体を用いて顕微鏡的に可視化し、最大3時間リアルタイムで監視した。このアプローチにより、血管内皮への細菌付着を促進する接着補因子としてのVWFの役割が8と判定された。
タンパク質分泌と立体構造変化の顕微鏡的可視化に加えて、この方法は、細菌感染プロセスの単一ステップをリアルタイムで監視し、異なる時点での付着菌の量を定量化するために使用することができる感染。特定のソフトウェア制御ポンプシステムはまた、内皮細胞を定義された一定の流れ条件で数日間培養する可能性を提供し、定義されたパルス媒体フローインキュベーションを可能にする。さらに、このメソッドは、異なるセルタイプを使用して適用することができます。染色プロトコルを適応させることは、真核細胞に内部化された細菌の検出および可視化も可能にする。
この原稿では、病態生理学的プロセスの効率的かつ汎用的な特性評価のための定義された、信頼性が高く、再現可能なアプローチとして使用できるこの高度な実験プロトコルについて説明します。
Protocol
Representative Results
Discussion
VWFのようなメカノ感受性宿主タンパク質との細菌相互作用のシミュレーションは、定義された、単方向、および液体の連続的な流れの生成を可能にする含水性細胞培養システムを必要とし、それによって信頼できるせん断応力を発生させる.いくつかのマイクロ流体ポンプシステムがすでに説明されている。Bergmannらからの包括的なレビューは、異なる2次元および三次元細胞培養…
Disclosures
The authors have nothing to disclose.
Acknowledgements
このプロジェクトはDFG(BE 4570/4-1)からS.Bに資金提供されました。
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

