Пневмококк инфекция первичных эндотелиальных клеток человека в постоянном потоке
Summary
Это исследование описывает микроскопический мониторинг пневмококка соблюдения фон Willebrand фактор строки, производимые на поверхности дифференцированных человеческих первичных эндотелиальных клеток под сдвига стресс в определенных условиях потока. Этот протокол может быть расширен до детальной визуализации конкретных клеточных структур и количественной оценки бактерий путем применения дифференциальных иммуностоинных процедур.
Abstract
Взаимодействие стрептококковой пневмонии с поверхностью эндотелиальных клеток опосредовано в кровотоке через механочувствительные белки, такие как фактор фон Виллебранд (VWF). Этот гликопротеин изменяет свою молекулярную конформацию в ответ на стресс сдвига, тем самым подвергая обязательные участки для широкого спектра взаимодействий хозяина-лигада. В целом, культивирование первичных эндотелиальных клеток под определенным потоком сдвига, как известно, способствует специфической клеточной дифференциации и образованию стабильного и тесно связанного эндотелиального слоя, напоминающего физиологию внутренней слизистой оболочки кровеносных сосудов . Таким образом, функциональный анализ взаимодействий между бактериальными патогенами и сосудами-хозяевами с использованием механочувствительных белков требует создания насосных систем, которые могут имитировать физиологические силы потока, которые, как известно, влияют на поверхность сосудистых клеток.
Микрофлюидическое устройство, используемое в данном исследовании, обеспечивает непрерывную и бесприсрадаемую рециркуляцию жидкостей с определенной скоростью потока. Компьютерная система насоса воздушного давления применяет определенный стресс сдвига на эндотелиальных поверхностях клеток, генерируя непрерывный, однонаправленный и контролируемый средний поток. Морфологические изменения клеток и бактериальной привязанности могут микроскопически контролироваться и количественно в потоке с помощью специальных слайдов канала, которые предназначены для микроскопической визуализации. В отличие от инфекции культуры статических клеток, которая в целом требует фиксации образца до иммунной маркировки и микроскопических анализов, микрофлюидные слайды позволяют как флуоресценции на основе обнаружения белков, бактерий и клеточных компонентов после фиксации образца; серийное окрашивание иммунофлуоресценции; и прямое обнаружение на основе флуоресценции в режиме реального времени. В сочетании с флуоресцентными бактериями и специфическими флуоресценцией помечены антитела, эта процедура инфекции обеспечивает эффективную систему визуализации нескольких компонентов для огромного спектра научных приложений, связанных с сосудистыми процессами.
Introduction
Патогенез пневмококковых инфекций характеризуется многогранным взаимодействием с разнообразием внеклеточных матричных соединений и компонентов гемостаза человека, таких как плазминоген и VWF1, 3,4,5,6,7,8. Мультидоменглиновая гликопротеина VWF служит ключевым регулятором сбалансированного гемостаза путем посредничества в наборе тромбоцитов и инкорпорации фибрина в месте образования сосудистого тромба9. Важность функционального, активного VWF для контроля кровотечения и заживления ран демонстрируетболезнь фон Виллебранд, распространенное наследственное кровотечение10.
Глобулярный VWF циркулирует в крови человека в концентрации до 14,0 мкг/мл11,10. В ответ на сосудистые травмы, локальный выпуск VWF эндотелиальных тел Вейбель Паладе (WBP) заметно увеличилось11,12. Предыдущие исследования показывают, что пневмококк приверженность человека эндотелиальных клеток и его производство порообразующего токсина пневмолиза значительно стимулирует светлую секрецию VWF13. Гидродинамические силы кровотока вызывают структурное открытие механоответственных доменов VWF. При норме потока 10 dyn/cm2 VWF мультимеризирует до длинных белковых струн длиной до нескольких сотен микрометров, которые остаются прикрепленными к субэндотелию10,12.
Чтобы понять функцию мультимеризированных струн VWF, генерируемых при стрессе сдвига при взаимодействии пневмококка с эндотелиальной поверхностью, был создан микрофлюидный подход к клеточной культуре. Использовалось микрофлюидное устройство с программно-управляемой системой насоса воздушного давления. Это позволило непрерывно, однонаправленное рециркуляции среды клеточной культуры с определенной скоростью потока. Таким образом, система применила определенный стресс сдвига на поверхности эндотелиальных клеток, которые оставались прикрепленными внутри специализированных слайдов канала. Этот подход позволил смоделировать силу сдвига в крови сосудистой системы человека, в которой строки VWF генерируются на дифференцированных эндотелиальных клетках при определенных постоянных условиях потока. Для этого эндотелиальные клетки культивировались в конкретных слайдах канала (см. Таблица материалов),которые были адаптированы для микроскопических анализов во время потока. Микрофлюидная насосная система обеспечивала высокоопределенную и контролируемую стрессовую ситуацию, необходимую для формирования расширенных струн VWF на сливочного эндотелиального клеточного слоя. После стимуляции VWF-секретации конфлентически выращенных человеческих пупочных клеток вены (HUVEC) гистаминовой добавкой, образование строки было вызвано применением сдвига стресс (я) 10 dyn/cm2. Стресс сдвига определяется как сила, действующая на клеточном слое. Он рассчитывается примерно в соответствии с Корниш и т.д. al.14 с уравнением 1:
В тех случаях, когда стресс сдвига в dyn/cm2, вязкость в (dyn)/cm2, h q half of высота канала, w й половина ширины канала, и й s flowrate в mL/min.
Результат уравнения 1 зависит от различных высот и ширины различных используемых слайдов (см. Таблица материалов). В этом исследовании был использован слайд канала Luer в 0,4 мкм, в результате чего коэффициент камерного слайда составил 131,6 (см. формулу 2).
Вискозность среды при 37 градусах Цельсия составляет 0,0072 дина/см2 и использовался стресс сдвига 10 dyn/cm2. Это привело к скорости потока 10,5 мл/мин (см. формулу 3).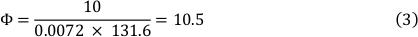
Здесь подробно описана адаптация и продвижение процедуры культивирования микрофлюидных клеток с использованием однонаправленной системы ламинара для исследования и визуализации механизмов бактериальной инфекции в сосудистой системе хозяина. Поколение строк VWF на эндотелиальных слоях также может быть стимулировано с помощью других насосных систем, которые способны применять непрерывный и устойчивый стресс сдвига15.
После культивирования первичных эндотелиальных клеток для слияния в потоке и стимуляции формирования струнных VWF, пневмококки, выражающие красный флуоресценционный белок (RFP)16 были добавлены в эндотелиальный клеточный слой под постоянным микроскопическим контролем. Привязка бактерий к струнам VWF на поверхности эндотелиальных клеток была микроскопически визуализирована и контролироваться в течение трех часов в режиме реального времени с помощью флуоресцентных антител, маркированных VWF. При таком подходе, роль VWF как кофактор адгезии содействия бактериальной привязанности к сосудистому эндотелия была определена8.
В дополнение к микроскопической визуализации секреции белка и конформационных изменений, этот метод может быть использован для мониторинга отдельных шагов процессов бактериальной инфекции в режиме реального времени и количественное количество прикрепленных бактерий в разных точках времени Инфекции. Специфическая система насоса, управляемая программным обеспечением, также обеспечивает возможность культуры эндотелиальных ячеек в определенных условиях постоянного потока на срок до нескольких дней и обеспечивает определенную инкубацию импульсного среднего потока. Кроме того, этот метод может быть применен с использованием различных типов клеток. Адаптация протокола окрашивания также позволяет обнаруживать и визуализировать бактерии, интернализированные в эукариотические клетки.
Данная рукопись описывает этот передовой экспериментальный протокол, который может быть использован в качестве определенного, надежного и воспроизводимого подхода для эффективной и универсальной характеристики патофизиологических процессов.
Protocol
Representative Results
Discussion
Моделирование бактериального взаимодействия с механочувствительными белками-хостами, такими как VWF, требует сложной системы культуры клеток, которая позволяет генерировать определенный, однонаправленный и непрерывный поток жидкостей, тем самым создавая надежный стресс сдвига . Уже ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Проект финансировался DFG (BE 4570/4-1) в S.B.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

