Sürekli Akışta Birincil İnsan Endotel Hücrelerinin Pnömokok Enfeksiyonu
Summary
Bu çalışmada, tanımlanmış akış koşullarında kesme stresi altında farklılaştırılmış insan primer endotel hücrelerinin yüzeyinde üretilen pnömokok komponent dizelerine bağlıpnozyağının mikroskobik takibi açıklanmaktadır. Bu protokol, diferansiyel immünboyama prosedürleri uygulanarak belirli hücre yapılarının ayrıntılı görselleştirilmesi ve bakterilerin sayısallaştırılması için genişletilebilir.
Abstract
Streptococcus pneumoniae’nin endotel hücrelerinin yüzeyi ile etkileşimi Von Willebrand Factor (VWF) gibi mekanosiz proteinler aracılığıyla kan akışında aracılık edilir. Bu glikoprotein, kesme stresine yanıt olarak moleküler konformasyonunu değiştirir ve böylece geniş bir konak-ligand etkileşimi spektrumu için bağlayıcı bölgeleri açığa çıkarır. Genel olarak, tanımlanmış bir kesme akışı altında primer endotel hücrelerinin kültürlenme belirli hücresel farklılaşma ve bir kan damarının iç astar fizyolojisi andıran istikrarlı ve sıkıca bağlı endotel tabakasıoluşumunu teşvik bilinmektedir . Bu nedenle, bakteriyel patojenler ve mekanosensit proteinleri içeren konak vaskülatür arasındaki etkileşimlerin fonksiyonel analizi, yüzeyini etkilediği bilinen fizyolojik akış kuvvetlerini simüle eden pompa sistemlerinin kurulmasını gerektirir. vasküler hücreler.
Bu çalışmada kullanılan mikroakışkan cihaz, tanımlanmış akış hızına sahip sıvıların sürekli ve darbesiz dolaşımını sağlar. Bilgisayar kontrollü hava basıncı pompa sistemi sürekli, tek yönlü ve kontrollü bir ortam akışı oluşturarak endotel hücre yüzeylerine tanımlanmış bir kesme gerilimi uygular. Hücrelerin morfolojik değişimleri ve bakteriyel eki mikroskobik olarak izlenebilir ve mikroskobik görüntüleme için tasarlanmış özel kanal slaytları kullanılarak akışta ölçülebilir. Genel olarak bağışıklık etiketleme ve mikroskobik analizlerden önce örnek fiksasyon gerektiren statik hücre kültürü enfeksiyonunun aksine, mikroakışkan slaytlar hem proteinlerin, bakterilerin hem de hücresel bileşenlerin floresan tabanlı saptanmasını sağlar. örnek fiksasyondan sonra; seri immünofloresan boyama; ve gerçek zamanlı olarak doğrudan floresan tabanlı algılama. Floresan bakteriler ve spesifik floresan etiketli antikorlar ile birlikte, bu enfeksiyon prosedürü vasküler süreçler ile ilgili bilimsel uygulamaların büyük bir spektrum için verimli bir çoklu bileşenli görselleştirme sistemi sağlar.
Introduction
Pnömokok enfeksiyonlarının patogenezi, plazminojen ve VWF1gibi ekstrasellüler matriks bileşikleri ve insan hemostaz bileşenlerinin çeşitliliği ile çok yönlü bir etkileşim ile karakterizedir,2, 3,4,5,6,7,8. Multidomain glikoprotein VWF vasküler trombüs oluşumu yerinde trombosit işe ve fibrin incorporation aracılık ederek dengeli bir hemostaz anahtar düzenleyici olarak hizmet vermektedir9. Kanama kontrolü ve yara iyileşmesi için fonksiyonel, aktif VWF’nin önemi von Willebrand hastalığı ile gösterilmiştir, yaygın bir kalıtsal kanama bozukluğu10.
Globüler VWF kadar bir konsantrasyonda insan kan sisteminde dolaşır 14.0 μg/mL11,10. Vasküler yaralanmaya yanıt olarak, endotel Weibel Palade Organları (WBP) tarafından VWF lokal sürümü belirgin artmıştır11,12. Önceki çalışmalar, pnömokok insan endotel hücrelerine bağlılık ve gözenek oluşturan toksin pnömolysin üretimi önemli ölçüde luminal VWF salgılanmasını uyarır göstermektedir13. Kan akışının hidrodinamik kuvvetleri mechanoresponsive VWF etki alanlarının yapısal bir açılış neden. 10 dyn/cm2 akış hızlarında VWF, subendothelium10,12’yebağlı kalan birkaç yüz mikrometreye kadar uzun protein dizelerine multimerize eder.
Pnömokokların endotel yüzeyi ile etkileşiminde kesme stresi altında oluşturulan çok merize VWF dizelerin işlevini anlamak için mikroakışkan tabanlı hücre kültürü enfeksiyonu yaklaşımı oluşturulmuştur. Yazılım kontrollü hava basıncı pompa sistemine sahip mikroakışkan bir cihaz kullanıldı. Bu, hücre kültürü ortamının tanımlı akış hızına sahip sürekli, tek yönlü bir sirkülasyonunu sağladı. Bu nedenle, sistem endotel hücrelerinin yüzeyinde tanımlanmış bir kesme stresi uyguladı, hangi özel kanal slaytlar içinde bağlı kaldı. Bu yaklaşım, VWF dizelerinin tanımlanmış sabit akış koşullarında farklılaştırılmış endotel hücrelerinde üretildiği insan vasküler sisteminin kan dolaşımı içindeki kesme kuvvetinin simülasyonuna olanak sağladı. Bu amaçla, endotel hücreleri akış sırasında mikroskobik analizler için uyarlanmış belirli kanal slaytlarında (bkz. Malzemeler Tablosu)yetiştirilmiştir. Mikroakışkan pompa sistemi, yoğun endotel hücre tabakasıüzerinde genişletilmiş VWF dizeleri oluşumu için gerekli olan yüksek tanımlı ve kontrollü kesme gerilimi durumunu sağlamıştır. Konfluently yetiştirilen insan göbek ven endotel hücrelerinin VWF-salgılanması uyarılmasından sonra (HUVEC) histamin takviyesi tarafından, dize oluşumu bir kesme stresi uygulanarak indüklendi () 10 dyn / cm2. Kesme gerilimi hücre tabakasıüzerinde hareket eden kuvvet olarak tanımlanır. Yaklaşık cornish et göre hesaplanır. 1. denklem 1 ile al.14:
Dyn/cm2’dekikesme gerilimi , η = viskozite (dyn)/cm2, h =kanal yüksekliğinin yarısı, w = kanal genişliğinin yarısı ve Φ = mL/dk’da akış hızı.
Denklem 1’in sonucu, kullanılan farklı slaytların farklı yükseklik ve genişliklerine bağlıdır (bkz. Malzemeler Tablosu). Bu çalışmada 0.4 μm’lik bir Luer kanal slaytı kullanılmıştır ve bu slayt 131.6’dır (bkz. formül 2).
37 °C’de ortamın viskozitesi 0.0072 dyn/cm² olup, 10 dyn/cm² kesme gerilimi kullanılmıştır. Bu da 10,5 mL/dk akış hızıile sonuçlandı (bkz. formül 3).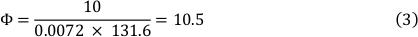
Burada, konak vaskülatürde bakteriyel enfeksiyon mekanizmalarının araştırılması ve görüntülenmesi için tek yönlü laminar akış sistemi kullanılarak mikroakışkan hücre culturing prosedürünün uyarlanma ve ilerlemesi ayrıntılı olarak açıklanmıştır. Endotel tabakalarında VWF dizeleri üretimi de sürekli ve sürekli kesme stresi uygulamak mümkün diğer pompa sistemleri kullanılarak uyarılabilir15.
VWF dize oluşumunun akışı ve uyarılmasında biraraya gelmek için birincil endotel hücrelerinin ekiminden sonra, kırmızı floresan proteini (RFP)16’yı sürekli mikroskobik kontrol altında endotel hücre tabakasına eklenmiştir. Endotel hücrelerinin yüzeyindeVWF dizeleri bakteri eki mikroskobik görselleştirilmiş ve VWF özgü floresan etiketli antikorlar kullanılarak gerçek zamanlı olarak üç saate kadar izlendi. Bu yaklaşımla VWF’nin vasküler endotel’e bakteriyel bağlanmasını teşvik eden bir yapışma kofaktör olarak rolü8olarak belirlenmiştir.
Protein salgısı nın mikroskobik görselizasyonu na ve konformasyonel değişikliklere ek olarak, bu yöntem bakteriyel enfeksiyon süreçlerinin tek adımlarını gerçek zamanlı olarak izlemek ve farklı zaman noktalarındaki bağlı bakteri miktarını ölçmek için kullanılabilir. Enfeksiyon. Özel yazılım kontrollü pompa sistemi de birkaç gün için tanımlanmış sabit akış koşullarında endotel hücreleri kültür imkanı sağlar ve tanımlanmış darbeli orta akış kuluçka sağlar. Ayrıca, bu yöntem farklı hücre türleri kullanılarak uygulanabilir. Boyama protokolünün uyarlanması aynı zamanda ökaryotik hücrelere dahil edilen bakterilerin algılanmasını ve görüntülenmesini sağlar.
Bu makale, patofizyolojik süreçlerin verimli ve çok yönlü bir karakterizasyonu için tanımlanmış, güvenilir ve tekrarlanabilir bir yaklaşım olarak kullanılabilecek bu gelişmiş deneysel protokolü açıklamaktadır.
Protocol
Representative Results
Discussion
VWF gibi mekanoduyaran konak proteinleri ile bakteri etkileşiminin simülasyonu, tanımlanmış, tek yönlü ve sürekli sıvı akışını sağlayan ve dolayısıyla güvenilir kesme gerilimi üreten, perfusable bir hücre kültür sistemi gerektirir . Birçok mikroakışkan pompa sistemleri zaten tarif edilmiştir. Bergmann ve ark. kapsamlı bir inceleme farklı iki ve üç boyutlu hücre kültürü modelleri17temel yönlerini özetler.
Mikroakışkan teknoloji çok …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Proje DFG (BE 4570/4-1) tarafından S.B.’ye finanse edilmiştir.
Materials
| 1 mL Luer-syringe | Fisher Scientific | 10303002 | with 1 mL volume for gelatin injection using the luer-connection of the slides |
| 2 mL Luer-syringe | Sarstedt | 9077136 | For pieptting/injecting fluids into the luer connections of the channel chamber slides |
| Accutase | eBioscience now thermo fisher | 00-4555-56 | protease mix used for gentle detachment of endothelial cells |
| AlexaFluor350-conjugated Phalloidin | Abcam | ab176751 | no concentration available from the manufacturer, stock solution is sufficient for 300 tets, company recommends to use 100 µl of a 1:1000 dilution, blue fluorescence (DAPI-filter settings) |
| AlexaFluor488-conjugated goat-derived anti-mouse antibody | Thermo Fisher Sientific | A11001 | stock concentration: 2 mg/mL for immunostaining of human VWF in microfluidic slide after PFA fixation, green fluorescence |
| AlexaFluor568-conjugated goat-derived anti-rabbit-antibody | Thermo Fisher Scientific | A-11011 | stock concentration: 2 mg/mL for immunostaining of pneumococci in microfluidic slide after pFA fixation, red fluorescence |
| Bacto Todd-Hewitt-Broth | Becton Dickinson GmbH | BD 249210 | complex bacterial culture medium |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153-25G | solubilized, for preparation of blocking buffer |
| Cell culture flasks with filter | TPP | 90026 | subcultivation of HUVEC in non-coated cell culture flasks of 25 cm2 surface |
| Centrifuge Allegra X-12R | Beckman Coulter Life Sciences | 392304 | spinning down of bacteria (volumes of > 2mL) |
| Centrifuge Allegra X-30 | Beckman Coulter Life Sciences | B06314 | spinning down of eukaryotic cells |
| Centrifuge Z 216 MK | Hermle | 305.00 V05 – Z 216 M | spinning down of bacteria (volumes of less than 2 mL) |
| Chloramphenicol | Carl Roth GmbH + Co. KG, Karlsruhe | 3886.2 | used in a concentration of 0.2 /mL for cultivation of pneumococci transformed with genetic construct carrying red fluorescent protein and chloramphenicol resistance cassette |
| Clamp for perfusion tubing | ibidi | 10821 | for holding the liquid in the tube bevor connecting the slide to the pump system |
| CO2-Incubator | Fisher Scientific | MIDI 40 | incubator size is perfectly adapted to teh size of the fluidic unit with connected channel slide and was used for flow cultivation at 37°C and 5% CO2 |
| CO2-Incubator | Sanyo | MCO-18 AIC | for incubation of bacteria and cells in a defined atmosphere at 5% CO2 and 37°C |
| Colombia blood agar plates | Becton Dickinson GmbH | PA-254005.06 | agar-based complex culture medium for S. pneumoniae supplemented with 7% sheep blood |
| Computer | Dell | Latitude 3440 | Comuter with pressure pump software |
| Confocal Laser Scanning Microscope (CLSM) | Leica | DMi8 | An inverse microscope with a stage covered by a heatable chamber and with a fluorescence unit equipped with fluorescence filter, Xenon-light source (SP8, DMi8) and DFC 365 FX Kamera (1392 x 1040, 1.4 Megapixel) |
| Di Potassium hydrogen phosphate (KH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | 3904.1 | used for PBS buffer |
| Drying material | Merck | 101969 | orange silica beads for drying used in a glass bottle with a tubing adaptor |
| ECGM supplement Mix | Promocell | C-39215 | supplement mix for ECGM -medium, required for precultivation of endothelial cells: 0.02 mL/mL Fetal calf serum, 0.004 mL/ mL endothelial cell growth supplement, 0.1 ng / mL epidermal growth factor, 1 ng / mL basic fibroblast growth factor, 90 µg / mL heparin, 1 µg / mL Hydrocortisone |
| ECGMS | Promocell | C-22010 | ECGM supplemented with 5 % [w/w] FCS and 1 mM MgSO4 to increase cell adhesion |
| Endothelial Cell growth medium (ECGM, ready to use) | Promocell | C-22010 | culture medium of HUVECs, already supplemented with all components of the supplement mix |
| Fetal Calf Serum (FCS) | biochrome now Merck | S 0415 | supplement for cell culture, used for infection analyses |
| FITC-conjugated goat anti-human VWF antibody | Abcam | ab8822 | stock concentration: 10 mg/mL, for immunodetection of globular and multimerized VWF in flow |
| Fluidic Unit | ibidi | 10903 | fluidic unit for flow cultivation |
| Gelatin (porcine) | Sigma Aldrich | G-1890-100g | for precoating of microslide channel surface |
| histamine dihydrochloride | Sigma Aldrich | H-7250-10MG | for induction of VWF secretion from endothelial Weibel Palade Bodies |
| Human Umbilical Vein Endothelial Cell (HUVEC) | Promocell | C-12203 Lot-Nr. 396Z042 | primary endothelial cells from pooled donor, stored crypcoserved in liquid nitrogen |
| Human VWF-specific antibody derived from mouse (monoclonal) | Santa Cruz | sc73268 | stock concentration: 200 µg/mL for immunostaining of VWF in microfluidic slide after PFA fixation |
| Injection Port | ibidi | 10820 | for injection of histamin or bacteria into the reservoir tubing during the flow circulation |
| Light microscope | Zeiss | Axiovert 35M | inverse light microscope for control of eukaryotic cell detachement and cell counting using a 40 x water objective allowing 400 x magnification |
| Luer-slides I0.4 (ibiTreat472microslides) | ibidi | 80176 | physically modified slides for fludic cultivation (μ–Slide I0.4Luer with a channel hight of 0.4 mm, a channel volume of 100 μl, a growth area of 2.5 cm and a coating area of 25.4 cm2) suitable for all kinds of flow assay, the physical treatment generates a hydrophilic and adhesive surface. |
| Magnesium sulfate (MgSO4, unhydrated) | Sigma Aldrich | M7506-500G | For preparation of ECGMS medium |
| Microfluidic Pump | ibidi | 10905 | air pressure pump |
| Neubauer cell counting chamber | Karl Hecht GmbH&Co KG | 40442002 | microscopic counting chamber for HUVECs |
| Paraformaldehyde 16% (PFA) | Electron Microscopy Sciences | 15710-S | for cross linking of samples |
| Perfusion Set | ibidi | 10964 | Perfusion Set Yellow/Green has a tubing diameter of 1.6 mm, a tube length of 50 cm, a total working volume of 13.6 mL, a dead tube volume of 2.8 mL and a reservoir size of 10 mL. combined with the µ-slide L0.4Luer, at 37°C and a viscosity of 0.0072 dyn x s/cm2 a flow rate range of 3.8mL/min up to 33.9 mL/min and shear stress between 3.5 dyn/cm2 and 31.2 dyn/cm2 can be reached. with 50 cm lenght for microfluidic |
| Phosphate-buffered saline (PBS) | the solution was prepared using the following chemicals: 0.2 g/L KCl, 1.44 g/L Na2HPO4, 0.24 g/L KH2PO4 , pH 7.4 | ||
| Plastic cuvettes | Sarstedt | 67,741 | (2 x optic) for OD measurement at 600 nm |
| Pneumococcus-specific antiserum | Pineda | raised in rabbit using heat-inactivated Streptococcus pneumoniae NCTC10319 and D39, IgG-purified using proteinA-sepharose column. | |
| Polystyrene or Styrofoam plate | this is a precaution step to avoid cold stress on the cells seeded in the channel slides. Any type of styrofoam such as packaging box-material can be used. The plate might by 0.5 cm thick and should have a size of 20 cm2. | ||
| Potassium chloride (KCl) | Carl Roth GmbH + Co. KG, Karlsruhe | 6781.1 | used for PBS buffer |
| Pump Control Software (PumpControl v1.5.4) | ibidi | v1.5.4 | Computer software for controlling the pressure pump, setting the flow conditions and start/end the flow |
| reaction tubes 1.5/ 2.0mL | Sarstedt | 72.706/ 72.695.500 | required for antibody dilutions |
| reaction tubes with 50 mL volume | Sarstedt | 6,25,48,004 | |
| RFP-expressing pneumococci | National Collection of Type Cultures, Public Health England | 10,319 | Streptococcus pneumoniae serotype 47 expressing RFP fused to ahistone-like protein integrated into the genome |
| serological pipets 5, 10 mL | Sarstedt | 86.1253.025/ 86.1254.025 | for pipeting larger volumes |
| Sodium Carbonate (Na2CO3, water free) | Sigma Aldrich | 451614-25G | for preparation of 100 mM Sodium Carbonate buffer |
| Sodium dihydrogen phosphate (NaH2PO4) | Carl Roth GmbH + Co. KG, Karlsruhe | P030.2 | used for PBS buffer |
| Spectral Photometer Libra S22 | Biochrom | 80-2115-20 | measurement of optical density (OD) of bacterial suspension at 600 nm |
| Sucrose | Sigma Aldrich | S0389-500G | for preparation of blocking buffer |
| Triton X-100 | Sigma Aldrich | T9284-500ML | Used in 0.1% end concentration diluted in dH20 for eukaryotic cell permeabilization after PFA fixation |
| Yeast extract | oxoid | LP0021 | bacteria are cultivated in THB supplement with 1% [w/w] yeast extract = complete bacterial cultivation medium THY |
References
- Weiser, J. N., Ferreira, D. M., Paton, J. C. Streptococcus pneumoniae: transmission, colonization and invasion. Nature Reviews Microbiology. 16 (6), 355-367 (2018).
- Bergmann, S., Hammerschmidt, S. Versatility of pneumococcal surface proteins. Microbiology. 152, 295-303 (2006).
- Bergmann, S., et al. Integrin-linked kinase is required for vitronectin-mediated internalization of Streptococcus pneumoniae by host cells. Journal of Cell Science. 122, 256-267 (2009).
- Bergmann, S., Schoenen, H., Hammerschmidt, S. The interaction between bacterial enolase and plasminogen promotes adherence of Streptococcus pneumoniae to epithelial and endothelial cells. International Journal of Medical Microbiology. 303, 452-462 (2013).
- Bergmann, S., Rohde, M., Chhatwal, G. S., Hammerschmidt, S. Alpha-enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface. Molecular Microbiology. 40, 1273-1287 (2001).
- Bergmann, S., et al. Identification of a novel plasmin(ogen)-binding motif in surface displayed alpha-enolase of Streptococcus pneumoniae. Molecular Microbiology. 49, 411-423 (2003).
- Bergmann, S., Rohde, M., Preissner, K. T., Hammerschmidt, S. The nine residue plasminogen-binding motif of the pneumococcal enolase is the major cofactor of plasmin-mediated degradation of extracellular matrix, dissolution of fibrin and transmigration. Thrombosis and Haemostasis. 94, 304-311 (2005).
- Jagau, H., et al. Von willebrand factor mediates pneumococcal aggregation and adhesion in flow. Frontiers in Microbiology. 10, 511 (2019).
- Tischer, A., et al. Enhanced local disorder in a clinically elusive von willebrand factor provokes high-affinity platelet clumping. Journal of Molecular Biology. 429, 2161-2177 (2017).
- Ruggeri, Z. M. Structure of von willebrand factor and its function in platelet adhesion and thrombus formation. Best Practice Research Clinical Haematology. 14, 257-279 (2001).
- Spiel, A. O., Gilbert, J. C., Jilma, B. Von willebrand factor in cardiovascular disease: Focus on acute coronary syndromes. Circulation. 117, 1449-1459 (2008).
- Springer, T. A. Von Willebrand factor, Jedi knight of the bloodstream. Blood. 124, 1412-1425 (2014).
- Luttge, M., et al. Streptococcus pneumoniae induces exocytosis of weibel-palade bodies in pulmonary endothelial cells. Cellular Microbiology. 14, 210-225 (2012).
- Cornish, R. J. Flow in a Pipe of Rectangular Cross-Section. Proceedings of the Royal Society A. 786, 691-700 (1928).
- Michels, A., Swystun, L. L., Mewburn, J., Albánez, S., Lillicrap, D. Investigating von Willebrand Factor Pathophysiology Using a Flow Chamber Model of von Willebrand Factor-platelet String Formation. Journal of Visualized Experiments. 14 (126), (2017).
- Kjos, M., et al. fluorescent Streptococcus pneumoniae for live-cell imaging of host-pathogen interactions. Journal of Bacteriology. 197, 807-818 (2015).
- Bergmann, S., Steinert, M. From single cells to engineered and explanted tissues: New perspectives in bacterial infection biology. International Reviews of Cell and Molecular Biology. 319, 1-44 (2015).
- Harrison, D. J., et al. Micromachining a miniaturized capillary electrophoresis-based chemical analysis system on a chip. Science. 261 (5123), 895-897 (1993).
- Magnusson, M. K., Mosher, D. F. Fibronectin: Structure, assembly, and cardiovascular implications. Arteriosclerosis, Thrombosis, and Vascular Biology. 18, 1363-1370 (1998).
- Zerlauth, G., Wolf, G. Plasma fibronectin as a marker for cancer and other diseases. The American Journal of Medicine. 77 (4), 685-689 (1984).
- Li, X. J., Valadez, A. V., Zuo, P., Nie, Z. 2012. Microfluidic 3D cell culture: potential application for tissue-based bioassays. Bioanalysis. 4, 1509-1525 (2019).
- Fiddes, L. K., et al. A circular cross-section PDMS microfluidics system for replication of cardiovascular flow conditions. Biomaterials. 31, 3459-3464 (2010).
- Schimek, K., et al. Integrating biological vasculature into a multi-organ-chip microsystem. Lab on a Chip. 13, 3588-3598 (2013).
- Pappelbaum, K. I., et al. Ultralarge von willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128, 50-59 (2013).
- Schneider, S. W., et al. Shear-induced unfolding triggers adhesion of von willebrand factor fibers. Proceedings of the National Academy of Sciences of the United States of America. 104, 7899-7903 (2007).
- Reneman, R. S., Hoek, A. P. G. Wall shear stress as measured in vivo: consequences for the design of the arterial system. Medical & Biological Engineering & Computing. 46 (5), 499-507 (2008).
- Valentijn, K. M., Sadler, J. E., Valentijn, J. A., Voorberg, J., Eikenboom, J. Functional architecture of Weibel- Palade bodies. Blood. 117, 5033-5043 (2011).
- Freshney, R. I. . Culture of animal cells: A manual of basic Technique, 5th edition. , (2005).
- Shaw, J. A., Shaw, A. J. . Epithelial cell culture- a practical approach. , 218 (1996).
- Elm, C., et al. Ectodomains 3 and 4 of human polymeric Immunoglobulin receptor (hpIgR) mediate invasion of Streptococcus pneumoniae into the epithelium. Journal of Biological Chemistry. 279 (8), 6296-6304 (2004).
- Nerlich, A., et al. Invasion of endothelial cells by tissue-invasive M3 type group A streptococci requires Src kinase and activation of Rac1 by a phosphatidylinositol 3-kinase-independent mechanism. Journal of Biological Chemistry. 284 (30), 20319-20328 (2009).
- Ho, C. T., et al. Liver-cell patterning lab chip: mimicking the morphology of liver lobule tissue. Lab on a Chip. 13, 3578-3587 (2013).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328, 1662-1668 (2010).
- Harink, B., Le Gac, S., Truckenmuller, R., van Blitterswijk, C., Habibovic, P. Regeneration-on-a-chip? The perspectives on use of microfluidics in regenerative medicine. Lab on a Chip. 13, 3512-3528 (2013).

