Modèle de carcinogenèse de la peau induitparé par des produits chimiques à l'aide de Dimethylbenz[a]Anthracene et 12-O-Tetradecanoyl Phorbol-13-Acetate (DMBA-TPA)
Summary
La carcinogenèse de peau à deux étapes est induite par deux produits chimiques topiques appliqués. Un mutagène 7,12-dimethylbenz[a]anthracene) provoque des mutations dans les cellules épidermiques et une application continue du stimulateur de croissance générale 12-O-tetradecanoyl phorbol-13-acetate accélère la formation de papillome cutané.
Abstract
Le cancer est l’une des maladies humaines les plus dévastatrices. Les modèles expérimentaux de cancer sont importants pour obtenir la perspicacité dans l’interaction complexe de différents types et gènes de cellules en favorisant la progression de tumeur et pour fournir une plate-forme pour tester l’efficacité de différentes approches thérapeutiques. L’un des modèles expérimentaux de cancer inflammatoire le plus couramment utilisé est le modèle de cancérogène de la peau à deux étapes DMBA-TPA. La formation de tumeur est induite dans ce modèle par l’application topique de deux produits chimiques différents, 7,12-dimethylbenz[a]anthracene (DMBA) et 12-O-tetradecanoyl phorbol-13-acetate (TPA), qui causent ensemble la formation de papillome dans la peau. Comme le résultat primaire est la formation de papillome dans la peau, le modèle est un moyen idéal, fiable, et reproductible pour adresser l’initiation de tumeur (survie tumeur-libre) et la progression de tumeur (nombre et taille des tumeurs visibles). Les effets du traitement DMBA-TPA sont transmis par un mécanisme inflammatoire, ce qui rend ce modèle particulièrement approprié pour étudier le rôle du système immunitaire dans la formation tumorale. Cependant, ce modèle est limité à la peau et à d’autres surfaces où les produits chimiques peuvent être appliqués. Un protocole détaillé est fourni dans cet article pour utiliser le modèle avec succès.
Introduction
Le cancer est l’une des principales causes de décès dans le monde. Par conséquent, il y a une demande pour développer des modèles expérimentaux fiables de maladie pour obtenir une meilleure compréhension de la maladie aussi bien que pour explorer des approches thérapeutiques potentielles. L’un des modèles expérimentaux in vivo les plus couramment utilisés pour étudier le développement du cancer de la peau est le modèle de carcinogenèse de la peau à deux étapes induit chimiquement à deux étapes1,2. Le modèle fournit un outil pour étudier l’initiation, la promotion et la progression de tumeur en plus des événements spécifiques tels que l’infiltration de cellules immunitaires et l’angiogenèse.
Pour employer le modèle de carcinogenèse de peau de deux étapes, la peau arrière des souris est traitée avec deux produits chimiques différents qui induisonnt ensemble la formation de tumeur. Le modèle est initié avec une faible dose de la mutagène, DMBA, suivie d’une exposition prolongée au promoteur de la tumeur, TPA3 (Figure 1). DMBA mute l’ADN au hasard en formant des adducts covalents avec l’ADN des cellules épidermiques et des cellules souches de kératinocyte primaire4,5,6,7. Certaines de ces mutations aléatoires ont lieu dans un proto-oncogène, comme Hras1 (mutations dans Kras et Nras sont également détectées) et la conversion de proto-oncogènes en oncogènes conduit la formation tumorale sous des stimuli appropriés. TPA, à son tour, est l’agent de croissance de croissance de tumeur le plus couramment utilisé. Sa cible moléculaire est la protéine kinase C (PKC)8. TPA active également la signalisation Wnt/ -caténine qui est cruciale pour la formation de tumeur dans le modèle9. L’exposition répétée et prolongée à l’agent de promotion mène à la signalisation accrue de cellules, à la production accrue des facteurs de croissance, et à une réaction inflammatoire locale, qui sont évidentes dues à la synthèse accrue d’ADN et à l’infiltration inflammatoire de cellules dans la peau traitée.
Les principaux médiateurs inflammatoires du modèle DMBA-TPA ont été identifiés10. Interleukin-17A (IL-17A) est connu pour être particulièrement tumorigène dans le modèle DMBA-TPA11,12. Il travaille en synergie avec l’interleukine 6 (IL-6) et participe au recrutement de macrophage et de neutrophile13,14. En outre, les cellules CD4et T et les neutrophiles se sont avérés tumorigènes dans le modèle DMBA-TPA. Enfin, les macrophages peuvent également promouvoir la tumorigénèse dans le modèle15,16,17.
Pendant la phase de promotion, la prolifération cellulaire des cellules mutées est améliorée et une hyperplasie soutenue de l’épiderme est maintenue1. Cela conduit au développement du papillome dans la peau en 10-20 semaines, après quoi les papillomes commencent à se convertir en tumeurs malignes, carcinomes épidermoïdes (SCC)2. Cependant, moins de 10% des papillomes progressent vers la malignité, bien que ce pourcentage dépende également du fond génétique des souris2,18. Pendant des décennies, on ne savait pas quel type de cellules ont été initialement mutés dans les tumeurs conduisant à la malignité, même si certaines études avaient rapporté des caractéristiques clairement distinctes dans les tumeurs malignes par rapport aux papillomes bénins19,20. Cependant, des études récentes ont considérablement augmenté notre compréhension sur l’origine clonale de la formation de tumeur dans le modèle21de DMBA-TPA. 22. 23. Il a été démontré que les deux cellules épithéliales dérivées de moelle osseuse et les cellules souches pileux follicules contribuent à la formation de tumeur22. Des études de traçage de lignée scénographie spécifiques à la scène ont révélé que les papillomes bénins sont d’origine monoclonal, mais ils recrutent de nouvelles populations épithéliales21,23. Cependant, un seul des clones cellulaires fonctionne comme un moteur de la carcinogenèse; il contient une mutation hras23. La progression vers la formation de carcinome est associée à un balayage clonal23.
Le DMBA cancérogène initie la formation de papillome et TPA favorise la croissance tumorale. Par conséquent, l’initiation de tumeur peut être étudiée séparément de la promotion en interrompant l’expérience avant la période de traitement de TPA. Comme la progression de tumeur est étudiée hebdomadairement elle offre une grande occasion pour l’analyse détaillée de croissance de tumeur tout au long de l’étude. Puisque les tumeurs sont produites par des produits chimiques externes, une mutation oncogène dans la lignée germinale est inutile. Ainsi, l’étude des effets d’un fond génétique (par exemple, knock-out/transgène contre type sauvage) sur la tumorigénèse est simple2. En somme, le modèle de cancer de la peau DMBA/TPA est une approche particulièrement utile pour étudier le rôle du système immunitaire dans la progression tumorale ainsi que pour l’évaluation des étapes d’initiation et de promotion de tumeur indépendamment ou interdépendante.
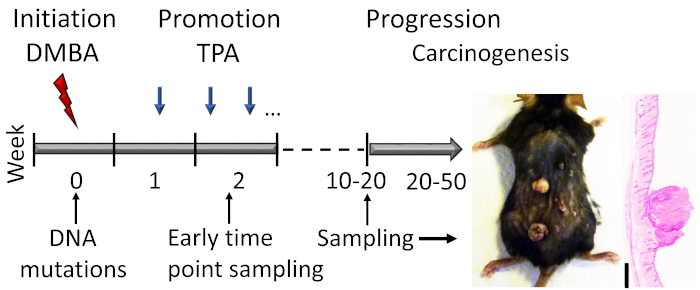
Figure 1 : Contour du modèle de carcinogenèse de la peau induit par DMBA-TPA. Le DMBA cancérogène est appliqué topiquement pour induire des mutations d’ADN dans la phase d’initiation du modèle. L’agent de promotion de la croissance TPA est administré 2x par semaine pour améliorer la prolifération cellulaire pendant la phase de promotion, conduisant au développement de papillomes dans la peau. Les animaux sont sacrifiés après que la réponse du papillome a atteint un plateau, généralement dans les semaines 15-20, selon le fond génétique des souris. Une petite proportion des papillomes peut se développer davantage en SCC dans un délai de 20 à 50 semaines. Pour étudier les premiers événements de la phase d’initiation et de promotion précoce, des échantillons peuvent être prélevés (p. ex., peu de temps après la deuxième demande d’APT). Une photographie représentative et l’hématoxylin et l’éosine souillées section transversale des papillomes sur une peau de souris C57BL/6 après 19 semaines de traitement sont montrées. Barre d’échelle de 0,1 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Protocol
Representative Results
Discussion
Le cancer de la peau d’Origine DMBA-TPA est l’un des modèles de cancer les plus couramment utilisés parce qu’il est hautement reproductible et fournit des informations sur la progression tumorale de l’initiation à la malignité. La principale mesure des résultats, la formation du papillome, est facilement et de manière fiable quantitative. Le modèle traite à la fois de l’initiation tumorale (survie sans tumeur) et de la progression (nombres et tailles tumoraux) simultanément. Le modèle est adapté pour l’étude …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ces travaux ont été financés par l’Académie de Finlande (subventions 25013080481 et 25013142041 (I.J.), 286377 et 295814 (M.P.), 287907 (T.J.)), fondation Deivikki et Sakari Sohlberg (M.P., T.J.), Finnish Medical Foundation (T.P.), The Competitive State Research Financement de la zone de responsabilité d’expert de l’hôpital universitaire de Tampere (subvention 9V049 et 9X044 (M.P.), 9X011 et 9V010 (T.J.)), Le financement de la recherche d’État concurrentiel de la zone de responsabilité experte des laboratoires Fimlab (subvention X51409 (I.J.)), Tays Fondation de soutien (I.J., M.P., T.J.), Tampere Tuberculosis Foundation (I.J., M.P., T.J.), la Finnish Cultural Foundation (M.V.), la Paulo Foundation (T.P.), Cancer Society of Finland (M.P.) et la Fondation Emil Aaltonen (T.P.).
Materials
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm – Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
References
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. 암 연구학. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126 (2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. 암 연구학. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154 (2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. 암 연구학. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994 (2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431 (2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266 (2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663 (2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. 암 연구학. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. 암 연구학. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293 (2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532 (2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -. P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).

