डाइमिथाइलबेंज [ए] एंथ्रेसीन और 12-ओ-टेट्रेडकैनोइल फोर्बोल-13-एसीटेट (DMBA-टीपीए) का उपयोग करके रासायनिक-प्रेरित त्वचा कार्सिनोजेनेसिस मॉडल
Summary
दो चरण त्वचा कार्सिनोजेनेसिस दो सामयिक रूप से लागू रसायनों से प्रेरित होता है। एक म्यूटाजेन 7,12-डाइमेथिलबेंज [ए]एंथ्रेसीन) एपिडर्मल कोशिकाओं में उत्परिवर्तन का कारण बनता है और सामान्य विकास उत्तेजक 12-ओ-टेट्रेडकैनोइल फोर्बोल-13-एसीटेट के निरंतर अनुप्रयोग त्वचा पेपिलोमा गठन को तेज करता है।
Abstract
कैंसर सबसे विनाशकारी मानव रोगों में से एक है। प्रयोगात्मक कैंसर मॉडल ट्यूमर प्रगति को बढ़ावा देने में विभिन्न सेल प्रकार और जीन के जटिल परस्पर क्रिया में अंतर्दृष्टि प्राप्त करने के लिए और विभिन्न चिकित्सीय दृष्टिकोण की प्रभावकारिता के परीक्षण के लिए एक मंच प्रदान करने के लिए महत्वपूर्ण हैं। सबसे अधिक इस्तेमाल किया प्रयोगात्मक भड़काऊ कैंसर मॉडल में से एक DMBA-TPA दो चरण त्वचा कैंसर कारक मॉडल है । ट्यूमर गठन दो अलग-अलग रसायनों, 7,12-डाइमिथाइलबेंज [ए]एंथ्रेसीन (DMBA) और 12-O-tetradecanoyl phorbol-13-acetate (टीपीए) के सामयिक आवेदन द्वारा इस मॉडल में प्रेरित किया जाता है, जो एक साथ त्वचा में पेपिलोमा गठन का कारण बनता है। चूंकि प्राथमिक परिणाम त्वचा में पेपिलोमा गठन है, मॉडल ट्यूमर दीक्षा (ट्यूमर मुक्त अस्तित्व) और ट्यूमर प्रगति (दृश्यमान ट्यूमर की संख्या और आकार) दोनों को संबोधित करने का एक आदर्श, विश्वसनीय और प्रजनन योग्य तरीका है। DMBA-टीपीए उपचार के प्रभाव एक भड़काऊ तंत्र के माध्यम से प्रेषित होते हैं, जो इस मॉडल को ट्यूमर गठन में प्रतिरक्षा प्रणाली की भूमिका का अध्ययन करने के लिए विशेष रूप से उपयुक्त बनाता है। हालांकि, यह मॉडल त्वचा और अन्य सतहों तक सीमित है जहां रसायनों को लागू किया जा सकता है। मॉडल का सफलतापूर्वक उपयोग करने के लिए इस लेख में एक विस्तृत प्रोटोकॉल प्रदान किया गया है।
Introduction
कैंसर दुनिया में मौत के प्रमुख कारणों में से एक है। इसलिए, रोग की बेहतर समझ प्राप्त करने के साथ-साथ संभावित चिकित्सीय दृष्टिकोणों का पता लगाने के लिए विश्वसनीय प्रयोगात्मक रोग मॉडल विकसित करने की मांग की गई है। त्वचा कैंसर के विकास का अध्ययन करने के लिए वीवो मॉडल में सबसे अधिक उपयोग किए जाने वाले प्रयोगात्मक में से एक रासायनिक रूप से प्रेरित दो-चरण त्वचा कार्सिनोजेनेसिस मॉडल1,2है। मॉडल प्रतिरक्षा सेल घुसपैठ और एंजियोजेनेसिस जैसी विशिष्ट घटनाओं के अलावा ट्यूमर दीक्षा, पदोन्नति और प्रगति का अध्ययन करने के लिए एक उपकरण प्रदान करता है।
दो चरण त्वचा कार्सिनोजेनेसिस मॉडल का उपयोग करने के लिए, चूहों की पीठ की त्वचा को दो अलग-अलग रसायनों के साथ इलाज किया जाता है जो एक साथ ट्यूमर गठन को प्रेरित करते हैं। मॉडल को म्यूटाजेन, DMBA की कम खुराक के साथ शुरू किया जाता है, जिसके बाद ट्यूमर प्रमोटर, टीपीए3 (चित्रा 1)के लिए लंबे समय तक एक्सपोजर होता है। डीएमबीए एपिडरमल कोशिकाओं और प्राथमिक केराटिनोसाइट स्टेम सेल4,5,6,7के डीएनए के साथ सहसंयोजक एडक्ट्स बनाकर डीएनए को बेतरतीब ढंग से म्यूट करता है । इनमें से कुछ यादृच्छिक उत्परिवर्तन एक प्रोटो-ऑन्कोजीन में होते हैं, जैसे कि Hras1 (Kras और Nras में उत्परिवर्तन भी पता लगाया जाता है) और प्रोटो-ऑन्कोजीन का ऑन्कोजीन में रूपांतरण उचित उत्तेजनाओं के तहत ट्यूमर गठन को चलाता है। टीपीए, बदले में, सबसे अधिक इस्तेमाल किया ट्यूमर विकास को बढ़ावा देने एजेंट है । इसका आणविक लक्ष्य प्रोटीन किनाज सी (पीकेसी)8है । टीपीए भी Wnt/-catenin संकेत है कि मॉडल9में ट्यूमर गठन के लिए महत्वपूर्ण है सक्रिय करता है । को बढ़ावा देने वाले एजेंट के लिए दोहराया और लंबे समय तक जोखिम बढ़ाया सेल संकेत, विकास कारकों के उत्पादन में वृद्धि, और एक स्थानीय भड़काऊ प्रतिक्रिया है, जो डीएनए संश्लेषण और इलाज त्वचा में भड़काऊ सेल घुसपैठ के कारण स्पष्ट कर रहे है की ओर जाता है ।
DMBA-टीपीए मॉडल में प्रमुख भड़काऊ मध्यस्थों की पहचान10की गई है । इंटरल्यूकिन-17ए (आईएल-17ए) को DMBA-टीपीए मॉडल11,12में विशेष रूप से ट्यूमरीजेनिक माना जाता है। यह इंटरल्यूकिन 6 (आईएल-6) के साथ तालमेल में काम करता है और मैक्रोफेज और न्यूट्रोफिल भर्ती13,14में भाग लेता है । इसके अलावा डीएमबीए-टीपीए मॉडल मेंसीडी4+ टी सेल और न्यूट्रोफिल को ट्यूमरीजेनिक दिखाया गया है। अंत में, मैक्रोफेज मॉडल15,16,17में ट्यूमरजेनेसिस को भी बढ़ावा दे सकता है।
पदोन्नति चरण के दौरान, उत्परिवर्तित कोशिकाओं के कोशिका प्रसार को बढ़ाया जाता है और एपिडर्मिस की निरंतर हाइपरप्लासिया1बनाए रखी जाती है। इससे त्वचा में 10-20 सप्ताह में पेपिलोमा विकास होता है, जिसके बाद पेपिलोमा घातक ट्यूमर, स्क्वैमस सेल कार्सिनोमा (एससीसी)2में परिवर्तित होना शुरू हो जाता है। हालांकि, पेपिलोमा का 10% से भी कम द्रोह करने के लिए प्रगति करता है, हालांकि यह प्रतिशत चूहों2,18की आनुवंशिक पृष्ठभूमि पर भी निर्भर करता है। दशकों से यह ज्ञात नहीं था कि ट्यूमर में शुरू में किस प्रकार की कोशिकाओं को द्रोह की ओर ले जाया गया था, भले ही कुछ अध्ययनों ने सौम्य पेपिलोमास19,20की तुलना में घातक ट्यूमर में स्पष्ट रूप से अलग विशेषताओं की सूचना दी थी। हालांकि, हाल के अध्ययनों से DMBA-टीपीए मॉडल21में ट्यूमर गठन की क्लोनल उत्पत्ति पर हमारी समझ बहुत बढ़ गईहै। 22. 23. यह प्रदर्शन किया गया था कि दोनों अस्थि मज्जा व्युत्पन्न एपिथेलियल कोशिकाओं और बाल कूप स्टेम कोशिकाओं ट्यूमर गठन22में योगदान . स्टेज-विशिष्ट वंश ट्रेसिंग अध्ययनों का अनावरण किया गया है कि सौम्य पेपिलोमा मोनोक्लोनल मूल के हैं, लेकिन वे21,23नए एपिथेलियल सेल आबादी की भर्ती करते हैं। हालांकि, केवल एक सेल क्लोन कार्सिनोजेनेसिस के लिए एक ड्राइवर के रूप में कार्य करता है; यह एक Hras म्यूटेशन23शामिल हैं . कार्सिनोमा गठन की प्रगति क्लोनल स्वीप23से जुड़ी हुई है ।
कार्सिनोजन DMBA पेपिलोमा गठन शुरू करता है और टीपीए ट्यूमर के विकास को बढ़ावा देता है। इसलिए, टीपीए उपचार अवधि से पहले प्रयोग में व्यवधान डालकर ट्यूमर दीक्षा का प्रचार से अलग से अध्ययन किया जा सकता है। के रूप में ट्यूमर प्रगति साप्ताहिक अध्ययन किया है यह अध्ययन के दौरान विस्तृत ट्यूमर विकास विश्लेषण के लिए एक महान अवसर प्रदान करता है । क्योंकि ट्यूमर बाहरी रसायनों से उत्पन्न होते हैं, अंकुरित में एक ऑन्कोजेनिक उत्परिवर्तन अनावश्यक है। इस प्रकार, ट्यूमरजीनिस पर आनुवंशिक पृष्ठभूमि (जैसे, नॉकआउट/ट्रांसजीन बनाम जंगली प्रकार) के प्रभावों का अध्ययन करना सीधा2है । संक्षेप में, DMBA/टीपीए त्वचा कैंसर मॉडल ट्यूमर प्रगति में प्रतिरक्षा प्रणाली की भूमिका का अध्ययन करने के साथ ही ट्यूमर दीक्षा और संवर्धन कदम स्वतंत्र रूप से या परस्पर निर्भर के मूल्यांकन के लिए एक विशेष रूप से उपयोगी दृष्टिकोण है ।
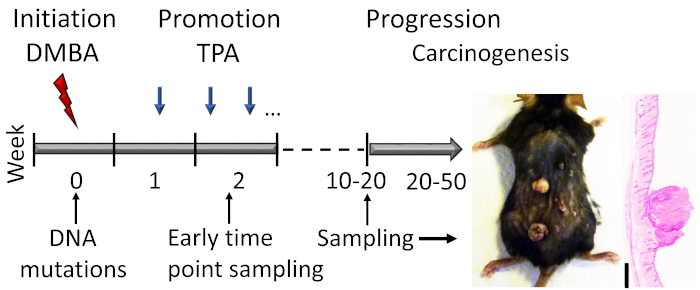
चित्रा 1: DMBA-टीपीए प्रेरित त्वचा कैंसरजन्य मॉडल रूपरेखा। कार्सिनोजन DMBA मॉडल के दीक्षा चरण में डीएनए म्यूटेशन को प्रेरित करने के लिए सामयिक रूप से लागू किया जाता है। विकास को बढ़ावा देने वाले एजेंट टीपीए को पदोन्नति चरण के दौरान सेल प्रसार को बढ़ाने के लिए एक सप्ताह में 2x प्रशासित किया जाता है, जिससे त्वचा में पेपिलोमा का विकास होता है। जानवरों की बलि के बाद papilloma प्रतिक्रिया एक पठार तक पहुंचता है, आमतौर पर सप्ताह के भीतर 15-20, चूहों की आनुवंशिक पृष्ठभूमि पर निर्भर करता है । पेपिलोमा का एक छोटा सा अनुपात 20-50 सप्ताह के भीतर एससीसी में और विकसित हो सकता है। दीक्षा और प्रारंभिक पदोन्नति चरण में प्रारंभिक घटनाओं का अध्ययन करने के लिए, नमूने एकत्र किए जा सकते हैं (उदाहरण के लिए, दूसरे टीपीए आवेदन के तुरंत बाद)। उपचार के 19 सप्ताह के बाद C57BL/6 माउस त्वचा पर पेपिलोमास के एक प्रतिनिधि तस्वीर और हेमैटोक्सिलिन और eosin दाग पार अनुभाग दिखाया जाता है । स्केल बार = 0.1 मिमी। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
DMBA-टीपीए प्रेरित त्वचा कैंसर सबसे अधिक इस्तेमाल किया कैंसर मॉडल में से एक है क्योंकि यह अत्यधिक प्रजनन योग्य है और दीक्षा से द्रोह के लिए ट्यूमर प्रगति के बारे में जानकारी प्रदान करता है । प्रमुख परिणा?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
इस काम को फिनलैंड अकादमी (अनुदान 25013080481 और 25013142041 (I.J.), 286377 और 295814 (मप्र), 287907 (जे.जे.), Päivikki और सकरी सोहलबर्ग फाउंडेशन (एम.पी., द्वारा वित्त पोषित किया गया था, टीजे), फिनिश मेडिकल फाउंडेशन (टीपी), प्रतिस्पर्धी राज्य अनुसंधान टैम्परे विश्वविद्यालय अस्पताल के विशेषज्ञ उत्तरदायित्व क्षेत्र का वित्तपोषण (अनुदान 9V049 और 9X044 (मप्र), 9X011 और 9V010 (T.J.)), फिमलाब प्रयोगशालाओं के विशेषज्ञ उत्तरदायित्व क्षेत्र के प्रतिस्पर्धी राज्य अनुसंधान वित्तपोषण (अनुदान X51409 (I.J.)), Tays समर्थन फाउंडेशन (I.J., M.P., J.J.), टैम्परे तपेदिक फाउंडेशन (I.J., M.P., J.J.), फिनिश कल्चरल फाउंडेशन (M.V.), पाउलो फाउंडेशन (T.P.), फिनलैंड के कैंसर सोसायटी (M.P.), और एमिल Aaltonen फाउंडेशन (T.P.) ।
Materials
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm – Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
References
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. 암 연구학. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126 (2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. 암 연구학. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154 (2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. 암 연구학. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994 (2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431 (2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266 (2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663 (2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. 암 연구학. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. 암 연구학. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293 (2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532 (2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -. P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).

