Использование Tg (Vtg1:mcherry) Эмбрионы зебры для тестирования эстрогенных эффектов эндокринных разрушающих соединений
Summary
Здесь представлен подробный протокол использования эмбрионов зебры Tg (vtg1: mCherry) для выявления эстрогенных эффектов. Протокол охватывает распространение рыбы и лечение эмбрионов, а также подчеркивает обнаружение, документацию и оценку флуоресцентных сигналов, индуцированных эндокринными разрушающих соединений (EDC).
Abstract
Есть много эндокринных разрушающих соединений (EDC) в окружающей среде, особенно эстрогенных веществ. Обнаружение этих веществ затруднено из-за их химического разнообразия; таким образом, все больше и больше эффект-обнаружение методы используются, такие как эстрогенный эффект чувствительных биомониторов / биоиндикатных организмов. Эти биомониторинговые организмы включают в себя несколько моделей рыб. Этот протокол охватывает использование трансгенной линии зебры Tg (vtg1: mCherry) в качестве биомониторинга организма, включая распространение рыбы и обработку эмбрионов, с акцентом на обнаружение, документацию и оценку флуоресцентных сигналов, индуцированных EDC. Целью работы является демонстрация использования трансгенных эмбрионов Tg (vtg1: mCherry) для обнаружения эстрогенных эффектов. Эта работа документирует использование трансгенных эмбрионов зебры Tg (vtg1: mCherry) для обнаружения эстрогенных эффектов путем тестирования двух эстрогенных веществ, з-и-зеараленол. Описанный протокол является лишь основой для разработки анализов; метод тестирования может быть изменен в зависимости от конечных точек тестирования и образцов. Кроме того, он может быть объединен с другими методами анализа, тем самым облегчая дальнейшее использование трансгенной линии.
Introduction
Существует значительное количество эндокринных разрушающих соединений (EDC), которые являются одними из самых опасных веществ в нашей окружающей среде. В основном это эстрогенные соединения, которые загрязняют воду из природных ресурсов. Химическое разнообразие веществ, принадлежащих к группе, затрудняет тестирование на их присутствие, поскольку для их обнаружения требуются различные аналитические методы. Основываясь на их химической структуре очень трудно определить, является ли вещество на самом деле в состоянии выступать в качестве эстрогена. Кроме того, эти вещества никогда не присутствуют в чистом виде в окружающей среде, поэтому их последствия могут быть затронуты другими соединениями, слишком1. Эта проблема может быть решена с помощью эффект-обнаружение методов, таких как использование биомониторов / биоиндикатных организмов, которые показывают эстрогенные эффекты2,,3,,4,5.
В последнее время, различные клеточные линии6 и дрожжей на основе тестовых систем2,3 были разработаны для обнаружения эстрогенных эффектов. Тем не менее, они, как правило, только в состоянии обнаружить привязку вещества к рецептору эстрогена2,3. Кроме того, они не в состоянии моделировать сложные физиологические процессы в организме или обнаруживать гормоночувствительные фазы жизненных стадий; таким образом, они часто приводят к ложным результатам.
Известно, что некоторые гены чутко реагируют на эстроген в живых организмах7. Обнаружение генных продуктов методами молекулярной биологии также возможно на уровнепротеинаили мРНК 8 ,9,но обычно включает животную жертву. Законы о защите животных стали более строгими, и растет спрос на альтернативные системы испытаний, которые сводят к минимуму количество и страдания животных, используемых в экспериментах или замены животного модели с другой моделью системы10. С открытием флуоресцентных белков и созданием линий биомаркеров, трансгенные технологии обеспечивают хорошую альтернативу11. С помощью этих линий, активация эстроген-чувствительный ген может быть проверена in vivo.
Среди позвоночных неотябавный потенциал рыбы в оценке экологического риска. Они предлагают много преимуществ перед моделями млекопитающих: будучи водными организмами, они способны поглощать загрязняющие вещества через все их тело, производить большое количество потомства, а некоторые из их видов характеризуются коротким временем поколения. Их эндокринная система и физиологические процессы показывают большое сходство с другими позвоночными и даже с млекопитающими, в том числе людей12.
Также известно несколько генов для выявления эстрогенных эффектов у рыб. Наиболее важными являются рецепторы эстрогена ароматазы-b, чориогенин-H, и вителлогенин (втг)7,13. В последнее время несколько эстроген-производящих биосенсорных линий также были созданы из рыбных моделей, используемых в лаборатории, таких как из зебры(Данио рерио)4,5,14,15,16,17. Основным преимуществом зебры в создании биосенсорных линий является прозрачное тело эмбрионов и личинок, потому что флуоресцентный сигнал репортера можно легко изучить в виво, не жертвуя животным10. В дополнение к защите животных, это также ценная особенность, поскольку она позволяет для изучения реакции одного и того же человека в разное время лечения18.
Эти эксперименты используют vitellogenin репортер трансгенной зебры линии15. Трансгенная конструкция, используемая для разработки Tg (vtg1:mCherry), имеет длинный (3,4 кбп) естественный вителлогенин-1 промоутер. Рецептор эстрогена (ER) является усилитель белка активируется лиганды, который является представителем стероидных / ядерных рецепторов суперсемейства. ER связывается с конкретными последовательностями ДНК, называемыми элементами реакции эстрогена (EREs) с высоким сродством и трансактивирует экспрессию генов в ответ на эстрадиол и другие эстрогенные вещества, поэтому чем больше ERE в промоутере вызывает более сильную реакцию19. Есть 17 ERE сайтов в области промоутера Tg (vtg1:mCherry) трансгена построить, и они, как ожидается, имитировать выражение родного гена vtg15. Существует непрерывное выражение флуоресцентного сигнала у сексуально созревает самок. Однако у мужчин и эмбрионов экспрессия в печени видна только при лечении эстрогенными веществами(рисунок 1).
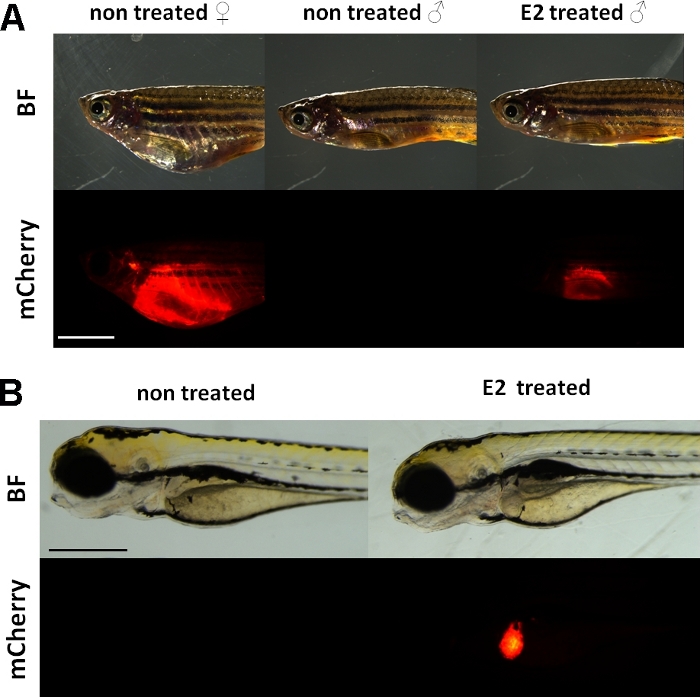
Рисунок 1: Красный флуоресцентный сигнал в печени vtg1:mЧерри трансгенных взрослых зебры и 5 dpf эмбрионов, после 17-я-эстрадиол (E2) индукции. У самок и у мужчин, обработанных Е2 (25 мкг/л времени воздействия:48hrs) сильная флуоресценция печени видна даже через пигментированную кожу. Нет флуоресцентный сигнал не виден в необработанных мужчин (). После индукции E2 (время экспозиции 50 мкг/л: 0-120 л.с.) можно также наблюдать красный флуоресцентный сигнал в печени 5 эмбрионов dpf, который не виден в контрольных эмбрионах(B). В то время как флуоресцентный сигнал постоянно присутствует у взрослых самок, в первую очередь мужчины и эмбрионы линии подходят для обнаружения эстрогенных эффектов. (BF: яркое поле, mCherry: красный флуоресцентный вид фильтра, однозначные изображения, шкала бар A: 5mm, масштаб бар B: 250 мкм) Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Как и эндогенный вителлогенин, репортер mCherry выражается только в печени. Поскольку вителлогенин производится только в присутствии эстрогена, нет флуоресцентного сигнала в элементах управления. Потому что выражение только в печени, оценка результатов гораздо проще15.
Чувствительность и удобство использования эмбрионов этой линии были исследованы на различных эстрогенных смеси, а также на экологических образцов15,,20, и в большинстве случаев доза-ответ отношения были задокументированы (Рисунок 2). Однако, в случае высокотоксичных, в основном гепатотоксических веществ (например, зеараленон), только очень слабый флуоресцентный сигнал может быть виден в печени обработанных эмбрионов и максимальной интенсивности флуоресцентный сигнал, вызванный может быть достигнуто в пределах очень небольшой диапазон концентрации, что делает его трудно установить доза-эффект отношений20.
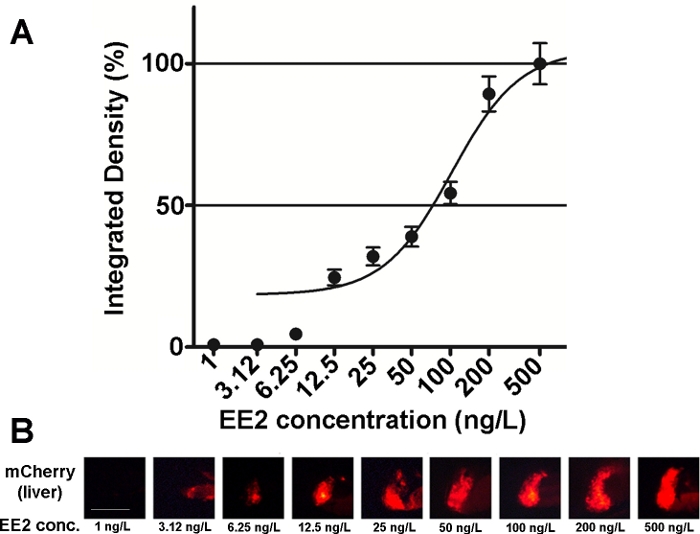
Рисунок 2: Диаграмма доза-реакция (A) и флуоресцентные изображения (mCherry) печени (B) подвергаются 17-З-этинилэстрадиол (EE2), в 5 dpf vtg1:mCherry личинок. Результаты выражаются как интегрированная плотность, генерируемая из силы сигнала и размера пораженного участка (SEM, n ю 60). 100% относится к наблюдаемым максимуму. Интенсивность флуоресцентного сигнала постепенно увеличивалась с концентрацией. Масштабная панель No 250 м. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
Есть несколько эстрогенных веществ, присутствующих в окружающей среде, 17-э-эстрадиол (экологическая концентрация: 0,1-5,1 нг/л)21,17-й-этинилэстрадиол (экологическая концентрация: 0,16–0,2 г/л) L)22, зеараленон (экологическая концентрация: 0,095-0,22 мкг/л)23, бисфенол-А (экологическая концентрация: 0,45-17,2 мг/л)24. При тестировании этих веществ в чистом активном виде с помощью трансгенных эмбрионов mCherry, самые низкие наблюдаемые концентрации эффекта (LOEC) для обнаружения флуоресцентных знаков были 100 нг/л для 17-й-эстрадиола, 1 нг/л для 17-З-этинилэстрадиола, 100 нг/л для зеараленона и 1 мг/л для бисфенола-А (96-120 л.с.), что очень близко к или в пределах экологических концентраций веществ15. Трансгенная линия Tg (vtg1:mCherry) может помочь обнаружить эстрогенность в образцах сточных вод после прямого воздействия. Линия так же чувствительна, как обычно используемый тест дрожжевого эстрогена, биолюминисцентный дрожжевой эстроген (BLYES) анализ15. С помощью этой линии, защитные эффекты бета-циклодекстрина против зеараленона индуцированной токсичности было подтверждено с помощью химических смесей20.
В недавнем докладе, in vivo использование трансгенной линии было продемонстрировано с помощью двух эстрогенных зеленонов (ЗЕА) метаболитов, з– и Зеараленол (З-ЗОЛ И-ЗОЛ)25. Базовый протокол подходит для изучения эстрогенного воздействия нескольких соединений или образцов окружающей среды на эмбрионах Tg (vtg1:mCherry).
Protocol
Representative Results
Discussion
Использование биомониторов/биоиндикатов для эстрогенного воздействия распространяется в токсикологических исследованиях. In vivo модели играют выдающуюся роль, так как в отличие от проб в пробирке, они не только предоставляют информацию о реакции клетки или рецептора, но и позволяют ис?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана Национальным управлением по исследованиям, разработкам и инновациям (NKFIH) из Национального фонда исследований, разработок и инноваций (NKFIA); Грантовое соглашение: NVKP_16-1-2016-0003, EFOP-3.6.3-VEKOP-16-2017-00008 проект, совместно финансируемый Европейским Союзом, и тематическая программа передового опыта NKFIH-831-10/2019 Университета Сента Иштвана, присуждаемая Министерством инноваций и технологий.
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

