Imagem de células vivas do ciclo de vida do predador bacteriano Bdellovibrio bacteriovorus usando microscopia de fluorescência de lapso de tempo
Summary
Apresentado aqui é um protocolo que descreve o monitoramento do ciclo de vida completo da bactéria predatória Bdellovibrio bacteriovorus usando microscopia de fluorescência de lapso de tempo em combinação com uma almofada de agarose e pratos de imagem celular.
Abstract
Bdellovibrio bacteriovorus é uma pequena bactéria predatória obrigatória que mata outras bactérias gram-negativas, incluindo patógenos nocivos. Portanto, é considerado um antibiótico vivo. Para aplicar B. bacteriovorus como um antibiótico vivo, é primeiro necessário entender os principais estágios de seu complexo ciclo de vida, particularmente sua proliferação dentro da presa. Até agora, tem sido desafiador monitorar sucessivas etapas do ciclo de vida predatório em tempo real. Apresentado aqui é um protocolo abrangente para imagens em tempo real do ciclo de vida completo de B. bacteriovorus, especialmentedurante seu crescimento dentro do hospedeiro. Para isso, um sistema composto por uma almofada de agarose é usado em combinação com pratos de imagem celular, no qual as células predatórias podem se mover livremente sob a almofada de agarose enquanto as células de presas imobilizadas são capazes de formar bdelloplastos. A aplicação de uma cepa que produz uma β-subunidade fluorescente de DNA polimerase III permite ainda que a replicação do cromossomo seja monitorada durante a fase de reprodução do ciclo de vida B. bacteriovorus.
Introduction
Bdellovibrio bacteriovorus é uma pequena (0,3-0,5 μm por 0,5-1,4 μm) gram-negativo bactéria que caça outras bactérias gram-negativas, incluindo patógenos nocivos como Klebsiella pneumoniae, Pseudomonas aeruginosa e Shigella flexneri1,2,3. Uma vez que b. bacteriovorus mata patógenos, é considerado um antibiótico vivo potencial que pode ser aplicado para combater infecções bacterianas, particularmente aquelas causadas por cepas multidroga resistentes.
B. bacteriovorus exibe um ciclo de vida peculiar composto por duas fases: uma fase de ataque não replicativo de vida livre e uma fase reprodutiva intracelular(Figura 1). Na fase de vida livre, esta bactéria altamente motile, que se move a velocidades de até 160 μm/s, procura por sua presa. Depois de anexar à membrana externa da presa, ela entra no periplasma4,5. Durante a fase reprodutiva interperiplasmática, B. bacteriovorus usa uma infinidade de enzimas hidrolíticas para degradar as macromoléculas do hospedeiro e reutilizá-las para seu próprio crescimento. Logo após invadir o periplasma, a célula hospedeira morre e incha em uma estrutura esférica chamada bdelloplast, dentro da qual a célula predatória alonga e replica seus cromossomos. O processo de replicação começa na origem de replicação (oriC)6 e prossegue até que várias cópias do cromossomo tenham sido completamente sintetizadas7. Curiosamente, a replicação de cada cromossomo não é seguida pela divisão celular. Em vez disso, o predador se alonga para formar uma célula longa, multinucleóide e filamentosa. Após o esgotamento dos nutrientes, o filamento sofre septação síncrola e as células progêneras são liberadas do bdelloplast8.
Antes que b. bacteriovorus possa ser usado como um antibiótico vivo contra infecções bacterianas, é crucial entender os principais estágios de seu ciclo de vida, particularmente aqueles relacionados à sua proliferação dentro da presa. A imagem de células vivas de B. bacteriovorus tem sido desafiadora, devido às várias formas morfológicas do predador e sua presa durante o complexo ciclo de vida. Até agora, as interações entre B. bacteriovorus e sua célula hospedeira têm sido estudadas principalmente por microscopia eletrônica e análise de snap-shot2,,9,,10, ambas com limitações, especialmente quando são usadas para monitorar estágios sucessivos do ciclo de vida predatório. Esses métodos fornecem imagens de alta resolução de células B. bacteriovorus e permitem a observação de um pequeno predador durante a fase de ataque ou crescimento. No entanto, eles não permitem o rastreamento de células b. bacteriovorus únicas ao longo de ambas as fases do ciclo de vida.
Apresentado aqui é um protocolo abrangente para o uso de microscopia de fluorescência de lapso de tempo (TLFM) para monitorar o ciclo de vida completo de B. bacteriovorus. Um sistema composto por uma almofada de agarose é usado em combinação com um prato de imagem celular, no qual as células predatórias podem se mover livremente sob a almofada de agarose enquanto as células de presas imobilizadas são capazes de formar bdelloplastos(Figura 2). Esta configuração é preparada com base em cepas específicas de E. coli e B. bacteriovorus,mas o protocolo pode ser facilmente alterado para se adequar às cepas individuais de um usuário (por exemplo, carregando diferentes marcadores de seleção, proteínas fundidas com fluoroforos diferentes, etc.).
Neste caso, para visualizar B. bacteriovorus durante a fase de ataque, foi construída uma cepa específica (HD100 DnaN-mNeonGreen/PilZ-mCherry) que expressa uma versão fluorescente marcada da proteína citoplasmática, PilZ (disponível em nosso laboratório mediante solicitação)7. Esta cepa também produz DNAN (o grampo β-deslizante), uma subunidade de holoenzima de dna polimerase III, fundida com uma proteína fluorescente. Isso permite que a replicação contínua do DNA seja monitorada dentro das células predatórias à medida que crescem dentro de bdelloplastos.
Embora o protocolo descrito e o software utilizado para aquisição de imagens se refira a um microscópio invertido fornecido por um fabricante específico (ver Tabela de Materiais), esta técnica pode ser ajustada para qualquer microscópio invertido equipado com uma câmara ambiental ou outro suporte de aquecimento externo e capaz de imagens de lapso de tempo. Para análise de dados, os usuários podem escolher qualquer software disponível compatível com os formatos de saída individuais.
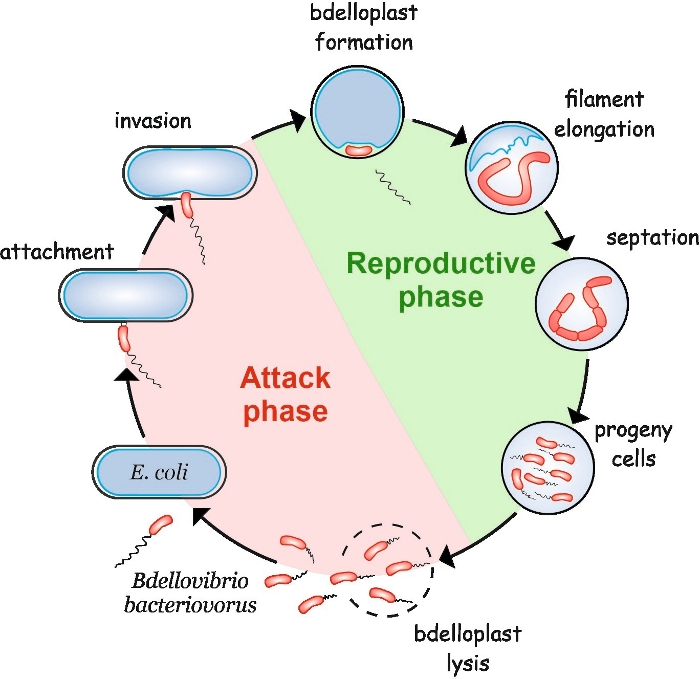
Figura 1: B. bacteriovorus ciclo de vida em E. coli como uma célula hospedeira. Durante a fase de ataque, uma célula B. bacteriovorus de natação livre procura e se conecta a uma célula E. coli hospedeira. Após a invasão, a célula predatória fica localizada no periplasma da presa, mudando a forma da célula hospedeira e formando um bdelloplasto. A fase reprodutiva começa com a formação de bdelloplast. A célula predatória digere a célula da presa e reutiliza compostos simples para construir suas próprias estruturas. B. bacteriovorus cresce como um longo filamento único dentro do periplasma do hospedeiro. Quando os recursos da célula presa estão esgotados, o filamento B. bacteriovorus sincronicamente septate e forma células descendentes. Depois que as células progêneras desenvolvem sua flagela, elas lise o bdelloplasto. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Devido ao crescente interesse em usar b. bacteriovorus como antibiótico vivo, novas ferramentas para observar o ciclo de vida predatório, particularmente interações predador-patógeno, são necessárias. O protocolo apresentado é usado para acompanhar todo o ciclo de vida B. bacteriovorus, especialmente durante seu crescimento dentro do hospedeiro, em tempo real. Além disso, a aplicação de uma cepa produzindo grampo beta fluorescente de holoenzima de DNA polimerase III permitiu o monitoramento d…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este estudo foi apoiado pelo Centro Nacional de Ciências grant Opus 2018/29/B/NZ6/00539 a J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
References
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

