Live-Cell Imaging av livssyklusen til bakteriell Predator Bdellovibrio bakteriovorus ved hjelp av Time-Lapse Fluorescence Mikroskopi
Summary
Presentert her er en protokoll som beskriver overvåking av hele livssyklusen til rovbakterien Bdellovibrio bakteriovorus ved hjelp av time-lapse fluorescens mikroskopi i kombinasjon med en agarose pad og celle-imaging retter.
Abstract
Bdellovibrio bacteriovorus er en liten gram-negativ, obligatorisk rovdyr bakterie som dreper andre gram-negative bakterier, inkludert skadelige patogener. Derfor regnes det som et levende antibiotika. For å bruke B. bakteriovorus som et levende antibiotika, er det først nødvendig å forstå de store stadiene av sin komplekse livssyklus, spesielt spredning inne i byttedyr. Så langt har det vært utfordrende å overvåke påfølgende stadier av rovlivssyklusen i sanntid. Presentert her er en omfattende protokoll for sanntidsavbildning av hele livssyklusen til B. bakteriovorus, spesielt under veksten inne i verten. For dette formålet brukes et system bestående av en agarosepute i kombinasjon med celleavbildningsretter, der rovcellene kan bevege seg fritt under agaroseputen mens immobiliserte byttedyrceller er i stand til å danne bdelloplasts. Anvendelsen av en stamme som produserer en fluorescerende merket β-underenhet av DNA polymerase III ytterligere tillater kromosom replikering som skal overvåkes under reproduksjonsfasen av B. bakteriovorus livssyklus.
Introduction
Bdellovibrio bakteriovorus er en liten (0,3–0,5 μm med 0,5–1,4 μm) gram-negativ bakterie som bytter på andre gram-negative bakterier, inkludert skadelige patogener som Klebsiella pneumoniae, Pseudomonas aeruginosa og Shigella flexneri1,2,3. Siden B. bakteriovorus dreper patogener, regnes det som et potensielt levende antibiotika som kan brukes til å bekjempe bakterielle infeksjoner, spesielt de som er forårsaket av multiresistente stammer.
B. bakteriovorus viser en særegen livssyklus bestående av to faser: en frittlevende ikke-repliktiv angrepsfase og en intracellulær reproduksjonsfase (figur 1). I frilivsfasen søker denne svært motile bakterien, som beveger seg med hastigheter på opptil 160 μm/s, etter byttet. Etter å ha festet seg til byttets ytre membran, kommer den inn i periplasma4,5. Under den interperiplasmiske reproduktive fasen bruker B. bakteriovorus en mengde hydrolytiske enzymer for å forringe vertens makromolekyler og gjenbruke dem for sin egen vekst. Kort tid etter å ha invadert periplasma, dør vertscellen og bloats inn i en sfærisk struktur kalt en bdelloplast, inne som rovcellen langstrakte og replikerer kromosomene. Replikeringsprosessen starter på replikeringsopprinnelsen (oriC)6 og fortsetter til flere kopier av kromosomet er fullstendig syntetisert7. Interessant, replikering av hvert kromosom etterfølges ikke av celledeling. I stedet forlenger rovdyret for å danne en lang, multinukleoid og filamentøs celle. Ved uttømming av næringsstoffer gjennomgår filamentet synkron septering og avkomceller frigjøres fra bdelloplast8.
Før B. bakteriovorus kan brukes som et levende antibiotika mot bakterielle infeksjoner, er det avgjørende å forstå de viktigste stadiene av livssyklusen, spesielt de som er relatert til spredning inne i byttet. Live-celle avbildning av B. bakteriovorus har vært utfordrende, på grunn av de ulike morfologiske former for rovdyret og dens byttedyr under den komplekse livssyklusen. Så langt har interaksjonene mellom B. bakteriovorus og vertscellen hovedsakelig blitt studert av elektronmikroskopi og snap-shot analyse2,9,10, som begge har begrensninger, spesielt når de brukes til å overvåke påfølgende stadier av rovlivssyklusen. Disse metodene gir høyoppløselige bilder av B. bakteriovorusceller og muliggjør observasjon av et lite rovdyr under angreps- eller vekstfasen. Imidlertid tillater de ikke sporing av enkelt B. bakteriovorusceller gjennom begge livssyklusfasene.
Presentert her er en omfattende protokoll for bruk av time-lapse fluorescens mikroskopi (TLFM) for å overvåke hele livssyklusen til B. bakteriovorus. Et system bestående av en agarose pad brukes i kombinasjon med en celle-imaging parabolen, der de rovdyrcellene kan bevege seg fritt under agarose pad mens immobiliserte byttedyr celler er i stand til å danne bdelloplasts (Figur 2). Dette oppsettet er utarbeidet basert på spesifikke stammer av både E. coli og B. bakteriovorus, men protokollen kan lett endres for å passe til en brukers individuelle stammer (f.eks. bærer forskjellige utvalgsmarkører, proteiner smeltet sammen med forskjellige fluoroforer, etc.).
I dette tilfellet, for å visualisere B. bakteriovorus under angrepsfasen, ble en bestemt stamme (HD100 DnaN-mNeonGreen / PilZ-mCherry) konstruert som uttrykker en fluorescerende merket versjon av cytoplasmatisk protein, PilZ (tilgjengelig i vårt laboratorium på forespørsel)7. Denne stammen produserer i tillegg DnaN (β-glidende klemme), en underenhet av DNA polymerase III holoenzyme, smeltet sammen med et fluorescerende protein. Dette gjør det mulig å overvåke pågående DNA-replikering inne i rovcellene etter hvert som de vokser innenfor bdelloplasts.
Selv om den beskrevne protokollen og programvaren som brukes til bildeoppkjøp refererer til et omvendt mikroskop levert av en bestemt produsent (se Materialstabell), kan denne teknikken justeres for ethvert invertert mikroskop utstyrt med et miljøkammer eller en annen ekstern varmeholder og i stand til tidsforløp. For dataanalyse kan brukerne velge hvilken som helst tilgjengelig programvare som er kompatibel med de enkelte utdataformatene.
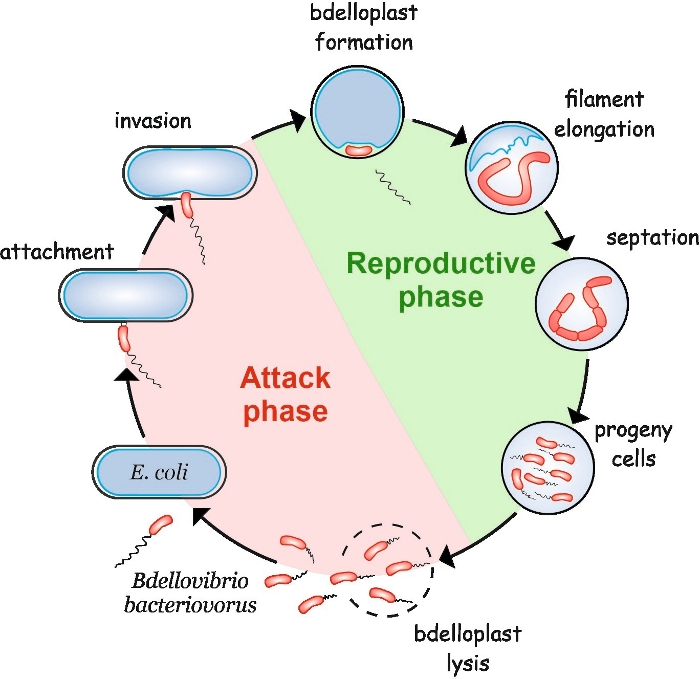
Figur 1: B. bakteriovorus livssyklus i E. coli som vertscelle. Under angrepsfasen søker en frittsvømming B. bakteriovoruscelle etter og festes til en vert E. coli-celle. Etter invasjonen blir rovcellen lokalisert i byttets periplasma, endrer vertscellens form og danner en bdelloplast. Den reproduktive fasen starter med bdelloplast dannelse. Rovcellen fordøyer byttedyrcellen og gjenbruker enkle forbindelser for å bygge sine egne strukturer. B. bakteriovorus vokser som en lang enkelt filament inne i vertens periplasma. Når byttedyrcellens ressurser er oppbrukt, er B. bakteriovorus filament synkront septater og danner avkomceller. Etter at avkomcellene utvikler sin flagella, lyser de bdelloplast. Vennligst klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
På grunn av den økte interessen for å bruke B. bakteriovorus som et levende antibiotika, er det nødvendig med nye verktøy for å observere rovlivssyklusen, spesielt rovdyr-patogeninteraksjoner. Den presenterte protokollen brukes til å spore hele B. bakteriovorus livssyklus, spesielt under veksten inne i verten, i sanntid. Videre, anvendelsen av en stamme som produserer fluorescerende merket beta klemme av DNA polymerase III holoenzyme aktivert overvåking av kromosom replikering progresjon gjennom…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne studien ble støttet av National Science Centre grant Opus 2018/29/B/NZ6/00539 til J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
References
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

