Live-Cell Imaging жизненного цикла бактериального хищника Bdellovibrio бактериоворуса с использованием Time-Lapse флуоресценции микроскопии
Summary
Здесь представлен протокол, описываемый мониторинг полного жизненного цикла хищной бактерии Bdellovibrio bacteriovorus с использованием замедленной микроскопии флуоресценции в сочетании с агарозной площадкой и клеточной визуализацией посуды.
Abstract
Bdellovibrio bacteriovorus является небольшой грамотрицательных, обязательных хищных бактерий, которая убивает другие грамотрицательных бактерий, в том числе вредных патогенов. Поэтому он считается живым антибиотиком. Чтобы применить B. bacteriovorus в качестве живого антибиотика, сначала необходимо понять основные этапы его сложного жизненного цикла, в частности его распространение внутри добычи. До сих пор было трудно контролировать последовательные этапы хищнического жизненного цикла в режиме реального времени. Здесь представлен комплексный протокол для визуализации в режиме реального времени полного жизненного цикла B. bacteriovorus,особенно во время его роста внутри хозяина. Для этого используется система, состоящая из агарозной площадки в сочетании с клеточной визуализацией посуды, в которой хищные клетки могут свободно перемещаться под агарозной площадкой, в то время как обездвиженные клетки добычи способны образовывать бделлопласты. Применение штамма, производящего флуоресцентно помеченный к югу от полимеразы ДНК III, позволяет контролировать репликацию хромосом во время фазы размножения жизненного цикла B. bacteriovorus.
Introduction
Bdellovibrio бактериоворус является небольшой (0,3-0,5 мкм на 0,5-1,4 мкм) грамотрицательная бактерия, которая охотится на другие грамотрицательных бактерий, в том числе вредных патогенов, таких как Klebsiella пневмонии, Pseudomonas aeruginosa, и Shigella flexneri1,2,3. Поскольку B. bacteriovorus убивает патогенные микроорганизмы, он считается потенциальным живым антибиотиком, который может быть применен для борьбы с бактериальными инфекциями, особенно вызванными штаммами с множественной лекарственной устойчивостью.
B. bacteriovorus демонстрирует своеобразный жизненный цикл, состоящий из двух фаз: свободной жизни не реплицативной фазы атаки и внутриклеточной репродуктивной фазы(рисунок 1). В фазе свободной жизни эта очень пестрая бактерия, которая движется со скоростью до 160 мкм/с, ищет свою добычу. Прикрепив к внешней мембране добычи, она попадает в периплазму4,,5. Во время межпериплазмической репродуктивной фазы B. bacteriovorus использует множество гидролитических ферментов для деградации макромолекул хозяина и повторного использования их для собственного роста. Вскоре после вторжения в периплазму, клетка-хозяин умирает и раздувается в сферическую структуру, называемую бделлопластом, внутри которого хищная клетка удлиняется и реплицирует свои хромосомы. Процесс репликации начинается с происхождения репликации(oriC)6 и продолжается до тех пор, пока несколько копий хромосомы не будут полностью синтезированы7. Интересно, что репликация каждой хромосомы не сопровождается делением клеток. Вместо этого хищник удлиняется, образовав длинные, многонуклеоидные и нитевидные клетки. После истощения питательных веществ, нить проходит синхронную перегородку и потомство клетки высвобождаются из bdelloplast8.
Прежде чем B. bacteriovorus может быть использован в качестве живого антибиотика против бактериальных инфекций, очень важно понять основные этапы его жизненного цикла, особенно те, которые связаны с его распространением внутри добычи. В течение сложной работы была сложная живая клеточная визуализация бактериоворуса B. из-за различных морфологических форм хищника и его добычи в течение сложного жизненного цикла. До сих пор взаимодействия между B. bacteriovorus и его клетки-хозяина были в основном изучены электронной микроскопии и оснастки выстрел анализа 2,9,10, оба из которых имеют ограничения, особенно когда они используются для мониторингапоследовательныхэтапов хищнического жизненного цикла. Эти методы обеспечивают высокое разрешение изображений клеток B. bacteriovorus и позволяют наблюдение небольшого хищника во время атаки или фазы роста. Тем не менее, они не позволяют отслеживать одиночные B. бактериоворусные клетки на протяжении обеих фаз жизненного цикла.
Здесь представлен комплексный протокол использования замедленной микроскопии флуоресценции (TLFM) для мониторинга полного жизненного цикла B. bacteriovorus. Система, состоящая из агарозы площадку используется в сочетании с клеточной визуализации блюдо, в котором хищные клетки могут свободно перемещаться под агарозой площадку в то время как обездвиженные клетки добычи способны образовывать bdelloplasts (Рисунок 2). Эта настройка подготовлена на основе конкретных штаммов кишечной палочки и B. bacteriovorus, но протокол может быть легко изменен, чтобы соответствовать индивидуальным штаммам пользователя (например, проведение различных маркеров отбора, белки, слитые с различными флюорофорами и т.д.).
В этом случае, чтобы визуализировать B. bacteriovorus во время фазы атаки, был построен специфический штамм (HD100 DnaN-mNeonGreen/Pil’-mCherry), который выражает флуоресцентно помеченную версию цитоплазмического белка, Pil’ (доступен в нашей лаборатории позапросу) 7. Этот штамм дополнительно производит DnaN (раздвижной зажим), подразделение ДНК-полимеразы III голоэнзима, слитого с флуоресцентным белком. Это позволяет контролировать текущую репликацию ДНК внутри хищных клеток по мере их роста в пределах бделлопластов.
Хотя описанный протокол и программное обеспечение, используемое для получения изображений, относятся к перевернутому микроскопу, предоставленную конкретным производителем (см. таблицу материалов),этот метод может быть скорректирован для любого перевернутого микроскопа, оснащенного экологической камерой или другим внешним держателем отопления и способного изображения замедленного действия. Для анализа данных пользователи могут выбрать любое доступное программное обеспечение, совместимое с отдельными форматами вывода.
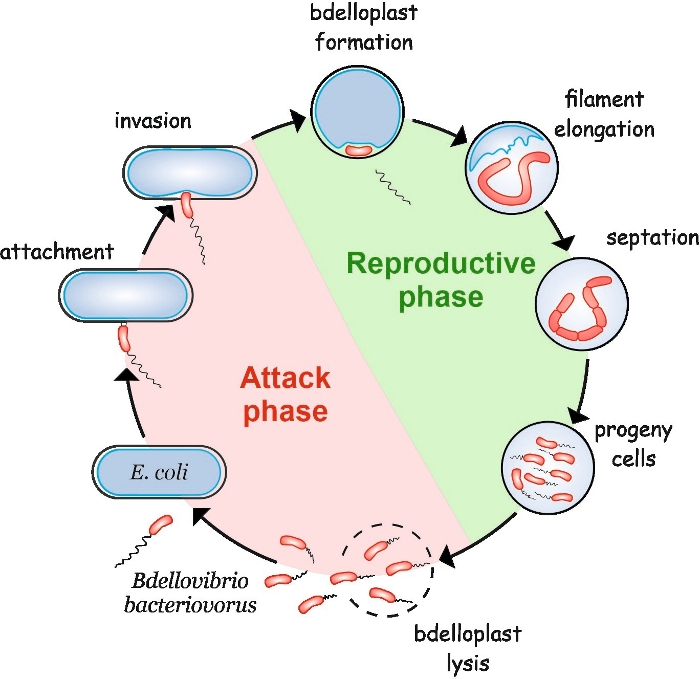
Рисунок 1: B. бактериоворусный жизненный цикл в кишечной палочке в качестве клетки-хозяина. Во время фазы атаки свободно плавающие клетки B. bacteriovorus ищут и прикрепляются к клетке кишечной палочки. После вторжения хищная клетка локализируется в периплазме жертвы, изменяя форму клетки-хозяина и образуя бделлопласт. Репродуктивная фаза начинается с образования бделлопласта. Хищная клетка переваривает клетку добычи и повторно использовать простые соединения для создания собственных структур. B. bacteriovorus растет как длинная нить внутри периплазмы хозяина. Когда ресурсы клетки добычи исчерпаны, бактериоворусная нить B. синхронно септирует и образует клетки потомства. После того, как клетки потомства развивают свою флагеллу, они высасывают бделлопласт. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Protocol
Representative Results
Discussion
В связи с повышенным интересом к использованию B. bacteriovorus в качестве живого антибиотика необходимы новые инструменты наблюдения за хищным жизненным циклом, особенно взаимодействия хищника и патогена. Представленный протокол используется для отслеживания всего жизненного цикл?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование было поддержано Грантом Национального научного центра Opus 2018/29/B/N’6/00539 в J.Q.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
References
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

