Live-Cell Imaging des Lebenszyklus des bakteriellen Raubtiers Bdellovibrio bacteriovorus mittels Time-Lapse Fluoreszenzmikroskopie
Summary
Hier wird ein Protokoll vorgestellt, das die Überwachung des gesamten Lebenszyklus des raubtierlichen Bakteriums Bdellovibrio bacteriovorus mittels Zeitrafferfluoreszenzmikroskopie in Kombination mit einem Agarosepad und zellbildenden Gerichten beschreibt.
Abstract
Bdellovibrio bacteriovorus ist ein kleines gramnegatives, obligates Raubbakterium, das andere gramnegative Bakterien abtötet, einschließlich schädlicher Krankheitserreger. Daher gilt es als ein lebendes Antibiotikum. Um B. bakteriovorus als lebendes Antibiotikum anzuwenden, ist es zunächst notwendig, die wichtigsten Stadien seines komplexen Lebenszyklus zu verstehen, insbesondere seine Proliferation in der Beute. Bisher war es schwierig, aufeinanderfolgende Phasen des raubtieren Lebenszyklus in Echtzeit zu überwachen. Präsentiert hier ist ein umfassendes Protokoll für die Echtzeit-Bildgebung des gesamten Lebenszyklus von B. bacteriovorus, vor allem während seines Wachstums innerhalb des Wirts. Dazu wird ein System aus einem Agarose-Pad in Kombination mit zellbildenden Schalen eingesetzt, bei denen sich die Raubzellen frei unter dem Agarose-Pad bewegen können, während immobilisierte Beutezellen Bdelloplasten bilden können. Die Anwendung eines Stammes, der eine fluoreszierend markierte Untereinheit der DNA-Polymerase III erzeugt, ermöglicht ferner die Überwachung der Chromosomenreplikation während der Reproduktionsphase des B. bakteriovorus Lebenszyklus.
Introduction
Bdellovibrio bacteriovorus ist ein kleines (0,3–0,5 m x 0,5–1,4 m) gramnegatives Bakterium, das andere gramnegative Bakterien, einschließlich schädlicher Krankheitserreger wie Klebsiella pneumoniae, Pseudomonas aeruginosa, und Shigella flexneri1,2,3,beutet. Da B. bacteriovorus Krankheitserreger abtötet, gilt es als ein potenzielles lebendes Antibiotikum, das zur Bekämpfung bakterieller Infektionen eingesetzt werden kann, insbesondere solche, die durch multiresistente Stämme verursacht werden.
B. bacteriovorus weist einen besonderen Lebenszyklus auf, der aus zwei Phasen besteht: einer frei lebenden nicht-replikativen Angriffsphase und einer intrazellulären Reproduktionsphase (Abbildung 1). In der Freilebphase sucht dieses hochmotile Bakterium, das sich mit Geschwindigkeiten von bis zu 160 m/s bewegt, nach seiner Beute. Nach der Befestigung an der äußeren Membran der Beute gelangt es in das Periplasma4,5. Während der interperiplasmischen Fortpflanzungsphase verwendet B. bacteriovorus eine Fülle hydrolytischer Enzyme, um die Makromoleküle des Wirts zu degradieren und für sein eigenes Wachstum wiederzuverwenden. Bald nach dem Eindringen in das Periplasma stirbt die Wirtszelle und bläht sich in eine kugelförmige Struktur namens Bdelloplast, in der sich die Raubzelle längt und ihre Chromosomen repliziert. Der Replikationsprozess beginnt am Replikationsursprung (oriC)6 und geht weiter, bis mehrere Kopien des Chromosoms vollständig synthetisiert wurden7. Interessanterweise folgt der Replikation jedes Chromosoms nicht die Zellteilung. Stattdessen erlänget sich das Raubtier zu einer langen, multinukleoiden und fadenförmigen Zelle. Bei Nährstoffmangel wird das Filament einer synchronen Septation unterzogen und Diegenzellen werden aus dem Bdelloplast8freigesetzt.
Bevor B. bacteriovorus als lebendes Antibiotikum gegen bakterielle Infektionen verwendet werden kann, ist es entscheidend, die wichtigsten Stadien seines Lebenszyklus zu verstehen, insbesondere diejenigen, die mit seiner Proliferation innerhalb der Beute zusammenhängen. Die Live-Zell-Bildgebung von B. bacteriovorus war aufgrund der verschiedenen morphologischen Formen des Raubtiers und seiner Beute während des komplexen Lebenszyklus eine Herausforderung. Bisher wurden die Wechselwirkungen zwischen B. bacteriovorus und seiner Wirtszelle hauptsächlich durch Elektronenmikroskopie und Schnappschussanalyse2,9,10untersucht, die beide Einschränkungen haben, insbesondere wenn sie verwendet werden, um aufeinanderfolgende Stadien des räuberischen Lebenszyklus zu überwachen. Diese Methoden liefern hochauflösende Bilder von B. bakteriovorus Zellen und ermöglichen die Beobachtung eines kleinen Raubtiers während der Angriffs- oder Wachstumsphase. Sie erlauben jedoch keine Verfolgung einzelner B. bakteriovorer Zellen während der beiden Lebenszyklusphasen.
Hier wird ein umfassendes Protokoll zur Verwendung der Zeitrafferfluoreszenzmikroskopie (TLFM) zur Überwachung des gesamten Lebenszyklus von B. bakteriovorusvorgestellt. Ein System, das aus einem Agarose-Pad besteht, wird in Kombination mit einer Zellbildschale verwendet, bei der sich die Raubzellen frei unter dem Agarose-Pad bewegen können, während die immobilisierten Beutezellen Inderoplasten bilden können (Abbildung 2). Diese Einrichtung wird auf der Grundlage spezifischer Stämme von E. coli und B. bacteriovoruserstellt, aber das Protokoll kann leicht an die individuellen Stämme eines Benutzers anpassen (z. B. mit verschiedenen Selektionsmarkern, Proteinen, die mit verschiedenen Fluorophoren verschmolzen sind usw.).
In diesem Fall wurde zur Visualisierung von B. bacteriovorus während der Angriffsphase ein spezifischer Stamm (HD100 DnaN-mNeonGreen/PilZ-mCherry) konstruiert, der eine fluoreszierend markierte Version des zytoplasmischen Proteins PilZ (verfügbar in unserem Labor auf Anfrage)ausdrückt 7. Dieser Stamm produziert zusätzlich DnaN (die Schiebeklemme), eine Untereinheit des DNA-Polymerase-III-Holoenzyms, die mit einem fluoreszierenden Protein verschmolzen wird. Dies ermöglicht die überwachung der kontinuierlichen DNA-Replikation innerhalb der Raubzellen, während sie innerhalb von Bdelloplasten wachsen.
Obwohl sich das beschriebene Protokoll und die für die Bildaufnahme verwendete Software auf ein invertiertes Mikroskop beziehen, das von einem bestimmten Hersteller bereitgestellt wird (siehe Tabelle der Materialien), kann diese Technik für jedes invertierte Mikroskop angepasst werden, das mit einer Umweltkammer oder einem anderen externen Heizhalter ausgestattet ist und zeitraffiver abbilden kann. Für die Datenanalyse können Benutzer jede verfügbare Software auswählen, die mit den einzelnen Ausgabeformaten kompatibel ist.
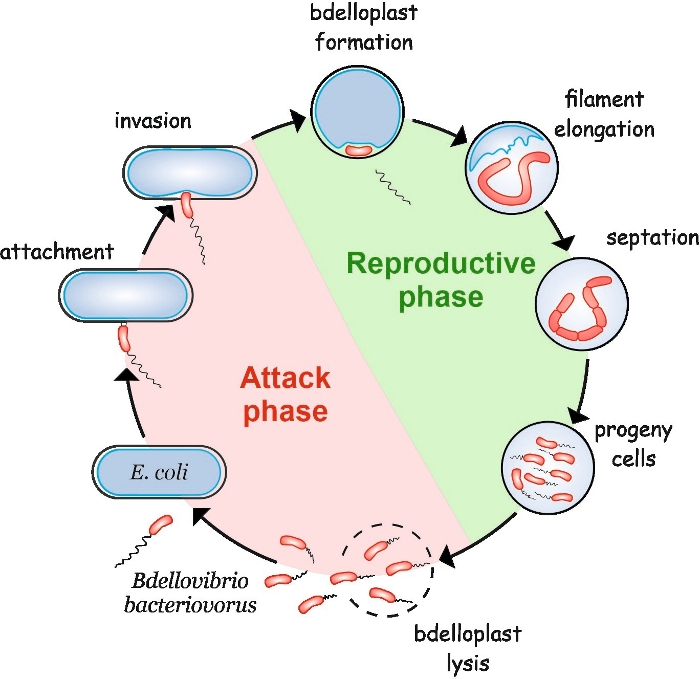
Abbildung 1: B. bakteriovorus Lebenszyklus in E. coli als Wirtszelle. Während der Angriffsphase sucht eine freischwimmende B. bakteriovore Zelle nach einer E. coli-Wirtszelle und heftet sie an. Nach der Invasion wird die Raubzelle im Periplasma der Beute lokalisiert, verändert die Form der Wirtszelle und bildet einen Bdelloplast. Die Fortpflanzungsphase beginnt mit der Bdelloplastbildung. Die Raubzelle verdaut die Beutezelle und verwendet einfache Verbindungen, um ihre eigenen Strukturen aufzubauen. B. bacteriovorus wächst als ein langes einzelnes Filament im Periplasma des Wirts. Wenn die Ressourcen der Beutezelle erschöpft sind, septiert das B. bakteriovorus Filament synchron und bildet Nachkommenzellen. Nachdem die Nachkommenzellen ihre Flagella entwickeln, lysieren sie den Bdelloplast. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Aufgrund des gestiegenen Interesses an der Verwendung von B. bacteriovorus als lebendes Antibiotikum sind neue Werkzeuge zur Beobachtung des raubtierlichen Lebenszyklus, insbesondere raubtier-pathogene Wechselwirkungen, erforderlich. Das vorgestellte Protokoll wird verwendet, um den gesamten B. bakteriovorus Lebenszyklus zu verfolgen, vor allem während seines Wachstums innerhalb des Hosts, in Echtzeit. Darüber hinaus ermöglichte die Anwendung eines Stammes, der fluoreszierend getaggte Betaklemme des …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Studie wurde vom National Science Centre Grant Opus 2018/29/B/NZ6/00539 an J.Z.C. unterstützt.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
References
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

