Live-Cell Imaging av livscykeln för bakteriell Predator Bdellovibrio bacteriovorus med hjälp av Time-Lapse Fluorescens mikroskopi
Summary
Presenteras här är ett protokoll som beskriver övervakning av den fullständiga livscykeln för underprissättning bakterie bdellovibrio bakteriovorus med hjälp av time-lapse fluorescens mikroskopi i kombination med en agaros pad och cell-imaging rätter.
Abstract
Bdellovibrio bakterienovorus är en liten gramnegativ, obligate rovgiriga bakterie som dödar andra gramnegativa bakterier, inklusive skadliga patogener. Därför anses det vara en levande antibiotika. För att applicera B. bacteriovorus som ett levande antibiotikum är det först nödvändigt att förstå de stora stadierna av dess komplexa livscykel, särskilt dess spridning inuti byte. Hittills har det varit en utmaning att övervaka successiva stadier av den rovgiriga livscykeln i realtid. Presenteras här är ett omfattande protokoll för realtidsavbildning av den kompletta livscykeln för B. bacteriovorus, särskilt under sin tillväxt inuti värden. För detta ändamål används ett system bestående av en agarospad i kombination med cellavbildningsrätter, där rovcellerna kan röra sig fritt under agarospaden medan immobiliserade bytesceller kan bilda bdelloplaster. Tillämpningen av en stam som producerar en fluorescerande taggade β-subenhet av DNA-polymeras III ytterligare tillåter kromosom replikering övervakas under reproduktionsfasen av B. bacteriovorus livscykel.
Introduction
Bdellovibrio bakteriovorus är en liten (0,3– 0,5 μm med 0,5–1,4 μm) gramnegativ bakterie som lever på andra gramnegativa bakterier, inklusive skadliga patogener som Klebsiella pneumoniae, Pseudomonas aeruginosa och Shigella flexneri1,2,3. Eftersom B. bacteriovorus dödar patogener, det anses vara en potentiell levande antibiotikum som kan tillämpas för att bekämpa bakteriella infektioner, särskilt de som orsakas av multiresistenta stammar.
B. bacteriovorus uppvisar en säregen livscykel som består av två faser: en fri-levande icke-replikiv attack fas och en intracellulär reproduktiv fas (Figur 1). I den fria levande fasen söker denna mycket motila bakterie, som rör sig med hastigheter på upp till 160 μm/s, efter sitt byte. Efter att ha fäst på bytets yttre membran kommer den in i periplasmen4,5. Under interperiplasmic reproduktiv fas, B. bacteriovorus använder en uppsjö av hydrolytiska enzymer för att försämra värdens makromolekyler och återanvända dem för sin egen tillväxt. Strax efter att ha invaderat periplasmen dör värdcellen och svällar in i en sfärisk struktur som kallas en bdelloplast, inuti vilken rovdjurscellen förlänger och replikerar sina kromosomer. Replikeringsprocessen startar vid replikeringsursprunget (oriC)6 och för fortlöper tills flera kopior av kromosomen har syntetiserats helt7. Intressant nog är replikering av varje kromosom inte följt av celldelning. Istället, rovdjuret elongates att bilda en lång, multinucleoid och fintrådiga cell. Vid näringsutarmning genomgår glödtråden synkron septation och avkommaceller frigörs från bdelloplasten8.
Innan B. bacteriovorus kan användas som en levande antibiotika mot bakteriella infektioner, är det viktigt att förstå de stora stadierna av sin livscykel, särskilt de som rör dess spridning inuti bytet. Live-cell imaging av B. bacteriovorus har varit utmanande, på grund av de olika morfologiska former av rovdjur och dess byte under den komplexa livscykeln. Hittills har interaktionerna mellan B. bacteriovorus och dess värdcell huvudsakligen studerats av elektronmikroskopi och snap-shot analys2,9,10, som båda har begränsningar, särskilt när de används för att övervaka successiva stadier av den rovgiriga livscykeln. Dessa metoder ger högupplösta bilder av B. bacteriovorus celler och möjliggöra observation av en liten rovdjur under attacken eller tillväxtfasen. De tillåter dock inte spårning av enstaka B. bacteriovorus celler under båda livscykelfaserna.
Presenteras här är ett omfattande protokoll för att använda time-lapse fluorescens mikroskopi (TLFM) för att övervaka den kompletta livscykeln för B. bacteriovorus. Ett system bestående av en agarospad används i kombination med en cell-avbildningsskål, där rovcellerna kan röra sig fritt under agarospaden medan de immobiliserade bytescellerna kan bilda bdelloplaster (Figur 2). Denna uppbyggnad är förberedd utifrån specifika stammar av både E. coli och B. bacteriovorus, men protokollet kan lätt ändras för att passa en användares individuella stammar (t.ex. bär olika selektion markörer, proteiner smält med olika fluoroforer, etc.).
I detta fall, att visualisera B. bacteriovorus under attacken fasen, en specifik stam (HD100 DnaN-mNeonGreen/PilZ-mCherry) konstruerades som uttrycker en fluorescerande taggade version av cytoplasmatiskt protein, PilZ (finns i vårt laboratorium på begäran)7. Detta anstränger dessutom jordbruksprodukter DnaN (denskjutna klämman för β-glidning), en subunit av DNA-polymerase III holoenzym, fixerat med ett fluorescerande protein. Detta gör det möjligt för pågående DNA-replikering att övervakas inuti de rovgiriga cellerna när de växer inom bdelloplaster.
Även om det beskrivna protokollet och programvara som används för bildanskaffning avser ett inverterat mikroskop som tillhandahålls av en specifik tillverkare (se Table of Materials), kan denna teknik justeras för alla inverterade mikroskop utrustad med en miljökammare eller annan extern värme hållare och kan time-lapse imaging. För dataanalys kan användare välja all tillgänglig programvara som är kompatibel med de enskilda utdataformaten.
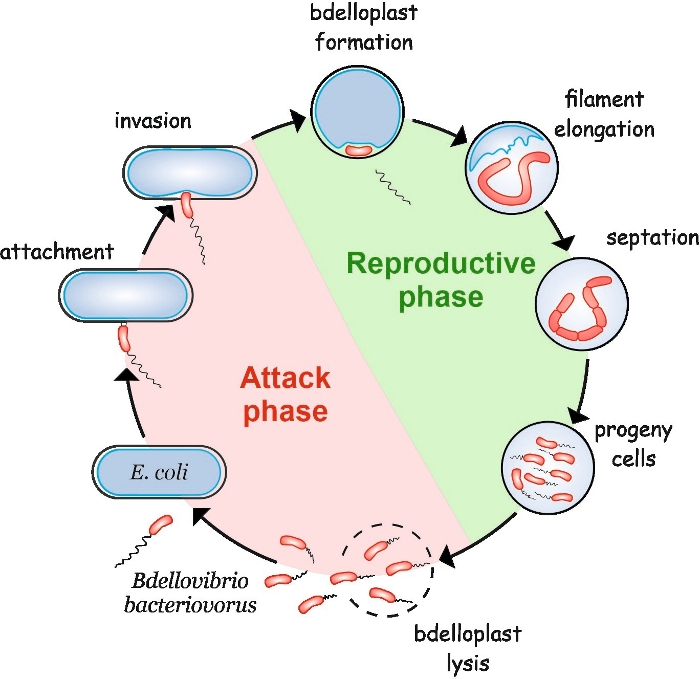
Figur 1: B. bacteriovorus livscykel i E. coli som värdcell. Under attackfasen söker en fritt simmande B. bacteriovoruscell efter och fäster vid en värd E. coli-cell. Efter invasionen blir rovdjurscellen lokaliserad i bytets periplasm, vilket ändrar värdcellens form och bildar en bdelloplast. Reproduktionsfasen börjar med bdelloplastbildning. Rovcellen smälter bytescellen och återanvänder enkla föreningar för att bygga sina egna strukturer. B. bacteriovorus växer som en lång enda glödtråd inuti värdens periplasm. När bytescellens resurser är uttömda, septaterar och bildar B. bacteriovorusfilament och bildar avkommaceller. Efter avkomman celler utveckla sin flagella, de lyse bdelloplast. Vänligen klicka här för att visa en större version av denna figur.
Protocol
Representative Results
Discussion
På grund av det ökade intresset för att använda B. bacteriovorus som ett levande antibiotikum behövs nya verktyg för att observera den rovlevande livscykeln, särskilt rovdjurspatogenaktioner. Det presenterade protokollet används för att spåra hela B. bacteriovorus livscykel, särskilt under sin tillväxt inuti värden, i realtid. Dessutom tillämpning av en stam som producerar fluorescerande taggade beta klämma av DNA polymeras III holoenzym aktiverat övervakning av kromosom replikering prog…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denna studie stöddes av National Science Centre grant Opus 2018/29/B/NZ6/00539 till J.Z.C.
Materials
| Centrifuge | MPW MED. INSTRUMENTS | MPW-260R | Rotor ref. 12183 |
| CertifiedMolecular Biology Agarose | BIO-RAD | 161-3100 | low fluorescence agarose for agarose pad |
| Fiji | ImageJ | https://imagej.net/Fiji | Open source image processing package |
| Glass Bottom Dish 35 mm | ibidi | 81218-200 | uncoated glass |
| Microscope | GE | DeltaVision Elite | Microtiter Stage, ultimate focus laser module, DV Elite CoolSnap HQ2 Camera, SSI assembly FP DV, kit obj. Oly 100x oil 1.4 NA, prism Nomarski 100x LWD DIC, ENV ctrl IX71 uTiter opaQ 240 V |
| Minisart Filter 0.45 µm | Sartorius | 16555———-K | Cellulose Acetate, Sterile, Luer Lock Outlet |
| Start SoftWoRx | GE | Manufacturer-supplied imaging software |
References
- Shatzkes, K., et al. Predatory Bacteria Attenuate Klebsiella pneumoniae Burden in Rat Lungs. mBio. 7 (6), (2016).
- Iebba, V., et al. Bdellovibrio bacteriovorus directly attacks Pseudomonas aeruginosa and Staphylococcus aureus Cystic fibrosis isolates. Frontiers in Microbiology. 5, (2014).
- Willis, A. R., et al. Injections of Predatory Bacteria Work Alongside Host Immune Cells to Treat Shigella Infection in Zebrafish Larvae. Current biology: CB. 26 (24), 3343-3351 (2016).
- Lambert, C., et al. Characterizing the flagellar filament and the role of motility in bacterial prey-penetration by Bdellovibrio bacteriovorus. Molecular Microbiology. 60 (2), 274-286 (2006).
- Lambert, C., et al. A Predatory Patchwork: Membrane and Surface Structures of Bdellovibrio bacteriovorus. Advances in Microbial Physiology. 54, 313-361 (2008).
- Makowski, &. #. 3. 2. 1. ;., et al. Initiation of Chromosomal Replication in Predatory Bacterium Bdellovibrio bacteriovorus. Frontiers in Microbiology. 7, 1898 (2016).
- Makowski, &. #. 3. 2. 1. ;., et al. Dynamics of Chromosome Replication and Its Relationship to Predatory Attack Lifestyles in Bdellovibrio bacteriovorus. Applied and Environmental Microbiology. 85 (14), (2019).
- Fenton, A. K., Kanna, M., Woods, R. D., Aizawa, S. I., Sockett, R. E. Shadowing the actions of a predator: backlit fluorescent microscopy reveals synchronous nonbinary septation of predatory Bdellovibrio inside prey and exit through discrete bdelloplast pores. Journal of Bacteriology. 192 (24), 6329-6335 (2010).
- Kuru, E., et al. Fluorescent D-amino-acids reveal bi-cellular cell wall modifications important for Bdellovibrio bacteriovorus predation. Nature Microbiology. 2 (12), 1648-1657 (2017).
- Dashiff, A., Junka, R. A., Libera, M., Kadouri, D. E. Predation of human pathogens by the predatory bacteria Micavibrio aeruginosavorus and Bdellovibrio bacteriovorus. Journal of Applied Microbiology. 110 (2), 431-444 (2011).

