Propagação do Parasita Microsporidiano Edhazardia aedis em Mosquitos Aedes aegypti
Summary
Um protocolo para cultivar o parasita microsporíduo Edhazardia aedis. O parasita é passagem de uma geração de mosquitos Aedes aegypti para a próxima via transferência horizontal na fase larval seguida de transmissão vertical na fase adulta. Os sporoplasmos vivos sobrevivem a longo prazo em ovos infectados.
Abstract
Edhazardia aedis é um parasita microsporíduo dos mosquitos Aedes aegypti, um vetor da doença que transmite múltiplas arboviroses que causam milhões de casos da doença a cada ano. E. aedis causa mortalidade e redução da aptidão reprodutiva no vetor do mosquito e tem sido explorada por seu potencial como agente de biocontrole. O protocolo que apresentamos para a realização de E. aedis baseia-se em seu ciclo de infecção natural, que envolve transmissão horizontal e vertical em diferentes estágios de vida do hospedeiro do mosquito. Mosquitos Ae. aegypti são expostos a esporos no estágio larval. Essas larvas infectadas então amadurecem em adultos e transmitem o parasita verticalmente para seus descendentes. Os descendentes infectados são então usados como fonte de esporos para futura transmissão horizontal. A culização de E. aedis pode ser desafiadora para os não iniciados dadas as complexidades do ciclo de vida do parasita, e este protocolo fornece orientação detalhada e auxiliares visuais para esclarecimento.
Introduction
O Aedes aegypti é o vetor do mosquito de múltiplas arboviroses (por exemplo, dengue, Zika, febre amarela) que, juntas, são estimadas para contabilizar centenas de milhões de casos da doença a cada ano e mais de 30.000 mortes1,2. O tratamento para doenças causadas por esses patógenos limita-se ao cuidado de suporte e é provável que outras arboviroses surjam no futuro3. O controle do mosquito vetor é, portanto, de importância primária, pois efetivamente impede a transmissão de patógenos atuais e emergentes4. Tradicionalmente, as estratégias de controle vetorial utilizam principalmente inseticidas químicos, mas a resistência a muitos inseticidas comumente usados tem impulsionado a demanda por novos métodos de controle vetorial. Um agente potencial que tem sido explorado por suas propriedades de biocontrole contra a Ae. aegypti é o parasita Edhazardia aedis5,6.
E. aedis, identificado pela primeira vez como Nosema aedis por Kudo em 1930, é um parasita microsporíduo dos mosquitos Ae. aegypti 7. O desenvolvimento e a reprodução de E. aedis é relativamente complexo e seu ciclo de vida pode prosseguir de múltiplas maneiras7,8,9. Um ciclo de desenvolvimento comum é descrito em profundidade em Becnel et al., 19897 e é utilizado para propagação laboratorial (Figura 1)8. Resumidamente, o ciclo começa quando os ovos Ae. aegypti infectados verticalmente com E. aedis eclodem em larvas infectadas que desenvolvem esporos uninucleados no corpo de gordura, e geralmente morrem como larvas ou pupas. Esporos uninucleados liberados de larvas mortas contaminam o habitat e são ingeridos por larvas saudáveis de Ae. aegypti. Esses esporos germinam principalmente no trato digestivo, infectando tecido digestivo das larvas expostas, resultando em transmissão horizontal. Larvas infectadas horizontalmente se desenvolvem em adultos (geração parental) onde esporos binucleados são formados. No feminino, esses esporos binucleados invadem o trato reprodutivo e seu esporoplasma associado infecta células óvulos em desenvolvimento. Esses ovos então eclodem em larvas infectadas (geração filial), resultando em transmissão vertical do parasita e continuação do ciclo conforme descrito acima.
Vários estudos investigaram o potencial de E. aedis para biocontrole. A infecção por E. aedis tem sido demonstrada para resultar na diminuição da capacidade reprodutiva das fêmeas Ae. aegypti 10. Além disso, em um experimento semi-campo, a liberação inundativa de E. aedis resultou na erradicação total de um teste da população de Ae. aegypti mantida dentro de um recinto telado6. Embora seja capaz de submeter-se a algumas etapas de desenvolvimento em um conjunto diversificado de espécies de mosquitos, o E. aedis é transmitido verticalmente apenas verticalmente no Ae. aegypti,indicando um alto grau de especificidade hospedeira11,12. Da mesma forma, em uma avaliação laboratorial do potencial risco ambiental associado ao E. aedis, o parasita microsporíduo não conseguiu infectar fauna aquática não-alvo, incluindo predadores que ingeriram larvas de Ae. aegypti infectadas com E. aedis13. Esses resultados destacam o potencial para que o E. aedis seja utilizado em estratégias de controle biológico voltadas para populações naturais de Ae. aegypti.
Apesar do fato de que e. aedis mostra promessa de uso no controle de vetores, há desafios para culminar e implantá-lo em larga escala. E. os esporos de aedis perdem a infectividade em menos de um dia a temperaturas frias (ou seja, 5 °C). Mesmo com temperaturas mais quentes (ou seja, 25 °C), os esporos rapidamente perdem a infectividade ao longo de três semanas14. Além disso, o E. aedis deve ser cultivado em mosquitos Ae. aegypti vivos e a dosagem controlada de mosquitos larvais saudáveis é necessária para garantir a conclusão do ciclo de vida e evitar o colapso da população utilizada para a cultura8. A exigência de cultivo in vivo apresenta um desafio; no entanto, os recentes avanços na criação de massa de mosquitos e robótica (por exemplo, Massaro et al.15) poderiam permitir a geração em larga escala de esporos de E. aedis. Prevemos que a visualização dessa metodologia aumentará a acessibilidade ao protocolo de criação do E. aedis e permitirá que mais pesquisadores investiguem a biologia básica e o potencial aplicado desse sistema. Também antecipamos que facilitará o aumento das colaborações com engenheiros, roboticistas e o setor de tecnologia mais amplo, o que pode servir para melhorar a criação em massa do E. aedis.
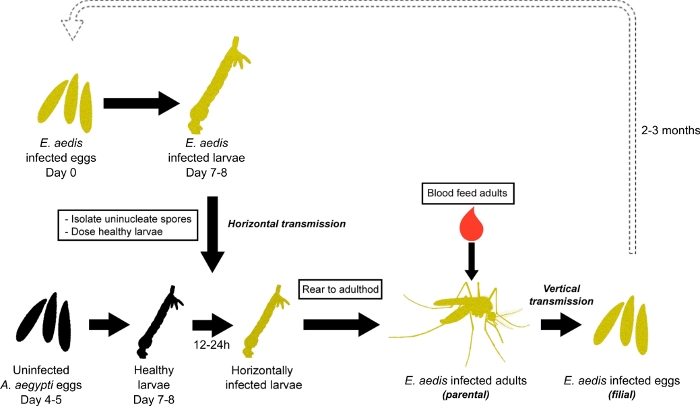
Figura 1: Propagação de E. aedis em Ae. aegypti. A propagação de E. aedis começa com a eclosão de ovos infectados por E. aedis. Larvas infectadas são criadas até 4º instar, esporos de Aedis são isolados dessas larvas, e os esporos são usados para infectar oralmente 2nd/3rd instar larvas criadas a partir de uma embreagem não infectada de ovos (transmissão horizontal). Essas larvas infectadas oralmente são então criadas até a idade adulta (geração parental) e colocam ovos infectados com E. aedis (transmissão vertical). Os ovos infectados (geração filial) são então eclodidos para continuar o ciclo de infecção e a cultura dos parasitas. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Apresentamos aqui o método originalmente descrito em Hembree e Ryan, 19828 para a criação de microsporidia E. aedis em mosquitos Ae. aegypti. A cepa de E. aedis utilizada neste estudo foi derivada da coleção de campo original de Stephen Hembree na Tailândia em 197919. O método capitaliza a transmissão horizontal, que ocorre naturalmente no ciclo de transmissão de E. aedis7, para propagar o parasita de forma controlada. Este método pode ser desafiador para os recém-chegados que não estão familiarizados com a aparência de esporos, sintomas de infecção em larvas ou a coordenação necessária para completar com sucesso o protocolo de criação/dosagem em vários estágios. Nossa esperança é que os auxílios visuais que acompanham esse protocolo reduzam as barreiras à entrada de pesquisadores que desejam cultivar e. aedis.
Propagamos E. aedis em Ae. aegypti como descrito acima e quantificamos o sucesso do parasitismo na geração filial. Resumidamente, eclodimos ovos Ae. aegypti infectados, criamos-os para a4ª instar, e coletamos esporos uninucleados E. aedis das larvas infectadas. Em seguida, infectamos horizontalmente larvas saudáveis com esses esporos através da ingestão oral, e criamos as larvas infectadas horizontalmente até a idade adulta. Alimentamos os adultos infectados (geração parental) e coletamos ovos (geração filial), que supumos que seriam verticalmente infectados com o parasita E. aedis. Eclodimos ovos da geração filial e coletamos e homogeneizamos um subconjunto das larvas quando eram 4estrelas. Quantificamos a porcentagem de larvas infectadas com E. aedis e a contagem total de esporos em todos os indivíduos infectados. Descobrimos que a grande maioria (96%) dos indivíduos foram infectados e a carga média de esporos de larvas infectadas foi ~105. Concluímos que nosso protocolo de criação resultou em uma propagação altamente bem sucedida do E. aedis em mosquitos Ae. aegypti.
Existem vários aspectos deste protocolo que podem ser particularmente desafiadores para o usuário não iniciado. Oferecemos abaixo algumas informações adicionais que podem ser de assistência. Para dúvidas sobre a criação geral do mosquito, um guia completo para a manutenção da colônia Ae. aegypti está além do escopo deste protocolo. No entanto, muitas questões comuns podem ser abordadas por recursos do Repositório de Recursos de Pesquisa de Biodefesa e Infecções Emergentes16,17, incluindo eclosão de ovos, necessidades alimentares gerais, condições habitacionais e ambientais e alimentação sanguínea. Em relação à linha do tempo da infecção, as larvas eclodidas a partir de ovos infectados não apresentam sinais de infecção até o final do4º estágio instar. Esporos uninucleados aparecem rapidamente, ao longo de 1-2 dias. Larvas podem parecer virtualmente não infectadas aos 6 dias após a eclosão, mas altamente infectadas até o dia 7 ou 8 pós-eclosão. Além disso, pode ser desafiador visualizar esporos em amostras homogeneizadas porque existem muitos outros micróbios presentes em homogeneizados de mosquitos inteiros, incluindo outros organismos eucarióticos unicelulares (por exemplo, levedura) de tamanho semelhante ao dos esporos uninucleados E. aedis. A forma distinta dos esporos de E. aedis (Figura 2A) é um método altamente confiável para identificação e ajudará a diferenciar e. aedis de outros micróbios na homogeneização. Embora não seja necessário para identificação ou quantificação, se a purificação do esporo for desejada, ela pode ser alcançada através da centrifugação gradiente de densidade de sílica coloidal que permitirá a separação dos esporos de E. aedis de outros elementos contaminantes no homogene. Este processo é descrito em detalhes em Solter et al.20.
A temperatura e a dieta utilizadas nas práticas de criação geralmente diferem entre laboratórios, mas as variações provavelmente ainda produzirão uma propagação de parasitas bem sucedida. Pequenas diferenças no tipo de alimentos larvais não interferem com a infecção bem sucedida, embora não tenhamos testado explicitamente diferentes tipos de alimentos neste protocolo. O efeito da temperatura sobre a infecção foi testado e a infecção por E. aedis foi encontrada robusta a uma ampla faixa de temperaturas21. A produção máxima de esporos ocorreu a 30,8 °C, mas ainda era robusta na criação de temperaturas tão baixas quanto 20 °C. A contagem de esporos foi reduzida drasticamente em temperaturas de criação mais altas (36 °C), portanto essas temperaturas devem ser evitadas para este protocolo.
A contaminação é sempre uma preocupação quando se trabalha com parasitas. E. aedis é um parasita bem sucedido do Ae. aegypti e, portanto, deve ser mantido separado de colônias laboratoriais não infectadas para evitar contaminação. Recomendamos o armazenamento de mosquitos infectados em uma incubadora separada, se possível. Também recomendamos que os materiais utilizados para o trabalho de microsporidia (por exemplo, bandejas larvais, tubos de transferência, gaiolas, copos de coleta de ovos) sejam designados para trabalhos de microsporidia e não utilizados de forma mais ampla em todo o inseticário. Todos os materiais de criação devem ser esterilizados com alvejante de 10% após o uso e autoclaving pode ser usado para complementar a esterilização alvejante.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Spencer Blankenship pela ajuda na criação de mosquitos. Agradecemos também a James N. Radl e M. Dominique Magistrado pelo feedback útil sobre o manuscrito.
Materials
| 120 mL Specimen cup | McKesson | 911759 | Inexpensive alternative to beaker |
| 150 mL beakers | VWR | 10754-950 | For larval dosing |
| 2 oz round glass bottle | VWR | 10862-502 | Bottle for 10% sucrose in adult cages |
| 3 oz. emergence cup | Henry-Schein | 1201502 | For transfer of pupae to cage |
| Adult mosquito cages | Bioquip | 1462 or 1450ASV | For adult housing |
| Autoclave | For sterilization | ||
| Bleach | For sterilization | ||
| Brewer’s yeast | Solgar | For feeding larvae during dosing | |
| Controlled rearing chamber | Tritech | DT2-MP-47L | Inexpensive small rearing chamber |
| Cotton roll | VWR | 470161-446 | Wick for sugar bottles |
| Defibrinated rabbit blood | Fisher | 50863762 | For blood feeding adults |
| Disodium ATP, crystalline | Sigma-Aldrich | A26209-5G | For blood feeding adults |
| Dry cat food | 9Lives | Indoor Complete | For general larval rearing |
| Fish food flakes | TetraMin | For general larval rearing | |
| Hemocytometer | Fisher | 267110 | For counting spores |
| Homogenizer/mixer motor | VWR | 47747-370 | For homogenizing infected larvae |
| Larval rearing trays | Sterillite | 1961 | Overall dimensions are 11" x 6 5/8" x 2 3/4" |
| Liver powder | NOW foods | 2450 | For feeding larvae during dosing |
| Pipette 1 – 10µL | VWR | 89079-962 | For larval dosing |
| Pipette 100 – 1000µL | VWR | 89079-974 | For food during larval dosing |
| Pipette tips 1 – 10µL | VWR | 10017-042 | For larval dosing |
| Pipette tips 100 – 1000µL | VWR | 10017-048 | For food during larval dosing |
| Plastic pestles | VWR | 89093-446 | For homogenizing infected larvae |
| Sucrose, crystalline | Life Technologies | 15503022 | For adult feeding |
| Transfer pipet | VWR | 414004-033 | For larval transfer, must trim ends |
References
- Yellow fever. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/yellow-fever (2019)
- Dengue and severe dengue. World Health Organization Available from: https://www.who.int/en/news-room/fact-sheets/detail/dengue-and-severe-dengue (2020)
- Weaver, S. C. Prediction and prevention of urban arbovirus epidemics : A challenge for the global virology community. Antiviral Research. 156, 80-84 (2018).
- Rather, I. A., Parray, H. A., Lone, J. B., Paek, W. K., Lim, J., Bajpai, V. K., Park, Y. H. Prevention and Control Strategies to Counter Dengue Virus Infection. Frontiers In Cellular and Infection Microbiology. 7, 336 (2017).
- Becnel, J. J. Edhazardia aedis (Microsporidia: Amblysporidae) as a biocontrol agent of Aedes aegypti (Diptera: Culicidae). Proceedings and abstracts, Vth International Colloquium on Invertebrate Pathology and Microbial Control. , 20-24 (1990).
- Becnel, J. J., Johnson, M. A. Impact of Edhazardia aedis (Microsporidia: Culicosporidae) on a seminatural population of Aedes aegypti (Diptera: Culicidae). Biological Control. 18 (1), 39-48 (2000).
- Becnel, J. J., Sprague, V., Fukuda, T., Hazard, E. I. Development of Edhazardia aedis (Kudo, 1930) N. G., N. Comb. (Microsporida: Amblyosporidae) in the mosquito Aedes aegypti (L.) (Diptera: Culicidae). Journal of Protozoology. 36, 119-130 (1989).
- Hembree, S. C., Ryan, J. R. Observations on the vertical transmission of a new microsporidian pathogen of Aedes aegypti from Thailand. Mosquito News. 42, 49-54 (1982).
- Johnson, M. A., Becnel, J. J., Undeen, A. H. A new sporulation sequence in Edhazardia aedis (Microsporidia: Culicosporidae), a parasite of the mosquito Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 70 (1), 69-75 (1997).
- Becnel, J. J., Garcia, J. J., Johnson, M. A. Edhazardia aedis (Microspora: Culicosporidae) effects on the reproductive capacity of Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 32 (4), 549-553 (1995).
- Becnel, J. J., Johnson, M. A. Mosquito host range and specificity of Edhazardia aedis (Microspora: Culicosporidae). Journal of the American Mosquito Control Association. 9 (3), 269-274 (1993).
- Andreadis, T. G. Host range tests with Edhazardia aedis (Microsporida: Culicosporidae) against northern Nearctic mosquitoes. Journal of Invertebrate Pathology. 64 (1), 46-51 (1994).
- Becnel, J. J. Safety of Edhazardia aedis (Microspora: Amblyosporidae) for nontarget aquatic organisms. Journal of the American Mosquito Control Association. 8 (3), 256-260 (1992).
- Undeen, A. H., Becnel, J. J. Longevity and germination of Edhazardia aedis (Microspora: Amblyosporidae) spores. Biocontrol Science and Technology. 2, 247-256 (1992).
- Massaro, P., Sobecki, R., Behling, C., Criswell, V., Zha, T., Devenzengo, R. T. Automated mass rearing system for insect larvae. , (2018).
- Methods in Aedes Research. BEI Resources Available from: https://www.beiresources.org/Portals/2/VectorResources/Methods_20in_20Aedes_20Research_202016.pdf (2016)
- Methods in Anopheles Research. BEI Resources Available from: https://www.beiresources.org/portals/2/MR4/MR4_Publications/Methods_20in_20Anopheles_20Research_202014/2014MethodsinAnophelesResearchManualFullVersionv2tso.pdf (2014)
- Desjardins, C. A., et al. Contrasting host-pathogen interactions and genome evolution in two generalist and specialist microsporidian pathogens of mosquitoes. Nature Communications. 6 (1), 1-12 (2015).
- Hembree, S. C. Preliminary Report of some mosquito pathogens from Thailand. Mosquito News. 39 (3), 575-582 (1979).
- Solter, L. F., Becnel, J. J., Vávra, J. Research methods for entomopathogenic microsporidia and other protists. Manual of Techniques in Invertebrate Pathology. , 329-371 (2012).
- Becnel, J. J., Undeen, A. H. Influence of temperature on developmental parameters of the parasite/host System Edhazardia aedis (Microsporidia: Amblyosporidae) and Aedes aegypti (Diptera: Culicidae). Journal of Invertebrate Pathology. 60, 299-303 (1992).

