נחישות מהירה של זיקה נוגדנים אנטיגן על ידי פוטומטריה המונית
Summary
אנו מתארים גישה של מולקולה אחת למדידות זיקה לאנטיגן-נוגדנים באמצעות פוטומטריה המונית (MP). הפרוטוקול מבוסס MP הוא מהיר, מדויק, משתמש בכמות קטנה מאוד של חומר, ואינו דורש שינוי חלבון.
Abstract
מדידות של הספציפיות והזיקה של אינטראקציות נוגדנים אנטיגן חשובים ביותר עבור יישומים רפואיים ומחקריים. בפרוטוקול זה, אנו מתארים את היישום של טכניקה חדשה של מולקולה אחת, פוטומטריה המונית (MP), למטרה זו. MP היא טכניקה נטולת תוויות ואי-תנועה המזהה ומכומתת מסות מולקולריות ואוכלוסיות של נוגדנים ותסביך נוגדנים ברמת מולקולה אחת. MP מנתח את דגימת האנטיגן-נוגדן בתוך דקות, ומאפשר קביעה מדויקת של הזיקה מחייבת בו זמנית מתן מידע על stoichiometry ואת המצב האוליגומרי של החלבונים. זוהי טכניקה פשוטה וישירה הדורשת רק כמויות picomole של חלבון ולא מתכלים יקרים. אותו הליך יכול לשמש לחקר חלבון חלבון מחייב חלבונים עם מסה מולקולרית גדולה מ 50 kDa. עבור אינטראקציות חלבון רב-לשוניות, ניתן להשיג את הזיקה של אתרי קשירה מרובים במדידה אחת. עם זאת, מצב המדידה של מולקולה אחת וחוסר התיוג כופה כמה מגבלות ניסיוניות. שיטה זו נותנת את התוצאות הטובות ביותר כאשר מוחל על מדידות של זיקה אינטראקציה תת מיקרומולרית, אנטיגנים עם מסה מולקולרית של 20 kDa או יותר, דגימות חלבון טהור יחסית. כמו כן, אנו מתארים את ההליך לביצוע שלבי ההתאמה והחישוב הנדרשים באמצעות תוכנה בסיסית לניתוח נתונים.
Introduction
נוגדנים הפכו לכלים בכל מקום של ביולוגיה מולקולרית והם משמשים בהרחבה הן ביישומים רפואיים והן ביישומים מחקריים. ברפואה, הם חשובים ביותר באבחון, אבל היישומים הטיפוליים שלהם מתרחבים גם טיפולים מבוססי נוגדנים חדשיםמפותחים כל הזמן 1,2,3,4. היישומים המדעיים של נוגדנים כוללים טכניקות מעבדה חיוניות רבות כגון immunofluorescence5, immunoprecipitation6, ציטומטריהזרימה 7, ELISA, ו סופג מערבי. עבור כל אחד מיישומים אלה, השגת מדידות מדויקות של תכונות מחייבות של הנוגדן, כולל זיקה מחייבת וספניות, היא בעלת חשיבות מכרעת.
מאז הוצג המכשיר המסחרי הראשון תהודה פלסמון (SPR) בשנת 1990, biosensors אופטי הפכו “תקן הזהב” של אפיון נוגדנים, אבל טכניקות אחרות, כולל ELISA, משמשים גם באופן שגרתי למדידת זיקהנוגדנים 8,9. שיטות אלה דורשות בדרך כלל קיבוע או תיוג של המולקולות המנותחות, אשר עלולות להשפיע על האינטראקציה של עניין. הם גם איטיים יחסית, מעורבים שלבי בדיקה מרובים לפני שניתן יהיה לאסוף את התוצאות לניתוח נתונים. שיטה שפותחה לאחרונה מולקולה אחת, פוטומטריה המונית (MP), מזהה מולקולות ישירות בת פתרון כאשר הם נוחתים על פני השטח של המיקרוסקופ מכסה אתהנקודה 10,11. הזיהוי האופטי מבוסס פיזור האור שחבר הפרלמנט משתמש בו אינו דורש תיוג או שינוי של חלבונים. מולקולות חלבון בודדות מתועדות על ידי מיקרוסקופ פיזור אינטרפרומטריכתמים כהיםהמופיעים בתמונה ( איור 1D ), וכמה אלפי מולקולות ניתן לזהות במהלך רכישת נתונים שלדקה אחת 12. האות שנוצר על-ידי כל חלקיק בודד מכומת, וערך החדות שלו (חשכה יחסית) מחושב. ערכי הניגוד האינטרפרומטרי פרופורציונליים להמונים המולקולריים של החלבונים, המאפשרים זיהוי של מינים קשורים וחופשיים בתערובת נוגדני האנטיגן. במקביל, על ידי ספירת אירועי נחיתה מולקולרית, חבר הפרלמנט מודד ישירות את אוכלוסיות המינים. הדבר מעניק לשיטות מבוססות MP יכולת ייחודית לכמת באופן עצמאי זיקה לאתרי איגוד מרובים.
קשירה של מולקולותאנטיגן( Ag ) לשני אתרי קשירה של הנוגדןשלם( Ab ) ניתן לתאר כ: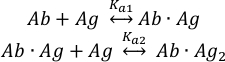
עם קבועי שיוך שיווי המשקל K a1ו- Ka2 המוגדרים כ: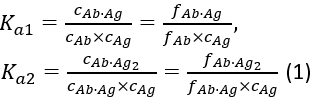
כאשר ci ו- f אני מייצג ריכוז ושבר של הרכיב i, בהתאמה. ריכוז אנטיגן הכולל (cAg)טוט יכול לבוא לידי ביטוי כ: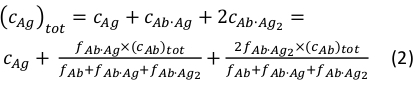
מאז הריכוזים הכוללים שלהנוגדן( cAb)טוט ואנטיגן (cAg)טוט ידועים, משוואה זו יכולה לשמש כדי להתאים ישירות את שברי הרכיב הניסיוני המתקבלים ממדידות MP ולחשב את קבועי שיוך שיווי המשקל K A1 ו- Ka2 (ראה מידע משלים).
ניתן להשתמש גם בנתונים של MP כדי להעריך שיתוף פעולה בין שני אתרי איגוד הנוגדנים11. עבור שני משטחי נוגדנים עם קבועי קשירה מיקרוסקופיים זהים, הגורמים הסטטיסטיים המתארים את תהליך האוכלוסייה של Ab· אג ואב· קומפלקסים Ag2 מכתיבים כי קבועי שיווי המשקל המקרוסקופיים לכאורה Ka1 ו- Ka2 לא יהיו שווים מבחינה מספרית, ו- Ka1 = 4Ka2. לכן, הערכים הניסיוניים של Ka1 < 4Ka2 מצביעים על שיתוף פעולה חיובי בין שני אתרי איגוד הנוגדנים. באופן דומה, Ka1 > 4K a2מציין שיתוף פעולה שלילי.
מדידות MP של זיקה מחייב נוגדן אנטיגן הם מהירים ודורשים כמות קטנה של חומר. ההתפלגויות ההמוניות של MP המשמשות לחישובים קבועים של שיווי משקל מספקות מידע נוסף אודות מאפייני המדגם ומאפשרות הערכה של טוהר המדגם, אוליגומריזציה וצבירה בניסוי יחיד. ניתן להשתמש באותה שיטה כדי למדוד זיקה גבוהה חלבון חלבון מחייב, ו MP הוא שימושי במיוחד עבור מחקרים של אינטראקציות חלבון רב ואלנט. קומפלקסים מרובי חלבונים בדרך כלל יש מסות מולקולריות גדולות, אופטימלי לגילוי MP, ונתונים מולקולה אחת ניתן להשתמש כדי למדוד stoichiometry ולחשב זיקה של אתרי קשירה מרובים בו זמנית. בדרך כלל קשה להשיג מידע זה בשיטות המבוססות בצובר.
ללא שינויים, הפרוטוקול הנוכחי מתאים למדידות של זיקה גבוהה יחסית, אינטראקציות תת מיקרומולריות עם אנטיגנים של מסה מולקולרית של 20 kDa ומעלה. לקבלת תוצאות מיטביות, מלאי החלבון צריך להיות בעל טוהר גבוה, אך אין דרישות חיץ ספציפיות. באמצעות MP, ניתן להעריך את איגוד נוגדני האנטיגן בפחות מחמש דקות. איסוף הנתונים והניתוח הנדרשים לחישובי KD מדויקים יכולים להתבצע תוך 30 דקות.
Protocol
Representative Results
Discussion
פרוטוקול Mass Photometry המתואר כאן מספק שיטה מהירה ומדויקת למדידת זיקה לקשירת נוגדנים אנטיגן. ניתוח MP משתמש בכמות קטנה מאוד של חומר, ומידע נוסף – כולל סטואיכימטריה, אוליגומריזציה וטוהר – ניתן להעריך מאותם נתונים (איור 5). ללא שינויים, שיטה זו חלה על המדידות של קבועי דיסוציאציה בט…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים לקייר נוימן על הקריאה הביקורתית של כתב היד. עבודה זו נתמכה על ידי התוכנית האינטרא-מורלית של ה-NHLBI, NIH.
Materials
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24×24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24×50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
References
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer’s Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer – A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).

