न्यूट्रॉन स्पिन इको स्पेक्ट्रोस्कोपी के माध्यम से प्रोटीन गतिशीलता का अध्ययन
Summary
वर्तमान प्रोटोकॉल मानव स्वास्थ्य में महत्वपूर्ण भूमिका है कि दो मॉडल प्रोटीन की संरचना और गतिशीलता की जांच के लिए तरीकों का वर्णन करता है। तकनीक प्रोटीन इंटरडोमेन गतियों के लिए प्रासंगिक समय और लंबाई के तराजू पर गतिशीलता तक पहुंचने के लिए न्यूट्रॉन स्पिन इको स्पेक्ट्रोस्कोपी के साथ बेंच-टॉप बायोफिजिकल लक्षण वर्णन को जोड़ती है।
Abstract
अधिकांश मानव शरीर प्रोटीन की गतिविधि और कार्यक्षमता प्रोटीन क्रिस्टल संरचना के भीतर पूरे उपडोमेन के विन्यास परिवर्तनों से संबंधित हैं। क्रिस्टल संरचनाएं किसी भी गणना के लिए आधार बनाती हैं जो प्रोटीन की संरचना या गतिशीलता का वर्णन करती है, ज्यादातर समय मजबूत ज्यामितीय प्रतिबंधों के साथ। हालांकि, क्रिस्टल संरचना से ये प्रतिबंध समाधान में मौजूद नहीं हैं। समाधान में प्रोटीन की संरचना पिको पर लूप या उपडोमेन के पुनर्व्यवस्था के कारण क्रिस्टल से नैनोसेकंड टाइम स्केल (यानी, आंतरिक प्रोटीन गतिशीलता समय शासन) से भिन्न हो सकती है। वर्तमान कार्य बताता है कि न्यूट्रॉन बिखरने का उपयोग करके कई दसियों नैनोसेकंड के टाइमस्केल पर धीमी गति तक कैसे पहुंचा जा सकता है। विशेष रूप से, दो प्रमुख मानव प्रोटीनों के गतिशील लक्षण वर्णन, एक आंतरिक रूप से अव्यवस्थित प्रोटीन जिसमें एक अच्छी तरह से परिभाषित माध्यमिक संरचना और एक शास्त्रीय एंटीबॉडी प्रोटीन की कमी होती है, को प्रयोगशाला लक्षण वर्णन विधियों की एक विस्तृत श्रृंखला के साथ संयुक्त न्यूट्रॉन स्पिन इको स्पेक्ट्रोस्कोपी (एनएसई) द्वारा संबोधित किया जाता है। प्रोटीन डोमेन गतिशीलता में आगे की अंतर्दृष्टि प्रयोगात्मक न्यूट्रॉन डेटा का वर्णन करने और संयुक्त विसारक और आंतरिक प्रोटीन गतियों के बीच क्रॉसओवर निर्धारित करने के लिए गणितीय मॉडलिंग का उपयोग करके प्राप्त की गई थी। एनएसई से प्राप्त मध्यवर्ती बिखरने वाले फ़ंक्शन में आंतरिक गतिशील योगदान का निष्कर्षण, जिसमें विभिन्न आंदोलनों का टाइमस्केल शामिल है, एकल प्रोटीन के यांत्रिक गुणों और भीड़ वाले प्रोटीन समाधान में उनके लगभग प्राकृतिक वातावरण में प्रोटीन की कोमलता में आगे की दृष्टि की अनुमति देता है।
Introduction
न्यूट्रॉन के साथ नरम पदार्थ की गतिशीलता की जांच
प्रोटीन और पेप्टाइड्स के गतिशील गुणों की जांच करना बायोफिजिकल अनुसंधान का एक प्रमुख हिस्सा है, और ऊर्जा परिदृश्य की एक विस्तृत श्रृंखला तक पहुंचने के लिए आज कई अच्छी तरह से विकसित तरीके मौजूद हैं1. प्रोटीन की प्रयोगात्मक रूप से प्रकट गतिशीलता को उनके जैविक कार्य से संबंधित करना एक अधिक कठिन कार्य है, जिसके लिए जटिल गणितीय मॉडल और कंप्यूटर-एडेड गतिशीलता सिमुलेशन की आवश्यकता होती है। प्रोटीन गतियों के विश्लेषण के लिए न्यूट्रॉन स्पेक्ट्रोस्कोपी के महत्व पर कई अच्छी तरह से प्राप्त और व्यापक रूप से मान्यता प्राप्त अध्ययनों 1,2,3,4,5 में जोर दिया गया है। आंतरिक प्रोटीन गतिशीलता के विविध ऊर्जा परिदृश्य की खोज करने से पहले, नरम पदार्थ में गतिशील प्रक्रियाओं का एक संक्षिप्त अवलोकन और न्यूट्रॉन उन्हें कैसे एक्सेस कर सकते हैं, इसकी आवश्यकता होती है।
आइसोटोपिक कॉन्फ़िगरेशन के लिए न्यूट्रॉन की संवेदनशीलता और नरम पदार्थ के साथ प्रदर्शित इंटरैक्शन का प्रकार न्यूट्रॉन बिखरने को सबसे बहुमुखी जांच तकनीकों में से एक बनाता है6. सहसंबंध लंबाई तराजू और सहसंबंध समय का एक व्यापक स्पेक्ट्रम है जो न्यूट्रॉन परमाणु उत्तेजना और परमाणु कंपन से सामूहिक गतियों और आइसोट्रोपिक घूर्णन और विसारक गतियों जैसी धीमी विश्राम प्रक्रियाओं तक पहुंच सकते हैं। उनके ऊर्जा हस्तांतरण के लिए बिखरे हुए न्यूट्रॉन की जांच करते समय, तीन मुख्य इंटरैक्शन को प्रतिष्ठित किया जा सकता है: लोचदार बिखरने, जिसमें नमूने में आने वाले न्यूट्रॉन और कण के बीच कोई ऊर्जा विनिमय नहीं होता है; न्यूट्रॉन और कण के बीच एक बड़े, मात्रात्मक ऊर्जा विनिमय के साथ अप्रत्याशित प्रकीर्णन; और अर्ध-लोचदार बिखरने का अजीब मामला जो घटना न्यूट्रॉन ऊर्जा 1,7 की तुलना में बहुत कम ऊर्जा हस्तांतरण को नामित करता है। ये इंटरैक्शन जांच की गई सामग्री के बारे में सटीक जानकारी देते हैं और विभिन्न प्रकार की न्यूट्रॉन बिखरने वाली तकनीकों का सैद्धांतिक आधार बनाते हैं।
लोचदार बिखरने में, डिटेक्टर न्यूट्रॉन की दिशाओं को एक विवर्तन पैटर्न के रूप में रिकॉर्ड करता है, जो एक दूसरे के सापेक्ष नमूना परमाणुओं की स्थिति को दर्शाता है। परमाणु पदों के सहसंबंधों के बारे में जानकारी प्राप्त की जाती है (यानी, गति हस्तांतरण क्यू से संबंधित एकीकृत तीव्रता एस ( क्यू), जो अकेले संरचनात्मक जानकारी से संबंधित है)। यह सिद्धांत न्यूट्रॉन विवर्तन 8 का आधार बनाताहै।
जटिलता तब उत्पन्न होती है जब नमूना सामग्री में उत्तेजना और आंतरिक उतार-चढ़ाव के कारण ऊर्जा हस्तांतरण अब शून्य नहीं होता है। यह न्यूट्रॉन स्पेक्ट्रोस्कोपी का आधार बनाता है, जिसमें बिखरे हुए न्यूट्रॉन की जांच ऊर्जा हस्तांतरण ई और गति हस्तांतरण क्यू दोनों के एक समारोह के रूप में की जाती है। गतिशील और संरचनात्मक जानकारी प्राप्त की जाती है। न्यूट्रॉन स्पेक्ट्रोस्कोपी ऊर्जा हस्तांतरण के लिए एक ही एकीकृत तीव्रता एस (क्यू) को मापता है (यानी, नमूना बिखरने के कारण न्यूट्रॉन का वेग परिवर्तन, एस (क्यू, ω) = एस (क्यू, ई), जिसे गतिशील संरचना कारक भी कहा जाता है)9।
किसी सामग्री से बिखरने की गणना के लिए, जोड़ी सहसंबंध फ़ंक्शन 7,10 का उपयोग करना अधिक पर्याप्त है। विवर्तन मामले में, स्थैतिक जोड़ी सहसंबंध फ़ंक्शन जी (आर) किसी अन्य कण के केंद्र से किसी दिए गए दूरी पर एक कण के केंद्र को खोजने की संभावना देता है। स्पेक्ट्रोस्कोपी स्थिर जोड़ी सहसंबंध फ़ंक्शन को सामान्यीकृत करता है और बिखरने वाले समीकरण में ऊर्जा / आवृत्ति / समय शामिल करता है। जोड़ी सहसंबंध फ़ंक्शन जी (आर) समय जी (आर, टी) का एक फ़ंक्शन बन जाता है, जिसे एक अलग परमाणु जोड़ी सहसंबंध फ़ंक्शन जीडी (आर, टी), और एक आत्म-सहसंबंध फ़ंक्शन जीएस (आर, टी) में विघटित किया जा सकता है। ये दो प्रकार के सहसंबंधों का वर्णन करते हैं: परमाणुओं की जोड़ी-सहसंबद्ध गति जो सुसंगत बिखरने को नियंत्रित करती है, और आत्म-सहसंबंध जो असंगत बिखरने को नियंत्रित करती है10.
सुसंगत प्रकीर्णन “औसत” से बिखरना है और बिखरी हुई तरंगों के सापेक्ष चरण पर निर्भर करता है। छोटे कोण बिखरने वाले शासन में, विभिन्न बिखरने वाले केंद्रों (विभिन्न परमाणुओं) से बिखरी हुई न्यूट्रॉन तरंगें रचनात्मक रूप से हस्तक्षेप करती हैं (समान चरण होते हैं), और परमाणुओं की सामूहिक गति मजबूत तीव्रता वृद्धि के साथ देखी जाती है। सुसंगत प्रकीर्णन अनिवार्य रूप से नमूना10 में सभी नाभिक से एक न्यूट्रॉन के बिखरने का वर्णन करता है।
जब विभिन्न केंद्रों से बिखरे हुए न्यूट्रॉन तरंगों के बीच कोई रचनात्मक हस्तक्षेप नहीं होता है, तो समय पर एक एकल परमाणु का पालन किया जाता है, और समय पर परमाणु की स्थिति के बीच आत्म-सहसंबंध टी = 0 और समय पर एक ही परमाणु टी मनाया जाता है। इस प्रकार, परमाणुओं की सापेक्ष स्थिति पर जानकारी खो जाती है, और ध्यान केवल स्थानीय उतार-चढ़ाव पर होता है। स्थानीय उतार-चढ़ाव से बिखरने से असंगत बिखरने को नियंत्रित करता है। असंगत प्रकीर्णन आइसोट्रोपिक है, पृष्ठभूमि संकेत में योगदान देता है, और सिग्नल-टू-शोर10,11 को नीचा दिखाता है।
उपरोक्त सभी के संयोजन से, हम चार प्रमुख न्यूट्रॉन बिखरने की प्रक्रियाओं को अलग करते हैं10: (1) लोचदार सुसंगत (परमाणु पदों के सहसंबंधों को मापता है), (2) अप्रत्याशित सुसंगत (परमाणुओं की सामूहिक गति को मापता है), (3) लोचदार असंगत (पृष्ठभूमि में योगदान देता है, डेबी-वालर कारक (डीडब्ल्यूएफ) द्वारा बिखरने की तीव्रता को कम करता है और लोचदार असंगत संरचना कारक (ईआईएसएफ) को मापता है। और (4) अप्रत्याशित असंगत (एकल परमाणु गतिशीलता और आत्म-सहसंबंध को मापता है)।
गतिशीलता प्रक्रियाएं जो न्यूट्रॉन जीव विज्ञान में कम आवृत्ति परमाणु और आणविक कंपन के भिगोना, जैव-सतहों के साथ विलायक अणुओं की बातचीत, और मैक्रोमोलेक्यूल्स और सीमित ज्यामिति की जलयोजन परत में प्रसार प्रक्रियाओं से लेकर छोटी दूरी की ट्रांसलेशनल, घूर्णी और टम्बलिंग डिफ्यूसिव गतियों, और प्रोटीन डोमेन और एलोस्टेरिक गतियोंतक पहुंच सकती हैं। . प्रोटीन गतिशीलता को मापने के लिए न्यूट्रॉन विधियों और उपकरणों की विस्तृत विविधता इस बात पर आधारित है कि घटना या आउटगोइंग न्यूट्रॉन बीम का अक्रोमेटाइजेशन कैसे प्राप्त किया जाता है और बिखरे हुए न्यूट्रॉन का ऊर्जा विश्लेषण कैसे किया जाता है। ट्रिपल-अक्ष से टाइम-ऑफ-फ्लाइट, बैकस्कैटरिंग और स्पिन-इको स्पेक्ट्रोमीटर तक, कोई भी 1 एक्स 10-14 एस और 1 एक्स 10-6 एस (फेम्टोसेकंड से माइक्रोसेकंड) 12 के बीच विशिष्ट समय के साथ गतिशील प्रक्रियाओं का पता लगा सकता है।
ओक रिज नेशनल लेबोरेटरी, अपने दो प्रसिद्ध न्यूट्रॉन स्रोतों के साथ, स्पैलेशन न्यूट्रॉन स्रोत – एसएनएस13 और उच्च आइसोटोप फ्लक्स रिएक्टर – एचएफआईआर14, जैव-सामग्री में गतिशीलता की जांच के लिए स्पेक्ट्रोमीटर के सबसे अच्छे सुइट्स में से एक है। कुछ सबसे वाक्पटु उदाहरणों में समाधान16 में हरे फ्लोरोसेंट प्रोटीन के आसपास जलयोजन पानी की गतिशील गड़बड़ी की जांच करने के लिए एसएनएस 15 में ठंडे न्यूट्रॉन हेलिकॉप्टर स्पेक्ट्रोमीटर (सीएनसीएस) का उपयोग या कईप्रोटीनों के उप-पिकोसेकंड सामूहिक कंपन17 शामिल हैं। अप्रत्याशित न्यूट्रॉन बिखरने की जांच की एक आवर्ती समस्या यह है कि कुछ जैविक प्रक्रियाएं देखी जाने वाली बहुत धीमी हैं। चरम सेटअप के बिना जो न्यूट्रॉन तीव्रता के भारी नुकसान का कारण बनता है, टाइम-ऑफ-फ्लाइट स्पेक्ट्रोमीटर 10 μeV ऊर्जा रिज़ॉल्यूशन तक सीमित होते हैं, जो ~ 200 पीएस10,11 के अधिकतम समय पैमाने के अनुरूप होते हैं। यह प्रोटीन में बड़े पैमाने पर गति का निरीक्षण करने के लिए पर्याप्त नहीं है। इसलिए, बैकस्कैटरिंग स्पेक्ट्रोमीटर जैसे उच्च ऊर्जा रिज़ॉल्यूशन वाले उपकरणों की अक्सर आवश्यकता होती है। टाइम-ऑफ-फ्लाइट और बैकस्कैटरिंग तकनीकों का संयोजन साइटोक्रोम पी 450 कैम (सीवाईपी 101) की आंतरिक गतिशीलता में परिवर्तन की जांच के लिए शक्तिशाली साबित हुआ है, एक एंजाइम जो हाइड्रॉक्सिलेशन कपूर18 को उत्प्रेरित करता है।
एसएनएस-बेसिस19 में बैकस्कैटरिंग स्पेक्ट्रोमीटर द्वारा मापा गया सूक्ष्म फैलाव आश्चर्यजनक रूप से अच्छी तरह से परिभाषित किया गया था और इसे पानी की विसारकता (जलयोजन, साइटोप्लाज्मिक और थोक जैसे पानी) और प्लेनेरियन फ्लैटवर्म में सेल घटकों की फैलाव में अलग किया जा सकता है, न्यूट्रॉन बिखरने20 द्वारा अध्ययन किया जाने वाला पहला जीवित जानवर . बैकस्कैटरिंग एक उच्च-रिज़ॉल्यूशन स्पेक्ट्रोस्कोपिक तकनीक है, लेकिन यह कई μeV = कई नैनोसेकंड तक भी सीमित है, जबकि बायोमैटेरियल्स में धीमी गतिशीलता परमाणु स्थिति या स्पिन झुकाव के बीच सहसंबंध के जीवित रहने के समय के रूप में भी प्रकट होती है (उदाहरण के लिए, विश्राम प्रक्रियाएं, जो नियमित रूप से दस से सैकड़ों नैनोसेकंड की समय सीमा में होती हैं)।
न्यूट्रॉन स्पिन इको स्पेक्ट्रोस्कोपी (एनएसई) इस तरह के उच्च रिज़ॉल्यूशन तक पहुंचने वाली एकमात्र न्यूट्रॉन बिखरने वाली तकनीक है। अन्य न्यूट्रॉन तकनीकों के विपरीत, एनएसई को बीम के एक्रोमेटाइजेशन की आवश्यकता नहीं होती है क्योंकि यह न्यूट्रॉन के क्वांटम यांत्रिक चरण का उपयोग करता है, जो उनके चुंबकीय क्षण हैं। चुंबकीय क्षणों का हेरफेर एक व्यापक न्यूट्रॉन बीम तरंग दैर्ध्य वितरण के उपयोग की अनुमति देता है, जबकि तकनीक 1 x 10-4 के क्रम में बहुत छोटे न्यूट्रॉन वेग परिवर्तनों के प्रति संवेदनशील है। एनएसई का उपयोग कई प्रोटीनों के समाधान में प्रोटीन की धीमी गतिशीलता की जांच करने के लिए सफलतापूर्वक किया गया है। इन कई अग्रणी अध्ययनों में, हम सुअर इम्युनोग्लोबुलिन21 के खंडीय लचीलेपन के अध्ययन को स्वीकार करते हैं; टैक पोलीमरेज़22 में युग्मित डोमेन गति; खमीर अल्कोहल डिहाइड्रोजनेज23 के टेट्रामर में डोमेन गति; सब्सट्रेट बाध्यकारी3 पर फॉस्फोग्लिसरेट किनेज में विरूपण का परिवर्तन; एच + एक्सचेंज नियामक कॉफ़ेक्टर 1 (एनएचईआरएफ 1) प्रोटीन 4,24,25 में डोमेन गतियों की सक्रियता और एलोस्टेरिक संकेतों का गतिशील प्रसार; मर्क्यूरिक आयन रिडक्टेस26 की एक कॉम्पैक्ट अवस्था की गतिशीलता; और लाल रक्त कोशिकाओं में हीमोग्लोबिन का प्रसार27. प्रोटीन गतिशीलता में दो और हालिया अध्ययनों ने मानव एंटीबॉडी इम्युनोग्लोबुलिन जी (आईजीजी) के लचीलेपन को एन्ट्रोपिक वसंत28 के रूप में उजागर किया है और आंतरिक रूप से अव्यवस्थित माइलिन मूल प्रोटीन (एमबीपी) 5 की गतिशीलता में विलायक योगदान की विशेषताओं को उजागर किया है।
वर्तमान लेख एनएसई के बुनियादी सिद्धांतों, पूरी तरह से प्रोटीन गतिशीलता जांच के लिए अनुशंसित कई प्रारंभिक विधियों के साथ-साथ एसएनएस, एसएनएस-एनएसई में एनएसई स्पेक्ट्रोमीटर में एनएसई डेटा अधिग्रहण के लिए पद्धति और प्रयोगात्मक प्रोटोकॉल की व्याख्या करता है। प्रोटोकॉल दो प्रोटीनों की विशेषता है: आईजीजी, एक नियमित मानव एंटीबॉडी प्रोटीन, और आंतरिक रूप से अव्यवस्थित प्रोटीन एमबीपी। बायोफिजिकल निहितार्थ, उदाहरणों की अनुसंधान प्रासंगिकता और तकनीक की सीमाओं पर संक्षेप में चर्चा की जाती है।
एनएसई स्पेक्ट्रोस्कोपी, धीमी गति से गतिशीलता माप के लिए विधि
एनएसई एक ध्रुवीकृत तकनीक है जो एक नमूने में न्यूट्रॉन और परमाणुओं के बीच अर्ध-लोचदार बातचीत के कारण ऊर्जा के आदान-प्रदान (ध्रुवीकरण की हानि) को मापने के लिए न्यूट्रॉन टाइम-ऑफ-फ्लाइट का उपयोग करती है। एनएसई स्पेक्ट्रोस्कोपी के मूल में दो बुनियादी सिद्धांत निहित हैं: (1) चुंबकीय शक्ति 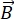 के आनुपातिक आवृत्ति के साथ चुंबकीय क्षेत्र में न्यूट्रॉन स्पिन की क्षमता, अर्थात् लार्मर आवृत्ति 29, और (बी) स्पिन-इको याहैन इको, रेडियोफ्रीक्वेंसी दालोंकी एक श्रृंखला को लागू करते समय ध्रुवीकरण संकेत के हेरफेर और पुन: फोकसिंग का प्रतिनिधित्व करते हैं।
के आनुपातिक आवृत्ति के साथ चुंबकीय क्षेत्र में न्यूट्रॉन स्पिन की क्षमता, अर्थात् लार्मर आवृत्ति 29, और (बी) स्पिन-इको याहैन इको, रेडियोफ्रीक्वेंसी दालोंकी एक श्रृंखला को लागू करते समय ध्रुवीकरण संकेत के हेरफेर और पुन: फोकसिंग का प्रतिनिधित्व करते हैं।
एनएसई प्रक्रिया की मूल बातें चित्रा 1 का उपयोग करके कुछ सरल चरणों 6,11 में संक्षेप ति की जा सकती हैं। (1) स्रोत (स्थिति 1) द्वारा उत्पादित न्यूट्रॉन बीम ध्रुवीकृत (स्थिति 2), निर्देशित और परिवहन (स्थिति 3) है, और एनएसई स्पेक्ट्रोमीटर के प्रवेश द्वार पर आता है, जहां यह पहले पाई-आधा फ्लिपर (स्थिति 4) द्वारा 90 ° तक घुमाया जाता है। (2) ध्रुवीकृत बीम (जैसे, न्यूट्रॉन चुंबकीय क्षण) पहले चुंबक की चुंबकीय क्षेत्र रेखाओं (पहले पूर्ववर्ती क्षेत्र, स्थिति 5) के लंबवत हो जाता है और पूर्ववर्ती होने लगता है। (3) चुंबक के अंत में, न्यूट्रॉन स्पिन चुंबकीय क्षेत्र की ताकत और अंदर बिताए गए समय-उड़ान के आनुपातिक एक निश्चित पूर्ववर्ती कोण जमा करते हैं (मूल रूप से न्यूट्रॉन वेग के विपरीत आनुपातिक)। व्यक्तिगत न्यूट्रॉन वेग को पहले पूर्ववर्ती क्षेत्र के अंत में उनके पूर्ववर्ती कोण के भीतर एन्कोड किया जाता है। (4) नमूना स्थिति के करीब, पाई-फ्लिपर (स्थिति 6) स्पिन के अभिविन्यास को 180 ° तक उलट देता है, पूर्ववर्ती कोण के संकेत को बदल देता है। (5) न्यूट्रॉन नमूने के अणुओं (स्थिति 7) के साथ बातचीत करते हैं और बिखरे हुए हो जाते हैं। (6) बिखरे हुए न्यूट्रॉन दूसरे पूर्ववर्ती क्षेत्र (स्थिति 8) में प्रवेश करते हैं और पूर्ववर्ती होते हैं लेकिन उलट-उन्मुख हो जाते हैं। (7) एक और पाई-आधा फ्लिपर (स्थिति 9) का उपयोग स्पिन के अभिविन्यास को लंबवत से क्षैतिज दिशा में घुमाने के लिए किया जाता है। यह पूर्वाग्रह को रोक देगा, φ पूर्ववर्ती कोण को सीओएस (φ) के आनुपातिक ध्रुवीकरण में अनुवाद करेगा। (8) विश्लेषक (स्थिति 10) एक अभिविन्यास के आधार पर न्यूट्रॉन का चयन करता है। यदि नमूने के साथ बातचीत लोचदार है, तो न्यूट्रॉन का वेग नहीं बदलेगा। न्यूट्रॉन पहले और दूसरे पूर्ववर्ती क्षेत्रों में उड़ान भरने में समान समय बिताएंगे, और संचित पूर्वाग्रह कोण पूरी तरह से पुनर्प्राप्त हो जाते हैं। पूर्ण ध्रुवीकरण डिटेक्टर (स्थिति 11) पर मूल ध्रुवीकरण (यानी, स्पिन-इको) की गूंज के रूप में बहाल किया जाता है। (9) हालांकि, एनएसई में, बिखरने अर्ध-लोचदार है, इसलिए न्यूट्रॉन और नमूना अणुओं के बीच एक छोटा ऊर्जा विनिमय नमूने द्वारा बिखरने के बाद विभिन्न न्यूट्रॉन वेगों की ओर जाता है। विभिन्न वेगों के कारण, न्यूट्रॉन दूसरे पूर्ववर्ती क्षेत्र के माध्यम से उड़ान भरने में एक अतिरिक्त समय बिताएंगे और अपने पूर्ववर्ती कोण को ठीक से पुनर्प्राप्त नहीं करेंगे। डिटेक्टर पर एक आंशिक ध्रुवीकरण पुनर्प्राप्त किया जाता है, और स्पिन विश्राम के कारण ध्रुवीकरण का नुकसान वर्णक्रमीय फ़ंक्शन एस (क्यू, ω), मध्यवर्ती प्रकीर्णन फ़ंक्शन एफ (क्यू, टी) के कॉस-फूरियर-ट्रांसफॉर्म के आनुपातिक है। (10) फ़ंक्शन एफ (क्यू, टी) का समय पैरामीटर पूर्ववर्ती चुंबकीय क्षेत्र की ताकत के लिए आनुपातिक है। चुंबकीय क्षेत्र की ताकत के एक समारोह के रूप में ध्रुवीकरण के नुकसान को स्कैन करना पैदावार, इसलिए, एक विश्राम फ़ंक्शन जो नमूने के भीतर गतिशील प्रक्रियाओं पर निर्भर करता है।

चित्रा 1: एसएनएस (एसएनएस-एनएसई) में एनएसई स्पेक्ट्रोमीटर की तस्वीर और सबसे महत्वपूर्ण कार्यात्मक घटकों के साथ न्यूट्रॉन फ्लाई पथ योजनाबद्ध। दाएं से बाएं: 1 = न्यूट्रॉन स्रोत; 2 = हेलिकॉप्टर-बेंडर-पोलराइज़र-माध्यमिक शटर सिस्टम; 3 = बीम परिवहन गाइड; 4 = पहले 90 ° स्पिन-टर्न के लिए पाई /2 फ्लिपर; 5 = पहला पूर्ववर्ती क्षेत्र; 6 = 180 ° स्पिन-टर्न के लिए पाई फ्लिपर; 7 = नमूना क्षेत्र और नमूना पर्यावरण (यहां, क्रायो-भट्ठी दिखाया गया है); 8 = दूसरा पूर्ववर्ती क्षेत्र; 9 = दूसरे 90 ° स्पिन-टर्न के लिए पाई/2 फ्लिपर; 10 = विश्लेषक; 11 = डिटेक्टर। (ध्यान दें कि 3, साथ ही 2 और 1 के हिस्से परिरक्षण के अंदर नीली दीवार के पीछे स्थित हैं; हेलिकॉप्टरों को रिएक्टर-आधारित एनएसई के लिए एक वेग चयनकर्ता द्वारा प्रतिस्थापित किया जाता है)। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
एनएसई स्पेक्ट्रोस्कोपी प्रोटीन की गतिशीलता का एक अनूठा और विस्तृत दृश्य प्रदान करता है, जो अन्य स्पेक्ट्रोस्कोपिक तकनीकों का उत्पादन नहीं कर सकता है। एक विस्तारित समय पैमाने पर माप प्रोटीन के अनुवा?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
इस शोध ने स्पैलेशन न्यूट्रॉन स्रोत (बीएल -15, बीएल -6, जीवविज्ञान और रसायन विज्ञान प्रयोगशालाओं) में संसाधनों का उपयोग किया, ओक रिज नेशनल लेबोरेटरी द्वारा संचालित विज्ञान उपयोगकर्ता सुविधा का एक डीओई कार्यालय। इस शोध ने एमएलजेड-एफआरएम 2 रिएक्टर गार्चिंग (केडब्ल्यूएस -2, फीनिक्स-जे-एनएसई) और जर्मनी के फोर्सचुंग्सज़ेंट्रम जुलिच जीएमबीएच में जेसीएनएस 1 में संसाधनों का भी उपयोग किया। राल्फ बीहल और डॉ एंड्रियास स्टैडलर को मॉडलिंग और आईजीजी और एमबीपी प्रोटीन अनुसंधान दोनों में उनके योगदान के साथ उनकी मदद के लिए स्वीकार करते हैं, एनएसई डेटा कमी समर्थन के लिए डॉ पियोटर ए स्ओनीरकज़ुक, एसएएनएस माप के साथ समर्थन के लिए डॉ चांगवू डू, और एसएनएस जैव रसायन प्रयोगशाला समर्थन के लिए रोंडा मूडी और डॉ केविन वीस।
Materials
| Bovine MBP protein solution | Sigma-Aldrich | M1891 | lyophilized powder reconstituted in D2O |
| D2O – heavy water | Sigma-Aldrich | Product No. 151882 | liquid |
| Dionized water | in house | – | for washing / cleanning cells |
| DLS instrument | Zetasizer Nano ZS, FZ-Jülich | – | dynamic light scattering instrument |
| Elastic scattering standards | SNS-NSE, ORNL | – | Al2O3 and Graphite powders |
| Ethanol | Sigma-Aldrich | 65350-M | 70% ethanol for cleaning cells |
| IgG protein solution | Sigma-Aldrich | I4506 | lyophilized powder reconstituted in D2O |
| KWS-2 instrument | JCNS outstation at the MLZ, Garching, Germany | – | small angle neutron instrument |
| Liquinox dish detergent | Alconox | – | Phosphate-free liquid lab glassware cleaner |
| Na2HPO4·7H2O | Sigma-Aldrich | Product No.S9390 | disodium phosphate heptahydrate salt |
| NaCl | Sigma-Aldrich | Product No.S9888 | sodium chloride salt |
| NaH2PO4·H2O | Sigma-Aldrich | Product No. S9638 | monosodium phosphate monohydrate salt |
| Nanodrop spectrophotometer | Thermo Scientific | Catalog number: ND-2000 | NanoDrop 2000/2000c Spectrophotometer |
| Neutron alignment camera | NeutronOptics, Grenoble | NOG210222 | 100 x 100 mm camera with Sony IMX249 CMOS sensor |
| Parafilm M – wax parafilm | Bemis | Parafilm M – 5259-04LC PM996 | all-purpose laboratory film in cardboard dispenser |
| Phoenix-J-NSE Spectrometer | JCNS outstation at the MLZ, Garching, Germany | – | neutron spectrometer |
| SasView | https://www.sasview.org/ | ||
| SAXSpace, Anton Paar instrument | FZ-Jülich | – | small angle x-ray instrument |
| Slide-A-Lyzer dialysis membranes | Thermo Scientific | 88400-88405 | Slide-A-Lyzer mini dialysis devices tubes of 3.5 K MWCO |
| SNS Remote Analysis Cluster | Neutron Science Remote Analysis (sns.gov) | https://analysis.sns.gov | |
| SNS-NSE spectrometer | ORNL, Oak Ridge, TN, USA | – | neutron spectrometer |
| Sterile syringe filters | VWR | N.A. PN:28145-501 | 0.2 µm pore size filters |
| Temperature Forcing System (TFS) | SP Scientific | Part Number 100004055 | sample environment equipment |
| Urea -d4 | Sigma-Aldrich | Product No. 176087 | deuterated Urea salt |
| Viscometer | FZ-Jülich | – | falling ball viscometer |
References
- Fitter, J., Gutberlet, T., Katsaras, J. . Neutron Scattering in Biology: Techniques and Applications. , (2006).
- Stadler, A., Monkenbusch, M., Biehl, R., Richter, D., Ollivier, J. Neutron spin-echo and TOF reveals protein dynamics in solution. Journal of the Physical Society of Japan. 82, (2013).
- Inoue, R. Large domain fluctuations on 50-ns timescale enable catalytic activity in phosphoglycerate kinase. Biophysical Journal. 99 (7), 2309-2317 (2010).
- Callaway, D. J. E., et al. Controllable activation of nanoscale dynamics in a disordered protein alters binding kinetics. Journal of Molecular Biology. 429 (7), 987-998 (2017).
- Stingaciu, L. R., Biehl, R., Changwoo, D., Richter, D., Stadler, A. M. Reduced internal friction by osmolyte interaction in intrinsically disordered myelin basic protein. Journal of Physical Chemistry Letters. 11 (1), 292-296 (2020).
- Monkenbusch, M., Richter, D. High resolution neutron spectroscopy-a tool for the investigation of dynamics of polymers and soft matter. Comptes Rendus Physique. , (2007).
- Richter, D., Monkenbusch, M., Schwahn, D. Neutron Scattering. Polymer Science: A Comprehensive Reference, 10 Volume Set. , (2012).
- Wilson, C. C. . Single Crystal Neutron Diffraction From Molecular Materials. , (2000).
- Marshall, W. . Theory of thermal neutron scattering. , (1971).
- . Roger Pynn Introduction & Neutron Scattering "Theory" Available from: https://neutrons.ornl.gov/sites/default/files/intro_to_neutron_scattering.pdf (2004)
- Richter, D. Neutron scattering in polymer physics. Physica B: Condensed Matter. 276-278, 22-29 (2000).
- Harroun, T. A., Wignall, G. D., Katsaras, J. Neutron scattering for biology. Neutron Scattering in Biology. , (2006).
- . SNS Available from: https://neutrons.ornl.gov/sna (2020)
- . HFIR Available from: https://neutrons.ornl.gov/hfir (2020)
- . CNCS Available from: https://neutrons.ornl.gov/cncs (2020)
- Perticaroli, S., et al. Description of hydration water in protein (green fluorescent protein) solution. Journal of the American Chemical Society. 139 (3), 1098-1105 (2017).
- Perticaroli, S., Nickels, J. D., Ehlers, G., Sokolov, A. P. Rigidity, secondary structure, and the universality of the boson peak in proteins. Biophysical Journal. 106 (12), 2667-2674 (2014).
- Miao, Y., et al. Coupled flexibility change in cytochrome p450cam substrate binding determined by neutron scattering, NMR, and molecular dynamics simulation. Biophysical Journal. 103 (10), 2167-2176 (2012).
- Mamontov, E., Zamponi, M., Hammons, S., Keener, W. S., Hagen, M., Herwig, K. W. BASIS: A new backscattering spectrometer at the SNS. Neutron News. 19 (3), 22-24 (2008).
- Mamontov, E. Microscopic diffusion processes measured in living planarians. Scientific Reports. 9, 8708 (2018).
- Alpert, Y., Cser, L., Faragó, B., Franěk, F., Mezei, F., Ostanevich, Y. M. Segmental flexibility in pig immunoglobulin G studied by neutron spin-echo technique. Biopolymers. 24 (9), 1769-1784 (1985).
- Bu, Z., Biehl, R., Monkenbusch, M., Richter, D., Callaway, D. J. E. Coupled protein domain motion in Taq polymerase revealed by neutron spin-echo spectroscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (49), 17646-17651 (2005).
- Biehl, R., et al. Direct observation of correlated interdomain motion in alcohol dehydrogenase. Physical Review Letters. 101, 138102 (2008).
- Farago, B., Li, J., Cornilescu, G., Callaway, D. J. E., Bu, Z. Activation of nanoscale allosteric protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 99 (10), 3473-3482 (2010).
- Bu, Z., Callaway, D. J. E. Dynamic propagation of long-range allosteric signals by nanoscale protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 100 (3), 223 (2011).
- Hong, L., et al. Structure and dynamics of a compact state of a multidomain protein, the mercuric ion reductase. Biophysical Journal. 107 (2), 393-400 (2014).
- Longeville, S., Stingaciu, L. -. R. Hemoglobin diffusion and the dynamics of oxygen capture by red blood cells. Scientific Reports. 7, 10448 (2017).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Hahn, E. L. Nuclear induction due to free larmor precession. Physical Review. 77, 297 (1950).
- Hahn, E. L. Spin echoes. Physical Review. 80, 580 (1950).
- Svergun, D. I., Koch, M. H. J. Small-angle scattering studies of biological macromolecules in solution. Reports on Progress in Physics. 66 (10), 1735-1782 (2003).
- . Sasview Available from: https://www.sasview.org (2020)
- Zhao, J. K., Gao, C. Y., Liu, D. The extended Q-range small-angle neutron scattering diffractometer at the SNS. Journal of Applied Crystallography. 43, 1068-1077 (2010).
- Ohl, M., et al. The high-resolution neutron spin-echo spectrometer for the SNS with τ ≥ 1 µs. Physica B: Condensed Matter. 350, 147-150 (2004).
- . SNS-NSE web page Available from: https://neutrons.ornl.gov/nse (2022)
- Ohl, M., et al. The spin-echo spectrometer at the Spallation Neutron Source (SNS). Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 696, 85-99 (2012).
- Zolnierczuk, P. A., Holderer, O., Pasini, S., Kozielewski, T., Stingaciu, L. R., Monkenbusch, M. Efficient data extraction from neutron time-of-flight spin-echo raw data. Journal of Applied Crystallography. 52 (5), 1022-1034 (2019).
- . Dr Spine hub Available from: https://jugit.fz-juelich.de/nse/drspine (2022)
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), (2014).
- . FZJ Available from: https://www.fz-juelich.de/portal/EN/AboutUs (2022)
- . KWS2 Available from: https://miz-garching.de/kws-2 (2022)
- Moorhouse, M., Barry, P. The protein databank. Bioinformatics Biocomputing and Perl. , (2005).
- Tria, G., Mertens, H. D. T., Kachala, M., Svergun, D. I. Advanced ensemble modelling of flexible macromolecules using X-ray solution scattering. IUCrJ. 2 (2), 207-217 (2015).
- Holderer, O., Monkenbusch, M., Schätzler, R., Kleines, H., Westerhausen, W., Richter, D. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 90 (4), 043107 (2008).
- Biehl, R., Monkenbusch, M., Richter, D. Exploring internal protein dynamics by neutron spin echo spectroscopy. Soft Matter. 7 (4), 1299-1307 (2011).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), 6987-6994 (2014).
- Biehl, R., Richter, D. Slow internal protein dynamics in solution. Journal of Physics: Condensed Matter. 26 (50), 503103 (2014).
- Hinsen, K. The molecular modeling toolkit: A new approach to molecular simulations. Journal of Computational Chemistry. 21 (2), 79-85 (2000).
- Uhlenbeck, G. E., Ornstein, L. S. On the theory of the Brownian motion. Physical Review. 36 (5), 823 (1930).
- Wang, M. C., Uhlenbeck, G. E. On the theory of the Brownian motion II. Reviews of Modern Physics. 17, 323 (1945).
- Callaway, D. J. E., Bu, Z. Nanoscale protein domain motion and long-range allostery in signaling proteins-a view from neutron spin echo spectroscopy. Biophysical Reviews. 7 (2), 165-174 (2015).
- Liu, Y. Intermediate scattering function for macromolecules in solution probed by neutron spin echo. Physical Review E. 95, 020501 (2017).
- Liu, Y. Short-time dynamics of proteins in solutions studied by neutron spin echo. Current Opinion in Colloid & Interface Science. 42, 147-156 (2019).

