Estudio de la dinámica de proteínas a través de la espectroscopia de eco de espín de neutrones
Summary
El presente protocolo describe métodos para investigar la estructura y la dinámica de dos proteínas modelo que tienen un papel importante en la salud humana. La técnica combina la caracterización biofísica de sobremesa con la espectroscopia de eco de espín de neutrones para acceder a la dinámica en escalas de tiempo y longitud relevantes para los movimientos entre dominios de proteínas.
Abstract
La actividad y funcionalidad de la mayoría de las proteínas del cuerpo humano están relacionadas con cambios de configuración de subdominios completos dentro de la estructura cristalina de la proteína. Las estructuras cristalinas construyen la base para cualquier cálculo que describa la estructura o dinámica de una proteína, la mayoría de las veces con fuertes restricciones geométricas. Sin embargo, estas restricciones de la estructura cristalina no están presentes en la solución. La estructura de las proteínas en la solución puede diferir del cristal debido a los reordenamientos de bucles o subdominios en la escala de tiempo de pico a nanosegundo (es decir, el régimen de tiempo de dinámica interna de proteínas). El presente trabajo describe cómo se puede acceder a cámaras lentas en escalas de tiempo de varias decenas de nanosegundos utilizando la dispersión de neutrones. En particular, la caracterización dinámica de dos proteínas humanas principales, una proteína intrínsecamente desordenada que carece de una estructura secundaria bien definida y una proteína de anticuerpo clásica, se aborda mediante espectroscopia de eco de espín de neutrones (NSE) combinada con una amplia gama de métodos de caracterización de laboratorio. Se lograron más conocimientos sobre la dinámica del dominio de las proteínas utilizando modelos matemáticos para describir los datos experimentales de neutrones y determinar el cruce entre los movimientos difusivos e internos combinados de las proteínas. La extracción de la contribución dinámica interna a la función de dispersión intermedia obtenida de NSE, incluida la escala de tiempo de los diversos movimientos, permite una mayor visión de las propiedades mecánicas de las proteínas individuales y la suavidad de las proteínas en su entorno casi natural en la solución de proteína abarrotada.
Introduction
Dinámica de sondeo de la materia blanda con neutrones
La investigación de las propiedades dinámicas de las proteínas y los péptidos es una parte importante de la investigación biofísica, y hoy en día existen muchos métodos bien desarrollados para acceder a una amplia gama de paisajes energéticos1. Relacionar la dinámica revelada experimentalmente de las proteínas con su función biológica es una tarea mucho más difícil, que requiere modelos matemáticos complejos y simulaciones dinámicas asistidas por computadora. La importancia de la espectroscopia de neutrones para el análisis de los movimientos de las proteínas ha sido enfatizada en varios estudios bien recibidos y ampliamente reconocidos 1,2,3,4,5. Antes de explorar el diverso panorama energético de la dinámica interna de proteínas, se requiere una breve descripción de los procesos dinámicos en la materia blanda y cómo los neutrones pueden acceder a ellos.
La sensibilidad de los neutrones a la configuración isotópica y el tipo de interacciones que muestran con la materia blanda hace que la dispersión de neutrones sea una de las técnicas de investigación más versátiles6. Existe un amplio espectro de escalas de longitud de correlación y tiempos de correlación a los que los neutrones pueden acceder, desde excitaciones nucleares y vibraciones atómicas hasta movimientos colectivos y procesos de relajación lentos como rotaciones isotrópicas y movimientos difusivos. Al investigar los neutrones dispersos para su transferencia de energía, se pueden distinguir tres interacciones principales: la dispersión elástica, en la que no hay intercambio de energía entre el neutrón entrante y la partícula en la muestra; la dispersión inelástica, con un gran intercambio de energía cuantificable entre neutrones y partículas; y el peculiar caso de la dispersión cuasielástica que designa una transferencia de energía muy pequeña en comparación con la energía neutrónica incidente 1,7. Estas interacciones proporcionan información precisa sobre el material investigado y forman la base teórica de una amplia variedad de técnicas de dispersión de neutrones.
En la dispersión elástica, el detector registra las direcciones de los neutrones como un patrón de difracción, que muestra la posición de los átomos de muestra entre sí. Se adquiere información sobre las correlaciones de las posiciones atómicas (es decir, la intensidad integrada S (Q) con respecto a la transferencia de momento Q, que se refiere solo a la información estructural). Este principio constituye la base de la difracción de neutrones8.
La complejidad surge cuando la transferencia de energía ya no es cero debido a excitaciones y fluctuaciones internas en el material de la muestra. Esto forma la base de la espectroscopia de neutrones, en la que los neutrones dispersos se investigan en función tanto de la transferencia de energía E como de la transferencia de momento Q. Se obtiene información dinámica y estructural. La espectroscopia de neutrones mide la misma intensidad integrada S(Q) para la transferencia de energía (es decir, el cambio de velocidad de los neutrones debido a la dispersión de la muestra, S(Q,ω) = S(Q, E), que también se conoce como el factor de estructura dinámica)9.
Para calcular la dispersión a partir de un material, es más adecuado utilizar la función de correlación de pares 7,10. En el caso de difracción, la función de correlación de pares estáticos G(r) da la probabilidad de encontrar el centro de una partícula a una distancia dada r del centro de otra partícula. La espectroscopia generaliza la función de correlación de pares estáticos e incluye energía/frecuencia/tiempo en la ecuación de dispersión. La función de correlación de pares G(r) se convierte en una función del tiempo G(r, t), que puede descomponerse en una función de correlación de pares de átomos distinta GD(r, t), y una función de autocorrelación GS(r, t). Estos describen dos tipos de correlaciones: movimientos correlacionados por pares de átomos que gobiernan la dispersión coherente y autocorrelación que gobierna la dispersión incoherente10.
La dispersión coherente es la dispersión de “la media” y depende de la fase relativa de las ondas dispersas. En el régimen de dispersión de ángulo pequeño, las ondas de neutrones dispersas de diferentes centros de dispersión (diferentes átomos) interfieren constructivamente (tienen fases similares), y el movimiento colectivo de los átomos se observa con una fuerte mejora de intensidad. La dispersión coherente describe esencialmente la dispersión de un solo neutrón de todos los núcleos de la muestra10.
Cuando no se produce ninguna interferencia constructiva entre las ondas de neutrones dispersas de diferentes centros, se sigue un solo átomo en el tiempo, y se observa la autocorrelación entre la posición del átomo en el tiempo t = 0 y el mismo átomo en el tiempo t. Por lo tanto, la información sobre las posiciones relativas de los átomos se pierde, y el enfoque está solo en las fluctuaciones locales. La dispersión de las fluctuaciones locales gobierna la dispersión incoherente. La dispersión incoherente es isotrópica, contribuye a la señal de fondo y degrada la señal a ruido10,11.
Combinando todo lo anterior, distinguimos cuatro procesos principales de dispersión de neutrones10: (1) coherente elástico (mide las correlaciones de las posiciones atómicas), (2) coherente inelástico (mide los movimientos colectivos de los átomos), (3) elástico incoherente (contribuye al fondo, reduce la intensidad de dispersión por el factor de Debye-Waller (DWF) y mide el factor de estructura incoherente elástica (EISF), describiendo la geometría de los movimientos difusivos en geometría confinada, y (4) incoherente inelástica (mide la dinámica de un solo átomo y la autocorrelación).
Los procesos dinámicos a los que los neutrones pueden acceder en biología van desde la amortiguación de vibraciones atómicas y moleculares de baja frecuencia, la interacción de moléculas de solvente con biosuperficies y procesos de difusión en la capa de hidratación de macromoléculas y geometría confinada, hasta movimientos difusivos de traslación, rotación y caída de corto alcance, y dominios de proteínas y movimientos alostéricos1 . La amplia diversidad de métodos e instrumentos de neutrones para medir la dinámica de las proteínas se basa en cómo se logra la acromatización del haz de neutrones incidente o saliente y cómo se realiza el análisis energético de los neutrones dispersos. Desde el triple eje hasta el tiempo de vuelo, la retrodispersión y los espectrómetros de espín-eco, se pueden explorar procesos dinámicos con tiempos característicos entre 1 x 10-14 s y 1 x 10-6 s (femtosegundos a microsegundos)12.
El Laboratorio Nacional de Oak Ridge, con sus dos fuentes de neutrones de renombre, la Fuente de Neutrones de Espalación – SNS13 y el Reactor de Alto Flujo de Isótopos – HFIR14, tiene uno de los mejores conjuntos de espectrómetros para investigar la dinámica en biomateriales. Algunos de los ejemplos más elocuentes incluyen el uso del espectrómetro de picador de neutrones fríos (CNCS) en SNS15 para investigar la perturbación dinámica del agua de hidratación alrededor de la proteína fluorescente verde en la solución16 o las vibraciones colectivas sub-picosegundos de varias proteínas17. Un problema recurrente de las investigaciones de dispersión de neutrones inelásticos es que algunos procesos biológicos son demasiado lentos para ser observados. Sin configuraciones extremas que conduzcan a una gran pérdida de intensidad de neutrones, los espectrómetros de tiempo de vuelo están limitados a una resolución de energía de 10 μeV, lo que corresponde a una escala de tiempo máxima de ~ 200 ps10,11. Esto no es suficiente para observar movimientos a gran escala en las proteínas. Por lo tanto, a menudo se necesitan instrumentos con una mayor resolución de energía, como los espectrómetros de retrodispersión. La combinación de las técnicas de tiempo de vuelo y retrodispersión ha demostrado ser poderosa para investigar el cambio en la dinámica interna del citocromo P450cam (CYP101), una enzima que cataliza la hidroxilación alcanfor18.
La difusividad microscópica medida por el espectrómetro de retrodispersión en SNS-BASIS19 estaba sorprendentemente bien definida y podía separarse en la difusividad del agua (hidratación, citoplasmática y agua a granel) y la difusividad de los constituyentes celulares en gusanos planos planarios, el primer animal vivo que se estudió mediante dispersión de neutrones20 . La retrodispersión es una técnica espectroscópica de alta resolución, pero también se limita a varios μeV = varios nanosegundos, mientras que la dinámica lenta en los biomateriales también se manifiesta como el tiempo de supervivencia de la correlación entre la posición atómica o las orientaciones de espín (por ejemplo, procesos de relajación, que ocurren regularmente en el rango de tiempo de diez a cientos de nanosegundos).
La espectroscopia de eco de espín de neutrones (NSE) es la única técnica de dispersión de neutrones que alcanza una resolución tan alta. A diferencia de otras técnicas de neutrones, NSE no requiere la acromatización del haz, ya que utiliza la fase mecánica cuántica de los neutrones, que son sus momentos magnéticos. La manipulación de momentos magnéticos permite el uso de una amplia distribución de longitud de onda del haz de neutrones, mientras que la técnica es sensible a cambios de velocidad de neutrones muy pequeños del orden de 1 x 10-4. NSE se ha utilizado con éxito para investigar la dinámica lenta de las proteínas en solución para muchas proteínas. Entre estos muchos estudios pioneros, reconocemos el estudio de la flexibilidad segmentaria de la inmunoglobulina porcina21; los movimientos de dominio acoplado en la polimerasaTaq 22; los movimientos del dominio en el tetrámero de levadura alcohol deshidrogenasa23; el cambio de conformación en la fosfoglicerato quinasa sobre la unión al sustrato3; la activación de los movimientos de dominio y la propagación dinámica de señales alostéricas en la proteína 4,24,25 del cofactor regulador del intercambio Na+/H+ (NHERF1); la dinámica de un estado compacto de iones mercúricos reductasa26; y la difusión de hemoglobina en los glóbulos rojos27. Dos estudios más recientes en dinámica de proteínas han expuesto la flexibilidad del anticuerpo humano Inmunoglobulina G (IgG) como primavera entrópica28 y las características de la contribución de disolventes a la dinámica de la proteína básica de mielina intrínsecamente desordenada (MBP)5.
El presente artículo explica los principios básicos de NSE, los múltiples métodos preparatorios recomendados para una investigación exhaustiva de la dinámica de proteínas, así como la metodología y el protocolo experimental para la adquisición de datos de NSE en el espectrómetro NSE en SNS, SNS-NSE. El protocolo caracteriza dos proteínas: IgG, una proteína de anticuerpos humanos regulares, y la proteína intrínsecamente desordenada MBP. Las implicaciones biofísicas, la relevancia de la investigación de los ejemplos y las limitaciones de la técnica se discuten brevemente.
Espectroscopia NSE, el método para mediciones de dinámica lenta
NSE es una técnica polarizada que utiliza el tiempo de vuelo de neutrones para medir el intercambio de energía (pérdida de polarización) debido a la interacción cuasi-elástica entre neutrones y átomos en una muestra. En el núcleo de la espectroscopia NSE se encuentran dos principios básicos: (1) la capacidad del espín de neutrones para precesar en el campo magnético con una frecuencia proporcional a la fuerza 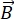 magnética, a saber, la frecuencia de Larmor29, y (b) el espín-eco o eco de Hann, que representa la manipulación y reenfoque de la señal de polarización al aplicar una serie de pulsos de radiofrecuencia30.
magnética, a saber, la frecuencia de Larmor29, y (b) el espín-eco o eco de Hann, que representa la manipulación y reenfoque de la señal de polarización al aplicar una serie de pulsos de radiofrecuencia30.
Los conceptos básicos del proceso NSE se pueden resumir en unos sencillos pasos 6,11 utilizando la Figura 1. (1) El haz de neutrones producido por la fuente (posición 1) es polarizado (posición 2), guiado y transportado (posición 3), y llega a la entrada del espectrómetro NSE, donde se gira 90° por la primera aleta pi-half (posición 4). (2) El haz polarizado (por ejemplo, momentos magnéticos de neutrones) se vuelve perpendicular a las líneas del campo magnético del primer imán (primera zona de precesión, posición 5) y comienza a precesar. (3) Al final del imán, los espines de neutrones acumulan un cierto ángulo de precesión proporcional a la intensidad del campo magnético y al tiempo de vuelo pasado en su interior (básicamente inversamente proporcional a la velocidad del neutrón). Las velocidades de neutrones individuales están codificadas dentro de su ángulo de precesión al final de la primera zona de precesión. (4) Cerca de la posición de la muestra, el pi-flipper (posición 6) invierte la orientación del espín en 180°, cambiando el signo del ángulo de precesión. (5) Los neutrones interactúan con las moléculas de la muestra (posición 7) y se dispersan. (6) Los neutrones dispersos entran y precesan en la segunda zona de precesión (posición 8) pero se orientan hacia atrás. (7) Se utiliza otra aleta pi-half (posición 9) para girar la orientación del giro de perpendicular a la dirección horizontal. Esto detendrá la precesión, traduciendo el ángulo de precesión φ en polarización proporcional a cos(φ). (8) El analizador (posición 10) selecciona los neutrones en función de una orientación. Si la interacción con la muestra es elástica, la velocidad del neutrón no cambiará. Los neutrones pasarán una cantidad idéntica de tiempo volando en la primera y segunda zonas de precesión, y los ángulos de precesión acumulados se recuperan por completo. La polarización completa se restaura en el detector (posición 11) como un eco de la polarización original (es decir, espín-eco). (9) Sin embargo, en NSE, la dispersión es cuasi elástica, por lo que un pequeño intercambio de energía entre neutrones y moléculas de muestra conduce a diferentes velocidades de neutrones después de la dispersión por la muestra. Debido a las diferentes velocidades, los neutrones pasarán un tiempo adicional volando a través de la segunda zona de precesión y no habrán recuperado adecuadamente su ángulo de precesión. Se recupera una polarización parcial en el detector, y la pérdida de polarización debido a la relajación del espín es proporcional a la transformada cos-Fourier de la función espectral S(Q, ω), la función de dispersión intermedia F(Q, t). (10) El parámetro de tiempo de la función F(Q, t) es proporcional a la intensidad del campo magnético de precesión. El escaneo de la pérdida de polarización en función de la intensidad del campo magnético produce, por lo tanto, una función de relajación que depende de los procesos dinámicos dentro de la muestra.

Figura 1: Fotografía del espectrómetro NSE en SNS (SNS-NSE) y esquema de trayectoria de vuelo de neutrones con los componentes funcionales más importantes. De derecha a izquierda: 1 = fuente de neutrones; 2 = choppers-bender-polarizador-sistema de obturador secundario; 3 = guías de transporte de vigas; 4 = pi/2 flipper para el primer giro de 90°; 5 = primera zona de precesión; 6 = pi flipper para 180° spin-turn; 7 = área de muestra y entorno de muestra (aquí, se muestra el crio-horno); 8 = segunda zona de precesión; 9 = pi/2 flipper para el segundo giro de 90°; 10 = analizador; 11 = detector. (Tenga en cuenta que las porciones de 3, así como 2 y 1, están situadas detrás de la pared azul dentro del blindaje; los helicópteros se reemplazan por un selector de velocidad para NSE basado en reactores). Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
La espectroscopia NSE ofrece una visión única y detallada de la dinámica de las proteínas, que otras técnicas espectroscópicas no pueden producir. Las mediciones a lo largo de una escala de tiempo extendida proporcionan observaciones de la difusión traslacional y rotacional de las proteínas, como se presenta aquí. La dinámica segmentaria y otras oscilaciones internas se revelan como una fuerte desintegración de la función de dispersión coherente S(Q, t) en una escala de tiempo corta y están bien se…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación utilizó recursos en la Fuente de Neutrones de Espalación (BL-15, BL-6, laboratorios de Biología y Química), una Oficina del DOE de la Instalación de Usuarios de Ciencia operada por el Laboratorio Nacional de Oak Ridge. Esta investigación también utilizó recursos en el reactor MLZ-FRM2 Garching (KWS-2, Phoenix-J-NSE) y el JCNS1 en Forschungszentrum Jülich GmbH, Alemania. El autor reconoce al Dr. Ralf Biehl y al Dr. Andreas Stadler por su ayuda con el modelado y su contribución a la investigación de proteínas IgG y MBP, al Dr. Piotr A. Żołnierczuk por el apoyo a la reducción de datos de NSE, al Dr. Changwoo Do por su apoyo con las mediciones de SANS, y a Rhonda Moody y al Dr. Kevin Weiss por el apoyo del laboratorio de bioquímica de SNS.
Materials
| Bovine MBP protein solution | Sigma-Aldrich | M1891 | lyophilized powder reconstituted in D2O |
| D2O – heavy water | Sigma-Aldrich | Product No. 151882 | liquid |
| Dionized water | in house | – | for washing / cleanning cells |
| DLS instrument | Zetasizer Nano ZS, FZ-Jülich | – | dynamic light scattering instrument |
| Elastic scattering standards | SNS-NSE, ORNL | – | Al2O3 and Graphite powders |
| Ethanol | Sigma-Aldrich | 65350-M | 70% ethanol for cleaning cells |
| IgG protein solution | Sigma-Aldrich | I4506 | lyophilized powder reconstituted in D2O |
| KWS-2 instrument | JCNS outstation at the MLZ, Garching, Germany | – | small angle neutron instrument |
| Liquinox dish detergent | Alconox | – | Phosphate-free liquid lab glassware cleaner |
| Na2HPO4·7H2O | Sigma-Aldrich | Product No.S9390 | disodium phosphate heptahydrate salt |
| NaCl | Sigma-Aldrich | Product No.S9888 | sodium chloride salt |
| NaH2PO4·H2O | Sigma-Aldrich | Product No. S9638 | monosodium phosphate monohydrate salt |
| Nanodrop spectrophotometer | Thermo Scientific | Catalog number: ND-2000 | NanoDrop 2000/2000c Spectrophotometer |
| Neutron alignment camera | NeutronOptics, Grenoble | NOG210222 | 100 x 100 mm camera with Sony IMX249 CMOS sensor |
| Parafilm M – wax parafilm | Bemis | Parafilm M – 5259-04LC PM996 | all-purpose laboratory film in cardboard dispenser |
| Phoenix-J-NSE Spectrometer | JCNS outstation at the MLZ, Garching, Germany | – | neutron spectrometer |
| SasView | https://www.sasview.org/ | ||
| SAXSpace, Anton Paar instrument | FZ-Jülich | – | small angle x-ray instrument |
| Slide-A-Lyzer dialysis membranes | Thermo Scientific | 88400-88405 | Slide-A-Lyzer mini dialysis devices tubes of 3.5 K MWCO |
| SNS Remote Analysis Cluster | Neutron Science Remote Analysis (sns.gov) | https://analysis.sns.gov | |
| SNS-NSE spectrometer | ORNL, Oak Ridge, TN, USA | – | neutron spectrometer |
| Sterile syringe filters | VWR | N.A. PN:28145-501 | 0.2 µm pore size filters |
| Temperature Forcing System (TFS) | SP Scientific | Part Number 100004055 | sample environment equipment |
| Urea -d4 | Sigma-Aldrich | Product No. 176087 | deuterated Urea salt |
| Viscometer | FZ-Jülich | – | falling ball viscometer |
References
- Fitter, J., Gutberlet, T., Katsaras, J. . Neutron Scattering in Biology: Techniques and Applications. , (2006).
- Stadler, A., Monkenbusch, M., Biehl, R., Richter, D., Ollivier, J. Neutron spin-echo and TOF reveals protein dynamics in solution. Journal of the Physical Society of Japan. 82, (2013).
- Inoue, R. Large domain fluctuations on 50-ns timescale enable catalytic activity in phosphoglycerate kinase. Biophysical Journal. 99 (7), 2309-2317 (2010).
- Callaway, D. J. E., et al. Controllable activation of nanoscale dynamics in a disordered protein alters binding kinetics. Journal of Molecular Biology. 429 (7), 987-998 (2017).
- Stingaciu, L. R., Biehl, R., Changwoo, D., Richter, D., Stadler, A. M. Reduced internal friction by osmolyte interaction in intrinsically disordered myelin basic protein. Journal of Physical Chemistry Letters. 11 (1), 292-296 (2020).
- Monkenbusch, M., Richter, D. High resolution neutron spectroscopy-a tool for the investigation of dynamics of polymers and soft matter. Comptes Rendus Physique. , (2007).
- Richter, D., Monkenbusch, M., Schwahn, D. Neutron Scattering. Polymer Science: A Comprehensive Reference, 10 Volume Set. , (2012).
- Wilson, C. C. . Single Crystal Neutron Diffraction From Molecular Materials. , (2000).
- Marshall, W. . Theory of thermal neutron scattering. , (1971).
- . Roger Pynn Introduction & Neutron Scattering "Theory" Available from: https://neutrons.ornl.gov/sites/default/files/intro_to_neutron_scattering.pdf (2004)
- Richter, D. Neutron scattering in polymer physics. Physica B: Condensed Matter. 276-278, 22-29 (2000).
- Harroun, T. A., Wignall, G. D., Katsaras, J. Neutron scattering for biology. Neutron Scattering in Biology. , (2006).
- . SNS Available from: https://neutrons.ornl.gov/sna (2020)
- . HFIR Available from: https://neutrons.ornl.gov/hfir (2020)
- . CNCS Available from: https://neutrons.ornl.gov/cncs (2020)
- Perticaroli, S., et al. Description of hydration water in protein (green fluorescent protein) solution. Journal of the American Chemical Society. 139 (3), 1098-1105 (2017).
- Perticaroli, S., Nickels, J. D., Ehlers, G., Sokolov, A. P. Rigidity, secondary structure, and the universality of the boson peak in proteins. Biophysical Journal. 106 (12), 2667-2674 (2014).
- Miao, Y., et al. Coupled flexibility change in cytochrome p450cam substrate binding determined by neutron scattering, NMR, and molecular dynamics simulation. Biophysical Journal. 103 (10), 2167-2176 (2012).
- Mamontov, E., Zamponi, M., Hammons, S., Keener, W. S., Hagen, M., Herwig, K. W. BASIS: A new backscattering spectrometer at the SNS. Neutron News. 19 (3), 22-24 (2008).
- Mamontov, E. Microscopic diffusion processes measured in living planarians. Scientific Reports. 9, 8708 (2018).
- Alpert, Y., Cser, L., Faragó, B., Franěk, F., Mezei, F., Ostanevich, Y. M. Segmental flexibility in pig immunoglobulin G studied by neutron spin-echo technique. Biopolymers. 24 (9), 1769-1784 (1985).
- Bu, Z., Biehl, R., Monkenbusch, M., Richter, D., Callaway, D. J. E. Coupled protein domain motion in Taq polymerase revealed by neutron spin-echo spectroscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (49), 17646-17651 (2005).
- Biehl, R., et al. Direct observation of correlated interdomain motion in alcohol dehydrogenase. Physical Review Letters. 101, 138102 (2008).
- Farago, B., Li, J., Cornilescu, G., Callaway, D. J. E., Bu, Z. Activation of nanoscale allosteric protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 99 (10), 3473-3482 (2010).
- Bu, Z., Callaway, D. J. E. Dynamic propagation of long-range allosteric signals by nanoscale protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 100 (3), 223 (2011).
- Hong, L., et al. Structure and dynamics of a compact state of a multidomain protein, the mercuric ion reductase. Biophysical Journal. 107 (2), 393-400 (2014).
- Longeville, S., Stingaciu, L. -. R. Hemoglobin diffusion and the dynamics of oxygen capture by red blood cells. Scientific Reports. 7, 10448 (2017).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Hahn, E. L. Nuclear induction due to free larmor precession. Physical Review. 77, 297 (1950).
- Hahn, E. L. Spin echoes. Physical Review. 80, 580 (1950).
- Svergun, D. I., Koch, M. H. J. Small-angle scattering studies of biological macromolecules in solution. Reports on Progress in Physics. 66 (10), 1735-1782 (2003).
- . Sasview Available from: https://www.sasview.org (2020)
- Zhao, J. K., Gao, C. Y., Liu, D. The extended Q-range small-angle neutron scattering diffractometer at the SNS. Journal of Applied Crystallography. 43, 1068-1077 (2010).
- Ohl, M., et al. The high-resolution neutron spin-echo spectrometer for the SNS with τ ≥ 1 µs. Physica B: Condensed Matter. 350, 147-150 (2004).
- . SNS-NSE web page Available from: https://neutrons.ornl.gov/nse (2022)
- Ohl, M., et al. The spin-echo spectrometer at the Spallation Neutron Source (SNS). Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 696, 85-99 (2012).
- Zolnierczuk, P. A., Holderer, O., Pasini, S., Kozielewski, T., Stingaciu, L. R., Monkenbusch, M. Efficient data extraction from neutron time-of-flight spin-echo raw data. Journal of Applied Crystallography. 52 (5), 1022-1034 (2019).
- . Dr Spine hub Available from: https://jugit.fz-juelich.de/nse/drspine (2022)
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), (2014).
- . FZJ Available from: https://www.fz-juelich.de/portal/EN/AboutUs (2022)
- . KWS2 Available from: https://miz-garching.de/kws-2 (2022)
- Moorhouse, M., Barry, P. The protein databank. Bioinformatics Biocomputing and Perl. , (2005).
- Tria, G., Mertens, H. D. T., Kachala, M., Svergun, D. I. Advanced ensemble modelling of flexible macromolecules using X-ray solution scattering. IUCrJ. 2 (2), 207-217 (2015).
- Holderer, O., Monkenbusch, M., Schätzler, R., Kleines, H., Westerhausen, W., Richter, D. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 90 (4), 043107 (2008).
- Biehl, R., Monkenbusch, M., Richter, D. Exploring internal protein dynamics by neutron spin echo spectroscopy. Soft Matter. 7 (4), 1299-1307 (2011).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), 6987-6994 (2014).
- Biehl, R., Richter, D. Slow internal protein dynamics in solution. Journal of Physics: Condensed Matter. 26 (50), 503103 (2014).
- Hinsen, K. The molecular modeling toolkit: A new approach to molecular simulations. Journal of Computational Chemistry. 21 (2), 79-85 (2000).
- Uhlenbeck, G. E., Ornstein, L. S. On the theory of the Brownian motion. Physical Review. 36 (5), 823 (1930).
- Wang, M. C., Uhlenbeck, G. E. On the theory of the Brownian motion II. Reviews of Modern Physics. 17, 323 (1945).
- Callaway, D. J. E., Bu, Z. Nanoscale protein domain motion and long-range allostery in signaling proteins-a view from neutron spin echo spectroscopy. Biophysical Reviews. 7 (2), 165-174 (2015).
- Liu, Y. Intermediate scattering function for macromolecules in solution probed by neutron spin echo. Physical Review E. 95, 020501 (2017).
- Liu, Y. Short-time dynamics of proteins in solutions studied by neutron spin echo. Current Opinion in Colloid & Interface Science. 42, 147-156 (2019).

