Studie av proteindynamik via neutronspinnekospektroskopi
Summary
Föreliggande protokoll beskriver metoder för att undersöka strukturen och dynamiken hos två modellproteiner som har en viktig roll för människors hälsa. Tekniken kombinerar biofysisk karakterisering med neutronspinneko-spektroskopi för att komma åt dynamiken vid tids- och längdskalor som är relevanta för proteininterdomainrörelser.
Abstract
De flesta mänskliga kroppsproteiners aktivitet och funktionalitet är relaterade till konfigurationsförändringar av hela underdomäner inom proteinkristallstrukturen. Kristallstrukturerna bygger grunden för varje beräkning som beskriver strukturen eller dynamiken hos ett protein, för det mesta med starka geometriska begränsningar. Dessa begränsningar från kristallstrukturen är emellertid inte närvarande i lösningen. Strukturen hos proteinerna i lösningen kan skilja sig från kristallen på grund av omarrangemang av slingor eller underdomäner på pico till nanosekund tidsskala (dvs den interna proteindynamikens tidsregim). Det aktuella arbetet beskriver hur slow motions på tidsskalor på flera tiotals nanosekunder kan nås med hjälp av neutronspridning. I synnerhet behandlas den dynamiska karakteriseringen av två stora humana proteiner, ett inneboende oordnat protein som saknar en väldefinierad sekundär struktur och ett klassiskt antikroppsprotein, med neutronspinnekospektroskopi (NSE) kombinerat med ett brett spektrum av laboratoriekarakteriseringsmetoder. Ytterligare insikter i proteindomändynamik uppnåddes med hjälp av matematisk modellering för att beskriva experimentella neutrondata och bestämma korsningen mellan kombinerade diffusiva och interna proteinrörelser. Extraktionen av det interna dynamiska bidraget till den mellanliggande spridningsfunktionen erhållen från NSE, inklusive tidsskalan för de olika rörelserna, möjliggör ytterligare syn på de mekaniska egenskaperna hos enskilda proteiner och mjukheten hos proteiner i deras nästan naturliga miljö i den trånga proteinlösningen.
Introduction
Sonderingsdynamik av mjuk materia med neutroner
Att undersöka de dynamiska egenskaperna hos proteiner och peptider är en stor del av den biofysiska forskningen, och många välutvecklade metoder finns idag för att komma åt ett brett spektrum av energilandskap1. Att relatera den experimentellt avslöjade dynamiken hos proteinerna till deras biologiska funktion är en mycket svårare uppgift som kräver komplexa matematiska modeller och datorstödda dynamiksimuleringar. Neutronspektroskopins betydelse för analys av proteinrörelser har betonats i flera väl mottagna och allmänt erkända studier 1,2,3,4,5. Innan du utforskar det olika energilandskapet för intern proteindynamik krävs en kort översikt över de dynamiska processerna i mjuk materia och hur neutroner kan komma åt dem.
Neutronernas känslighet för isotopkonfiguration och den typ av interaktioner de visar med mjuk materia gör neutronspridning till en av de mest mångsidiga undersökningsteknikerna6. Det finns ett brett spektrum av korrelationslängdsskalor och korrelationstider som neutroner kan komma åt, från kärnexcitationer och atomvibrationer till kollektiva rörelser och långsamma avslappningsprocesser som isotropa rotationer och diffusiva rörelser. När man undersöker de spridda neutronerna för deras energiöverföring kan tre huvudinteraktioner särskiljas: den elastiska spridningen, där det inte finns något energiutbyte mellan inkommande neutron och partikel i provet; den oelastiska spridningen, med ett stort, kvantifierbart energiutbyte mellan neutron och partikel; och det märkliga fallet med kvasielastisk spridning som betecknar en mycket liten energiöverföring jämfört med den infallande neutronenergin 1,7. Dessa interaktioner ger exakt information om det undersökta materialet och utgör den teoretiska grunden för en mängd olika neutronspridningstekniker.
Vid elastisk spridning registrerar detektorn neutronernas riktningar som ett diffraktionsmönster, vilket visar provatomernas position i förhållande till varandra. Information om korrelationerna mellan atompositioner förvärvas (dvs integrerad intensitet S(Q) avseende momentumöverföringen Q, som avser enbart strukturell information). Denna princip utgör grunden för neutrondiffraktion8.
Komplexitet uppstår när energiöverföringen inte längre är noll på grund av excitationer och inre fluktuationer i provmaterialet. Detta ligger till grund för neutronspektroskopi, där de spridda neutronerna undersöks som en funktion av både energiöverföringen E och momentumöverföringen Q. Dynamisk och strukturell information erhålls. Neutronspektroskopi mäter samma integrerade intensitet S(Q) för energiöverföring (dvs. hastighetsförändring av neutronerna på grund av provspridning, S(Q,ω) = S(Q, E), som också kallas den dynamiska strukturfaktorn)9.
För att beräkna spridningen från ett material är det mer lämpligt att använda parkorrelationsfunktionen 7,10. I diffraktionsfallet ger den statiska parkorrelationsfunktionen G(r) sannolikheten att hitta mitten av en partikel på ett givet avstånd r från mitten av en annan partikel. Spektroskopin generaliserar den statiska parkorrelationsfunktionen och inkluderar energi/frekvens/tid i spridningsekvationen. Parkorrelationsfunktionen G(r) blir en funktion av tiden G(r, t), som kan sönderdelas i en distinkt atomparkorrelationsfunktion GD(r, t) och en självkorrelationsfunktion GS(r, t). Dessa beskriver två typer av korrelationer: parkorrelerade rörelser av atomer som styr den koherenta spridningen och självkorrelation som styr den osammanhängande spridningen10.
Koherent spridning är spridningen från “genomsnittet” och beror på den relativa fasen av de spridda vågorna. I spridningsregimen med liten vinkel stör de spridda neutronvågorna från olika spridningscentra (olika atomer) konstruktivt (har liknande faser), och atomernas kollektiva rörelse observeras med stark intensitetsförbättring. Koherent spridning beskriver väsentligen spridningen av en enda neutron från alla kärnor i provet10.
När ingen konstruktiv interferens inträffar mellan de spridda neutronvågorna från olika centra följs en enda atom i tid och självkorrelationen mellan atomens position vid tiden t = 0 och samma atom vid tiden t observeras. Således förloras informationen om atomernas relativa positioner, och fokus ligger endast på lokala fluktuationer. Spridning från lokala fluktuationer styr osammanhängande spridning. Osammanhängande spridning är isotrop, bidrar till bakgrundssignalen och försämrarsignal-bruset 10,11.
Genom att kombinera alla ovanstående skiljer vi fyra stora neutronspridningsprocesser10: (1) elastisk koherent (mäter korrelationerna mellan atompositioner), (2) oelastisk koherent (mäter atomers kollektiva rörelser), (3) elastisk osammanhängande (bidrar till bakgrunden, minskar spridningsintensiteten med Debye-Waller-faktor (DWF) och mäter elastisk osammanhängande strukturfaktor (EISF), som beskriver geometrin för diffusiva rörelser i begränsad geometri, och (4) oelastisk osammanhängande (mäter enatomdynamik och självkorrelation).
Dynamikprocesser som neutroner kan komma åt i biologi sträcker sig från dämpning av lågfrekventa atom- och molekylära vibrationer, interaktionen mellan lösningsmedelsmolekyler och bioytor och diffusionsprocesser i hydratiseringsskiktet av makromolekyler och begränsad geometri, till kortdistans translationella, roterande och tumlande diffusiva rörelser och proteindomäner och allosteriska rörelser1 . Den stora mångfalden av neutronmetoder och instrument för att mäta proteindynamik baseras på hur akromatiseringen av den infallande eller utgående neutronstrålen uppnås och hur energianalysen av de spridda neutronerna utförs. Från trippelaxel till flygtid, backscattering och spin-echo-spektrometrar kan man utforska dynamiska processer med karakteristiska tider mellan 1 x 10-14 s och 1 x 10-6 s (femtosekunder till mikrosekunder)12.
Oak Ridge National Laboratory, med sina två kända neutronkällor, Spallation Neutron Source – SNS13 och High Isotope Flux Reactor – HFIR14, har en av de bästa sviterna av spektrometrar för att undersöka dynamik i biomaterial. Några av de mest vältaliga exemplen inkluderar användningen av den kalla neutronhackspektrometern (CNCS) vid SNS15 för att undersöka den dynamiska störningen av hydratiseringsvatten runt grönt fluorescerande protein i lösning16 eller de subpikosekunds kollektiva vibrationerna hos flera proteiner17. Ett återkommande problem med oelastiska neutronspridningsundersökningar är att vissa biologiska processer är för långsamma för att kunna observeras. Utan extrema inställningar som leder till en enorm förlust av neutronintensitet är flygtidsspektrometrar begränsade till 10 μeV energiupplösning, vilket motsvarar en maximal tidsskala på ~ 200 ps10,11. Detta är inte tillräckligt för att observera storskaliga rörelser i proteiner. Därför behövs ofta instrument med högre energiupplösning som bakåtspridningsspektrometrarna. Att kombinera time-of-flight och backscattering-tekniker har visat sig vara kraftfullt för att undersöka förändringen i den inre dynamiken hos Cytochrome P450cam (CYP101), ett enzym som katalyserar hydroxyleringskavfern18.
Mikroskopisk diffusivitet mätt med backscatteringsspektrometern vid SNS-BASIS19 var förvånansvärt väldefinierad och kunde separeras i diffusiviteten hos vatten (hydrering, cytoplasmatisk och bulkliknande vatten) och diffusiviteten hos cellbeståndsdelar i planariska plattmaskar, det första levande djuret som studerades genom neutronspridning20 . Backscattering är en högupplöst spektroskopisk teknik, men den är också begränsad till flera μeV = flera nanosekunder, medan den långsamma dynamiken i biomaterial också manifesteras som överlevnadstiden för korrelation mellan atomposition eller spinnorienteringar (t.ex. avslappningsprocesser, som regelbundet händer i tidsintervallet tio till hundratals nanosekunder).
Neutronspinneko spektroskopi (NSE) är den enda neutronspridningstekniken som når så hög upplösning. Till skillnad från andra neutrontekniker kräver NSE inte akromatisering av strålen eftersom den använder neutronernas kvantmekaniska fas, vilket är deras magnetiska ögonblick. Manipuleringen av magnetiska ögonblick möjliggör användning av en bred neutronstrålevåglängdsfördelning, medan tekniken är känslig för mycket små neutronhastighetsförändringar i storleksordningen 1 x 10-4. NSE har framgångsrikt använts för att undersöka den långsamma dynamiken hos proteiner i lösning för många proteiner. Bland dessa många pionjärstudier erkänner vi studien av segmentflexibiliteten hos grisimmunoglobulin21; de kopplade domänrörelserna i Taq-polymeras22; domänrörelserna i tetrameren av jästalkoholdehydrogenas23; förändringen av konformationen i fosfoglyceratkinas vid substratbindning3; aktivering av domänrörelser och dynamisk förökning av allosteriska signaler i Na+/H+ utbytesreglerande kofaktor 1 (NHERF1) protein 4,24,25; dynamiken i ett kompakt tillstånd av kvicksilverjonreduktas26; och diffusion av hemoglobin i röda blodkroppar27. Två nyare studier inom proteindynamik har avslöjat flexibiliteten hos humant antikroppsimmunglobulin G (IgG) som en entropisk fjäder28 och egenskaperna hos lösningsmedelsbidrag till dynamiken hos inneboende oordnat myelinbasprotein (MBP)5.
Den här artikeln förklarar de grundläggande principerna för NSE, de flera förberedande metoder som rekommenderas för en grundlig proteindynamikundersökning, samt metodiken och det experimentella protokollet för NSE-datainsamling vid NSE-spektrometern vid SNS, SNS-NSE. Protokollet karakteriserar två proteiner: IgG, ett vanligt humant antikroppsprotein, och det inneboende oordnade proteinet MBP. De biofysiska implikationerna, exemplens forskningsrelevans och teknikens begränsningar diskuteras kortfattat.
NSE-spektroskopi, metoden för långsam dynamikmätning
NSE är en polariserad teknik som använder neutron-flygtid för att mäta utbytet av energi (förlust av polarisation) på grund av den kvasielastiska interaktionen mellan neutroner och atomer i ett prov. Kärnan i NSE-spektroskopi ligger två grundläggande principer: (1) neutronspinnets förmåga att precessa i magnetfältet med en frekvens som är proportionell mot magnetisk styrka 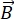 , nämligen Larmor-frekvensen29, och (b) spinn-ekot eller Hann-ekot, som representerar manipulering och omfokusering av polarisationssignalen vid applicering av en serie radiofrekvenspulser30.
, nämligen Larmor-frekvensen29, och (b) spinn-ekot eller Hann-ekot, som representerar manipulering och omfokusering av polarisationssignalen vid applicering av en serie radiofrekvenspulser30.
Grunderna i NSE-processen kan sammanfattas i några enkla steg 6,11 med hjälp av figur 1. (1) Neutronstrålen som produceras av källan (position 1) polariseras (position 2), styrs och transporteras (position 3) och anländer till ingången till NSE-spektrometern, där den roteras med 90 ° av den första pi-halva flippern (position 4). (2) Den polariserade strålen (t.ex. neutronmagnetiska ögonblick) blir vinkelrät mot den första magnetens magnetfältlinjer (första precessionszonen, position 5) och börjar precessa. (3) I slutet av magneten ackumulerar neutronspinn en viss precessionsvinkel som är proportionell mot magnetfältstyrkan och flygtiden som spenderas inuti (i princip omvänt proportionell mot neutronhastigheten). De enskilda neutronhastigheterna kodas inom sin precessionsvinkel i slutet av den första precessionszonen. (4) Nära provpositionen vänder pi-flippern (position 6) rotationsorienteringen med 180 °, vilket ändrar tecknet på precessionsvinkeln. (5) Neutronerna interagerar med provets molekyler (position 7) och sprids. (6) De spridda neutronerna kommer in och föregår i den andra precessionszonen (position 8) men blir omvända. (7) En annan pi-halv flipper (position 9) används för att rotera rotationsorienteringen från vinkelrätt mot horisontell riktning. Detta kommer att stoppa precessionen, översätta precessionsvinkeln φ till polarisering proportionell mot cos (φ). (8) Analysatorn (position 10) väljer neutronerna baserat på en orientering. Om interaktionen med provet är elastisk kommer neutronens hastighet inte att förändras. Neutronerna kommer att spendera lika mycket tid på att flyga i de första och andra precessionszonerna, och de ackumulerade precessionsvinklarna återvinns helt. Den fulla polarisationen återställs på detektorn (position 11) som ett eko av den ursprungliga polarisationen (dvs spin-echo). (9) I NSE är dock spridningen kvasielastisk, så ett litet energiutbyte mellan neutroner och provmolekyler leder till olika neutronhastigheter efter spridning av provet. På grund av de olika hastigheterna kommer neutronerna att spendera ytterligare tid på att flyga genom den andra precessionszonen och kommer inte att ha återhämtat sin precessionsvinkel ordentligt. En partiell polarisation hämtas på detektorn, och förlusten av polarisation på grund av spinnavslappning är proportionell mot cos-Fourier-transformen av spektralfunktionen S(Q, ω), den mellanliggande spridningsfunktionen F(Q, t). (10) Tidsparametern för funktionen F(Q, t) är proportionell mot precessionens magnetfältstyrka. Skanning av förlusten av polarisation som en funktion av magnetfältstyrkan ger därför en avslappningsfunktion som beror på de dynamiska processerna i provet.

Figur 1: Fotografi av NSE-spektrometern vid SNS (SNS-NSE) och neutronflugvägsschematiskt med de viktigaste funktionella komponenterna. Från höger till vänster: 1 = neutronkälla; 2 = choppers-bender-polarisator-sekundär slutarsystem; 3 = stråltransportstyrningar; 4 = pi/2 flipper för första 90° spin-turn; 5 = första precessionszonen; 6 = pi flipper för 180° spin-turn; 7 = provarea och provmiljö (här visas kryougnen); 8 = andra precessionszonen; 9 = pi/2 flipper för andra 90° spin-turn; 10 = analysator; 11 = detektor. (Observera att delar av 3, samt 2 och 1 ,är placerade bakom den blå väggen inuti avskärmningen; hackarna ersätts av en hastighetsväljare för reaktorbaserad NSE). Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
NSE-spektroskopi ger en unik och detaljerad bild av proteinernas dynamik, som andra spektroskopiska tekniker inte kan producera. Mätningar över en längre tidsskala ger observationer av både proteinernas translationella och rotationsdiffusion, som presenteras här. Segmentdynamiken och andra interna svängningar avslöjar sig som ett starkt sönderfall av den koherenta spridningsfunktionen S(Q, t) på en kort tidsskala och är väl separerade från de övergripande diffusionsavslappningsprocesserna. De viktig…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denna forskning använde resurser vid Spallation Neutron Source (BL-15, BL-6, Biology and Chemistry labs), ett DOE-kontor för Science User Facility som drivs av Oak Ridge National Laboratory. Denna forskning använde också resurser vid MLZ-FRM2-reaktorn Garching (KWS-2, Phoenix-J-NSE) och JCNS1 vid Forschungszentrum Jülich GmbH, Tyskland. Författaren erkänner Dr. Ralf Biehl och Dr. Andreas Stadler för deras hjälp med modellering och deras bidrag till både IgG- och MBP-proteinforskning, Dr. Piotr A. Żołnierczuk för NSE-datareduktionsstöd, Dr. Changwoo Do för stöd med SANS-mätningar och Rhonda Moody och Dr. Kevin Weiss för SNS-biokemilabbstöd.
Materials
| Bovine MBP protein solution | Sigma-Aldrich | M1891 | lyophilized powder reconstituted in D2O |
| D2O – heavy water | Sigma-Aldrich | Product No. 151882 | liquid |
| Dionized water | in house | – | for washing / cleanning cells |
| DLS instrument | Zetasizer Nano ZS, FZ-Jülich | – | dynamic light scattering instrument |
| Elastic scattering standards | SNS-NSE, ORNL | – | Al2O3 and Graphite powders |
| Ethanol | Sigma-Aldrich | 65350-M | 70% ethanol for cleaning cells |
| IgG protein solution | Sigma-Aldrich | I4506 | lyophilized powder reconstituted in D2O |
| KWS-2 instrument | JCNS outstation at the MLZ, Garching, Germany | – | small angle neutron instrument |
| Liquinox dish detergent | Alconox | – | Phosphate-free liquid lab glassware cleaner |
| Na2HPO4·7H2O | Sigma-Aldrich | Product No.S9390 | disodium phosphate heptahydrate salt |
| NaCl | Sigma-Aldrich | Product No.S9888 | sodium chloride salt |
| NaH2PO4·H2O | Sigma-Aldrich | Product No. S9638 | monosodium phosphate monohydrate salt |
| Nanodrop spectrophotometer | Thermo Scientific | Catalog number: ND-2000 | NanoDrop 2000/2000c Spectrophotometer |
| Neutron alignment camera | NeutronOptics, Grenoble | NOG210222 | 100 x 100 mm camera with Sony IMX249 CMOS sensor |
| Parafilm M – wax parafilm | Bemis | Parafilm M – 5259-04LC PM996 | all-purpose laboratory film in cardboard dispenser |
| Phoenix-J-NSE Spectrometer | JCNS outstation at the MLZ, Garching, Germany | – | neutron spectrometer |
| SasView | https://www.sasview.org/ | ||
| SAXSpace, Anton Paar instrument | FZ-Jülich | – | small angle x-ray instrument |
| Slide-A-Lyzer dialysis membranes | Thermo Scientific | 88400-88405 | Slide-A-Lyzer mini dialysis devices tubes of 3.5 K MWCO |
| SNS Remote Analysis Cluster | Neutron Science Remote Analysis (sns.gov) | https://analysis.sns.gov | |
| SNS-NSE spectrometer | ORNL, Oak Ridge, TN, USA | – | neutron spectrometer |
| Sterile syringe filters | VWR | N.A. PN:28145-501 | 0.2 µm pore size filters |
| Temperature Forcing System (TFS) | SP Scientific | Part Number 100004055 | sample environment equipment |
| Urea -d4 | Sigma-Aldrich | Product No. 176087 | deuterated Urea salt |
| Viscometer | FZ-Jülich | – | falling ball viscometer |
References
- Fitter, J., Gutberlet, T., Katsaras, J. . Neutron Scattering in Biology: Techniques and Applications. , (2006).
- Stadler, A., Monkenbusch, M., Biehl, R., Richter, D., Ollivier, J. Neutron spin-echo and TOF reveals protein dynamics in solution. Journal of the Physical Society of Japan. 82, (2013).
- Inoue, R. Large domain fluctuations on 50-ns timescale enable catalytic activity in phosphoglycerate kinase. Biophysical Journal. 99 (7), 2309-2317 (2010).
- Callaway, D. J. E., et al. Controllable activation of nanoscale dynamics in a disordered protein alters binding kinetics. Journal of Molecular Biology. 429 (7), 987-998 (2017).
- Stingaciu, L. R., Biehl, R., Changwoo, D., Richter, D., Stadler, A. M. Reduced internal friction by osmolyte interaction in intrinsically disordered myelin basic protein. Journal of Physical Chemistry Letters. 11 (1), 292-296 (2020).
- Monkenbusch, M., Richter, D. High resolution neutron spectroscopy-a tool for the investigation of dynamics of polymers and soft matter. Comptes Rendus Physique. , (2007).
- Richter, D., Monkenbusch, M., Schwahn, D. Neutron Scattering. Polymer Science: A Comprehensive Reference, 10 Volume Set. , (2012).
- Wilson, C. C. . Single Crystal Neutron Diffraction From Molecular Materials. , (2000).
- Marshall, W. . Theory of thermal neutron scattering. , (1971).
- . Roger Pynn Introduction & Neutron Scattering "Theory" Available from: https://neutrons.ornl.gov/sites/default/files/intro_to_neutron_scattering.pdf (2004)
- Richter, D. Neutron scattering in polymer physics. Physica B: Condensed Matter. 276-278, 22-29 (2000).
- Harroun, T. A., Wignall, G. D., Katsaras, J. Neutron scattering for biology. Neutron Scattering in Biology. , (2006).
- . SNS Available from: https://neutrons.ornl.gov/sna (2020)
- . HFIR Available from: https://neutrons.ornl.gov/hfir (2020)
- . CNCS Available from: https://neutrons.ornl.gov/cncs (2020)
- Perticaroli, S., et al. Description of hydration water in protein (green fluorescent protein) solution. Journal of the American Chemical Society. 139 (3), 1098-1105 (2017).
- Perticaroli, S., Nickels, J. D., Ehlers, G., Sokolov, A. P. Rigidity, secondary structure, and the universality of the boson peak in proteins. Biophysical Journal. 106 (12), 2667-2674 (2014).
- Miao, Y., et al. Coupled flexibility change in cytochrome p450cam substrate binding determined by neutron scattering, NMR, and molecular dynamics simulation. Biophysical Journal. 103 (10), 2167-2176 (2012).
- Mamontov, E., Zamponi, M., Hammons, S., Keener, W. S., Hagen, M., Herwig, K. W. BASIS: A new backscattering spectrometer at the SNS. Neutron News. 19 (3), 22-24 (2008).
- Mamontov, E. Microscopic diffusion processes measured in living planarians. Scientific Reports. 9, 8708 (2018).
- Alpert, Y., Cser, L., Faragó, B., Franěk, F., Mezei, F., Ostanevich, Y. M. Segmental flexibility in pig immunoglobulin G studied by neutron spin-echo technique. Biopolymers. 24 (9), 1769-1784 (1985).
- Bu, Z., Biehl, R., Monkenbusch, M., Richter, D., Callaway, D. J. E. Coupled protein domain motion in Taq polymerase revealed by neutron spin-echo spectroscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (49), 17646-17651 (2005).
- Biehl, R., et al. Direct observation of correlated interdomain motion in alcohol dehydrogenase. Physical Review Letters. 101, 138102 (2008).
- Farago, B., Li, J., Cornilescu, G., Callaway, D. J. E., Bu, Z. Activation of nanoscale allosteric protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 99 (10), 3473-3482 (2010).
- Bu, Z., Callaway, D. J. E. Dynamic propagation of long-range allosteric signals by nanoscale protein domain motion revealed by neutron spin echo spectroscopy. Biophysical Journal. 100 (3), 223 (2011).
- Hong, L., et al. Structure and dynamics of a compact state of a multidomain protein, the mercuric ion reductase. Biophysical Journal. 107 (2), 393-400 (2014).
- Longeville, S., Stingaciu, L. -. R. Hemoglobin diffusion and the dynamics of oxygen capture by red blood cells. Scientific Reports. 7, 10448 (2017).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Hahn, E. L. Nuclear induction due to free larmor precession. Physical Review. 77, 297 (1950).
- Hahn, E. L. Spin echoes. Physical Review. 80, 580 (1950).
- Svergun, D. I., Koch, M. H. J. Small-angle scattering studies of biological macromolecules in solution. Reports on Progress in Physics. 66 (10), 1735-1782 (2003).
- . Sasview Available from: https://www.sasview.org (2020)
- Zhao, J. K., Gao, C. Y., Liu, D. The extended Q-range small-angle neutron scattering diffractometer at the SNS. Journal of Applied Crystallography. 43, 1068-1077 (2010).
- Ohl, M., et al. The high-resolution neutron spin-echo spectrometer for the SNS with τ ≥ 1 µs. Physica B: Condensed Matter. 350, 147-150 (2004).
- . SNS-NSE web page Available from: https://neutrons.ornl.gov/nse (2022)
- Ohl, M., et al. The spin-echo spectrometer at the Spallation Neutron Source (SNS). Nuclear Instruments and Methods in Physics Research, Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 696, 85-99 (2012).
- Zolnierczuk, P. A., Holderer, O., Pasini, S., Kozielewski, T., Stingaciu, L. R., Monkenbusch, M. Efficient data extraction from neutron time-of-flight spin-echo raw data. Journal of Applied Crystallography. 52 (5), 1022-1034 (2019).
- . Dr Spine hub Available from: https://jugit.fz-juelich.de/nse/drspine (2022)
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), (2014).
- . FZJ Available from: https://www.fz-juelich.de/portal/EN/AboutUs (2022)
- . KWS2 Available from: https://miz-garching.de/kws-2 (2022)
- Moorhouse, M., Barry, P. The protein databank. Bioinformatics Biocomputing and Perl. , (2005).
- Tria, G., Mertens, H. D. T., Kachala, M., Svergun, D. I. Advanced ensemble modelling of flexible macromolecules using X-ray solution scattering. IUCrJ. 2 (2), 207-217 (2015).
- Holderer, O., Monkenbusch, M., Schätzler, R., Kleines, H., Westerhausen, W., Richter, D. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 90 (4), 043107 (2008).
- Biehl, R., Monkenbusch, M., Richter, D. Exploring internal protein dynamics by neutron spin echo spectroscopy. Soft Matter. 7 (4), 1299-1307 (2011).
- Stingaciu, L. R., Ivanova, O., Ohl, M., Biehl, R., Richter, D. Fast antibody fragment motion: Flexible linkers act as entropic spring. Scientific Reports. 6, 22148 (2016).
- Stadler, A. M., et al. Internal nanosecond dynamics in the intrinsically disordered myelin basic protein. Journal of the American Chemical Society. 136 (19), 6987-6994 (2014).
- Biehl, R., Richter, D. Slow internal protein dynamics in solution. Journal of Physics: Condensed Matter. 26 (50), 503103 (2014).
- Hinsen, K. The molecular modeling toolkit: A new approach to molecular simulations. Journal of Computational Chemistry. 21 (2), 79-85 (2000).
- Uhlenbeck, G. E., Ornstein, L. S. On the theory of the Brownian motion. Physical Review. 36 (5), 823 (1930).
- Wang, M. C., Uhlenbeck, G. E. On the theory of the Brownian motion II. Reviews of Modern Physics. 17, 323 (1945).
- Callaway, D. J. E., Bu, Z. Nanoscale protein domain motion and long-range allostery in signaling proteins-a view from neutron spin echo spectroscopy. Biophysical Reviews. 7 (2), 165-174 (2015).
- Liu, Y. Intermediate scattering function for macromolecules in solution probed by neutron spin echo. Physical Review E. 95, 020501 (2017).
- Liu, Y. Short-time dynamics of proteins in solutions studied by neutron spin echo. Current Opinion in Colloid & Interface Science. 42, 147-156 (2019).

