Verwendung von perkutanen ventrikulären Unterstützungsgeräten bei akutem Myokardinfarkt, der durch kardiogenen Schock kompliziert ist
Summary
Perkutane ventrikuläre Unterstützungsgeräte werden zunehmend bei Patienten mit akutem Myokardinfarkt und kardiogenem Schock eingesetzt. Hierin diskutieren wir den Wirkmechanismus und die hämodynamischen Wirkungen solcher Geräte. Wir überprüfen auch Algorithmen und Best Practices für die Implantation, das Management und die Entwöhnung dieser komplexen Geräte.
Abstract
Der kardiogene Schock ist definiert als anhaltende Hypotonie, begleitet von Hinweisen auf eine Hypoperfusion des Endorgans. Perkutane ventrikuläre Unterstützungsgeräte (PVADs) werden zur Behandlung des kardiogenen Schocks eingesetzt, um die Hämodynamik zu verbessern. Impella ist derzeit die häufigste PVAD und pumpt aktiv Blut aus dem linken Ventrikel in die Aorta. PVADs entladen den linken Ventrikel, erhöhen das Herzzeitvolumen und verbessern die Koronarperfusion. PVADs werden typischerweise im Herzkatheterlabor unter fluoroskopischer Führung über die Oberschenkelarterie platziert, wenn dies möglich ist. Bei schwerer peripherer arterieller Verschlusskrankheit können PVADs durch einen alternativen Zugang implantiert werden. In diesem Artikel fassen wir den Wirkmechanismus von PVAD und die Daten zusammen, die ihre Verwendung bei der Behandlung von kardiogenem Schock unterstützen.
Introduction
Der kardiogene Schock (CS) ist definiert als persistierende Hypotonie (systolischer Blutdruck 30 Minuten oder die Notwendigkeit von Vasopressoren oder Inotropen), Endorgan-Hypoperfusion (Urinausscheidung 2 mmol/L), pulmonale Stauung (pulmonaler Kapillarkeildruck (PCWP) ≥ 15 mmHg) und Verringerung der Herzleistung (Herzindex <2.2 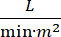 )1, 2 aufgrund einer primären Herzerkrankung. Akuter Myokardinfarkt (AMI) ist die häufigste Ursache für CS3. CS tritt in 5-10% der AMI auf und wurde in der Vergangenheit mit einer signifikanten Mortalität in Verbindung gebracht3,4. Mechanische Kreislaufunterstützungsgeräte (MCS) wie intraaortale Ballonpumpe (IABP), perkutane ventrikuläre Unterstützungsgeräte (PVAD), extrakorporale Membranoxygenierung (ECMO) und perkutane Linksatrium-Aorten-Geräte werden häufig bei Patienten mit CS5eingesetzt. Die routinemäßige Anwendung von IABP hat keine Verbesserung der klinischen Ergebnisse oder des Überlebens bei AMI-CS1gezeigt. Angesichts der schlechten Ergebnisse im Zusammenhang mit AMI-CS, der Schwierigkeiten bei der Durchführung von Studien in AMI-CS und der negativen Ergebnisse der IABP-Anwendung in AMI-CS suchen Kliniker zunehmend nach anderen Formen von MCS.
)1, 2 aufgrund einer primären Herzerkrankung. Akuter Myokardinfarkt (AMI) ist die häufigste Ursache für CS3. CS tritt in 5-10% der AMI auf und wurde in der Vergangenheit mit einer signifikanten Mortalität in Verbindung gebracht3,4. Mechanische Kreislaufunterstützungsgeräte (MCS) wie intraaortale Ballonpumpe (IABP), perkutane ventrikuläre Unterstützungsgeräte (PVAD), extrakorporale Membranoxygenierung (ECMO) und perkutane Linksatrium-Aorten-Geräte werden häufig bei Patienten mit CS5eingesetzt. Die routinemäßige Anwendung von IABP hat keine Verbesserung der klinischen Ergebnisse oder des Überlebens bei AMI-CS1gezeigt. Angesichts der schlechten Ergebnisse im Zusammenhang mit AMI-CS, der Schwierigkeiten bei der Durchführung von Studien in AMI-CS und der negativen Ergebnisse der IABP-Anwendung in AMI-CS suchen Kliniker zunehmend nach anderen Formen von MCS.
PVADs werden zunehmend bei Patienten mit AMI-CS6eingesetzt. In diesem Artikel werden wir unsere Diskussion hauptsächlich auf den Impella CP konzentrieren, der derzeit am häufigsten verwendete PVAD6. Dieses Gerät verwendet eine axiale Archimedes-Schraubenpumpe, die aktiv und kontinuierlich Blut aus dem linken Ventrikel (LV) in die aufsteigende Aorta treibt (Abbildung 1). Das Gerät wird am häufigsten im Herzkatheterlabor unter fluoroskopischer Führung über die Oberschenkelarterie platziert. Alternativ kann es bei Bedarf durch einen axillären oder transkavalen Zugang implantiert werden7,8.
Protocol
Representative Results
Discussion
Minimierung der Risiken und Komplikationen von PVAD (Tabelle 2)
Die hämodynamischen Vorteile von PVAD können signifikant neutralisiert werden, wenn Komplikationen durch großflächigen Zugang auftreten, wie schwere Blutungen und akute Extremitätenischämie28,29. Es ist daher wichtig, das Risiko und die Komplikationen des Geräts zu minimieren.
Um Komplikationen an der Zugangsstelle zu verringern und die Anzahl de…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nichts
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
References
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

