アノフェレスガンビアにおける機能遺伝学のGAL4-UASシステムの使用
Summary
二部類GAL4-UASシステムは 、アノフェレスガンビアで機能的な遺伝子解析を可能にする制御された時空間的な方法で遺伝子発現を修飾するための汎用性の高いツールです。このシステムを使用するために説明されている手順は、半標準化されたクローニング戦略、蛍光タンパク質マーカーおよび胚固定のための子犬の性別とスクリーニングである。
Abstract
二部のGAL4-UASシステムは機能性の遺伝子解析のための多目的で強力な用具である。システムの本質は、酵母転写因子GAL4を組織特異的な方法で発現するトランスジェニックな「ドライバ」ラインを横断し、その発現がGAL4に結合する上流活性化配列(UAS)によって制御される遺伝子/RNA干渉構造の候補を運ぶトランスジェニックな「応答者」ラインである。その後の子孫では、遺伝子またはサイレンシング構築物は、このように規定された時空間的な方法で発現され、結果として生じる表現型をアッセイし、遺伝子機能を推測することを可能にする。バイナリシステムは、重度のフィットネスコストが誘発された場合でも、複数の組織特異的パターンでトランスジーン発現によって生成された表現型をスクリーニングする実験的アプローチの柔軟性を可能にする。我々は、アフリカの主要なマラリアベクター であるアノフェレス・ガンビアにこのシステムを適応させました。
この記事では、GAL4-UAS 分析で使用される一般的な手順をいくつか紹介します。我々は、すでに生成された AN.ガンビア GAL4-UASラインと、アップレギュレーションとRNAiノックダウンのための新しい応答構造のクローニングについて説明する。我々は、ドライバーと応答者の挿入をタグ付けする蛍光遺伝子マーカーの継承に従う子孫のスクリーニングを含む、遺伝的十字架を確立するための蚊の子犬のセックスのためのステップバイステップガイドを指定する。我々はまた、胚発生を研究するために An.ガンビア胚 をクリアするためのプロトコルを提示する。最後に、標的遺伝子のGAL4下流にCRISPR/Cas9を挿入してドライバラインを生成する方法の潜在的な適応を紹介する。
Introduction
二部GAL4-UASシステムは、昆虫モデルの生物ショウジョウバエメラノガスター1,2,3における遺伝子の機能的特徴付けの役馬である。GAL4-UASシステムを使用するには、トランスジェニックドライバラインは、調節配列の制御下にある酵母転写因子GAL4を発現し、GAL4によって認識される上流活性化シーケンス(UAS)によって制御される目的の遺伝子またはRNA干渉(RNAi)構築物を運ぶ応答線と交差する。この十字架の子孫は、GAL4発現を制御するプロモーターによって指示される時空間パターンにおける関心のトランスジーンを表す(図1)。ドライバー応答者十字の子孫によって表示される型のフェノタイプは、候補遺伝子の機能を解明するために評価することができる。D.メラノガスターは、他の生物から遺伝子を調べるために使用されているが4,5,6,7,, GAL4-UASシステムは、関心のある種8,9,11,12,13,14の直接分析を提供するために、医療および農業上重要の昆虫での使用に適応されています。
アフリカのマラリア蚊、アノフェレスガンビアでは、GAL4-UASシステムが最初に細胞株共トランスフェクション9によってテストされました。複数の構成体が異なる対の組み合わせで効率のためにアッセイされ、14のタンデム反復UASが小型の人工イントロン(UAS-14i)を補い、GAL4ドライバのパネルで使用すると、最も広い範囲の活性化電位を示すことがわかった。インビボ機能を実証するために、これらの構成体は、ピギーバクトトランスフォーメーション8によって2つの別々のトランスジェニックAn.ガンビアラインを作成するために使用されました:midgut特異的プロモーターによって駆動されるGAL4を運ぶドライバーラインと、UAS配列の調節下にあるルシメラーゼおよび強化された黄色蛍光タンパク質(eYFP)遺伝子の両方を含む応答線。腸特異的ルシメラーゼ活性および生前性における蛍光は、このシステムがアノフェレスで効率的であることを示した。それ以来、オエノサイト15やヘモサイト16を含むベクター容量および殺虫剤耐性に重要な他の組織におけるトランス遺伝子を発現するドライバラインが作成され、かつ、ユビキタスパターン10に近いものである。また、代謝および隔離媒介性殺虫剤耐性に関与すると考えられるアッセイ遺伝子、カチカリン炭化水素合成、および異なる細胞および組織タイプに蛍光タグを付ける測定遺伝子にも多数のUASラインが生成されている(表1)。応答線については、トランスジーンの部位指向統合が、UAS調節遺伝子のゲノムコンテキストを固定するために、ΦC31触媒再結合カセット交換17,18によって行われるようになりました。このようにして、遺伝子挿入位置に関して遺伝子導入発現が正規化され、異なる候補遺伝子の表現型効果をより正確に比較することが可能になる。
これまでに作成された応答線は、高いレベルでトランスジーンを発現するか、RNA干渉(RNAi)を介して遺伝子発現を減少させるように設計されています。 通常、cDNAクローンはUAS配列に融合して適切な発現プラスミドを生成するが、完全なゲノム配列はクローニングには大きすぎるものではないと仮定しても可能である。サイレンシング構築物を生成するために、RNAiを刺激するヘアピンdsRNAを形成する適切なタンデム逆配列を得るために3つの異なる方法を用いた。これらには、融合PCR、非対称PCRおよびヘアピン構築物の商業的合成が含まれています。各方法に共通するのは、転写安定性を提供するために反転配列間にイントロン配列を含めることである。目的の遺伝子/RNAi構築物を挿入できる応答性プラスミドが開発された15。これらのプラスミドはまた、RMCE(RCME技術を詳細に記述するJoVE紙に付随するアドルフィに記載)に必要なΦC31 attB サイトを運びます。これらのプラスミドの1つに挿入するシーケンスを過剰発現にする際に必要な重要なステップをカバーするプロトコルが、この原稿に含まれている。また、RNAiヘアピン構築物作成用の2つのプロトコルを説明し、図示する。
新しいラインを作成する際には、まれなトランスジェニックな個体の同定は、トランスジェニックコロニーを確立し維持するために繁殖するために重要です。GAL4-UASシステムにとって最も重要なことは、応答者とドライバラインを区別して十字架を確立し、両方の遺伝子を運ぶ個々の子孫を特定する必要があります。これは、ドライバと応答側カセットにリンクされた異なる支配的な選択可能マーカー遺伝子を使用することによって達成される。最も一般的には、光学フィルター(例えば、eYFP、eCFP、dsRed)を使用して明確に識別可能な蛍光マーカー遺伝子です。マーカーは、異常や汚染の識別が容易になるため、既知の信頼性の高い時空間パターンで表現することが重要です。蛍光マーカー遺伝子発現は、合成 3xP3 プロモーターによって日常的に調節され、 An.gambiae 開発19のすべての段階で眼および腹側神経節特異的発現を引き起こす。 3xP3 で制御される蛍光マーカーは、本稿に記載されているすべての形質転換プラスミドに含まれています。蛍光 アンガンバエ PUPAe GAL4-UASラインをスクリーニングするために使用される一般的な方法を詳述するプロトコルがここに含まれています。
GAL4-UAS システムの重要な要素の 1 つは、差し切れにマークされたドライバとレスポンダラインを横断する必要があります。この男性と女性を各ラインから行うには、交配前に分離する必要があります。しかし、成人は視力によって容易に区別できるが、遺伝的十字架を確立するためには、交配が起こらないように成人の出現前に男女を分離することが賢明である。男性と女性の一般的なサイズの違い アンガンビアの 子犬は、性決定の効率的で信頼性の高い方法になるにはあまりにも可変です20。代わりに、外部生殖器の明確な形態学的違いは 、An.ガンビアでのセックスのための信頼できる基礎を提供します。この記事では、適切な十字架を設定するために An.ガンビア の子犬をセックスするための信頼できる方法について説明します。
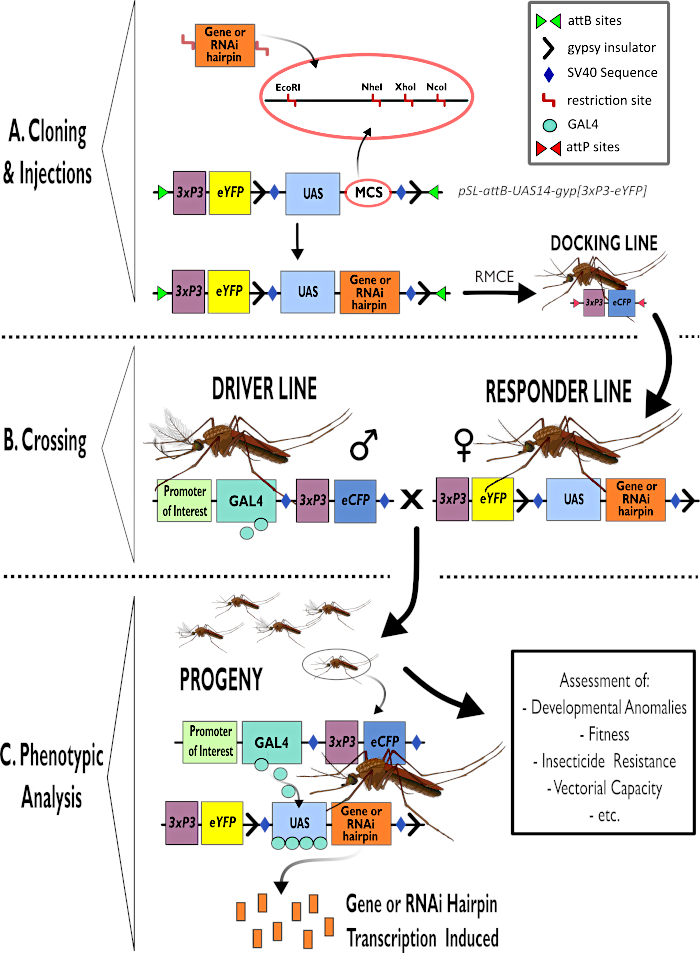
図1 -アノフェレスガンビアにおける二国間GAL4-UASシステムを使用するためのプロセスの図示的表現。 (A)例ベクトルの主要成分(pSL-attB-UAS14-gyp[3xp3-eYFP])が描かれ、対象遺伝子にヘアピン構造またはコード配列を挿入するのに適した複数のクローニング部位内の利用可能な制限部位(EcoRI、NheI、XhoIおよびNcoI)を詳述している。ドッキングラインの構造も描かれています。(B)交差工程は、ドライバーライン(3xP3プロモーターによって駆動される目的のプロモーターおよびeCFPによってGAL4ドライバーを運ぶ)および応答側ライン(UASプロモーターおよび3xP3プロモーターによって制御されるeYFPマーカーによって制御される関心のある遺伝子またはヘアピン構築物を運ぶ)からの雄の使用を示す図示される。(C)Bにおける十字架の子孫における目的の遺伝子のGAL4駆動発現の図示および評価される典型的な表現型の一部のリスト。略称:複数クローニング部位(MCS)、リコンビナーゼ媒介カセット交換(RMCE)、アップストリームアクチベーター配列(UAS)、強化された黄色蛍光タンパク質(eYFP)、強化シアン蛍光タンパク質(eCFP)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
GAL4-UAS システムの二者間の性質を提供する十字の使用であり、より線形なアプローチよりも明確な利点があります。例えば、ドライバーとレスポンダーラインの組み合わせは、プロモーター/遺伝子の組み合わせごとに新しいトランスジェニックラインを生成して維持する必要がある場合よりも評価できます。さらに重要なことは、線形系で作成/維持することが困難な発現が摂動されたときに致死的または無菌表現型を産生する遺伝子の分析を可能にする。このような致死性表現型は、遺伝子機能および時空間的発現に応じて、すべての発達段階で現れるが、胚発生時に最も頻繁に観察される。蚊の胚の発達を視覚化するには、卵をコーティングする不透明な絨毛のクリアが必要です。Trpiš(1970)21 およびカイザーら(2014)22に記載されている方法に従って、我々は、構造的完全性を維持しながら、胚を固定するために使用するプロトコルを記述し、顕微鏡的可視化およびイメージングを可能にするエンドコリオンをクリアするために漂白する。
Protocol
Representative Results
Discussion
蚊の遺伝子機能を理解することは、アノフェレスを制御し、マラリア感染に影響を与える新しいアプローチを開発するために不可欠です。記載されているGAL4-UASシステムは、候補遺伝子の機能解析のための汎用性と強力なシステムであり、現在までに我々は殺虫剤耐性の遺伝的基礎を調べるためにシステムを使用しています17とキューチキュラー炭化水素生産<sup class="…
Disclosures
The authors have nothing to disclose.
Acknowledgements
我々は、LSTMとIVCC(アドリアナ・アドルフィ)、BBSRC(新捜査官賞(AL)、MRC(BCP:MR/P016197/1への博士課程の学生シップ)、ウェルカム(LGへのヘンリー・ウェルカム博士研究員:215894/Z/19/Z)からの資金提供を感謝しています。
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
References
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. 유전학. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. 유전학. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. 발생학. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

