時間分解型クライオ電子顕微鏡のための高速グリッド調製
Summary
ここでは、高速グリッド作成用の高速グリッド製造装置の使用と、時間分解実験を行うための迅速な混合と凍結の両方に関する詳細なプロトコルを提供します。
Abstract
クライオ電子顕微鏡(cryo-EM)の分野は、新しいハードウェアと処理アルゴリズムで急速に発展しており、より高い解像度の構造と、より困難なシステムに関する情報を生み出しています。cryo-EMのサンプル調製は、従来のブロッティングシステムに取って代わる新しいアプローチで同様の革命を起こしています。これらには、ピエゾ電気ディスペンサーの使用、ピン印刷および直接噴霧が含まれる。これらの開発の結果、グリッド調製の速度は数秒からミリ秒に進み、特にタンパク質と基質が急落凍結の前に急速に混合され、短命の中間状態を捕捉できる時間分解型クライオEMの分野で新たな機会を提供しています。ここでは、標準の高速グリッド準備と時間分解実験の両方のために、社内の時間分解EMデバイス上でグリッドを作成するための標準プロトコルを詳細に説明します。このプロトコルは、4グリッドの調製のために、2 mg/mLの≥濃度で、最低約50 μLのサンプルを必要とします。サンプルアプリケーションと凍結の間の遅延は10ミリ秒と低くすることができます。1つの制限は、より速い速度で氷の厚さを増加させ、ブロッティング法と比較することです。私たちは、このプロトコルが他の人が自分のグリッド作りデバイスを設計し、時間を解決した実験を設計することに興味を持っている人を助けることを願っています。
Introduction
バックグラウンド
最近のクライオ電子顕微鏡(cryo-EM)の発展により、高分解能でますます複雑化するシステムの構造研究が可能になりました。いくつかの例外を除いて、このような研究は平衡1 または比較的遅い反応2での生体高分子に限定されてきた。 インビボの 多くのプロセスは、より速いタイムスケール(ミリ秒)で発生し、これらのタイムスケール3で時間分解クライオEM(TrEM)への関心が高まっています。しかしながら、ブロッティング法による従来のクライオEMサンプル調製は、ミリ秒TrEMには遅すぎる。
ブロッティング法には、時間分解能の低さ以外にも制限があります。タンパク質およびタンパク質複合体は、格子4上で変性または好ましい向きに苦しむことができる。サンプル調製中の空気水界面への曝露時間を短縮することは、好ましい配向及びタンパク質変性5,6を緩和することが示されている。したがって、高速グリッドの準備はミリ秒のTrEMを可能にするだけでなく、グリッドの品質を向上させることができます。
現在、グリッドの自動準備には 3 つの異なるアプローチがあります。最初のアプローチでは、少量のサンプルを保持するピンまたはキャピラリーを使用します。液体とグリッド表面の間に接触を確立した後、サンプルはグリッド7、8に「書き込まれる」。サンプルアプリケーションプロセスは比較的遅く、数秒かかります。別のアプローチは、ピエゾディスペンサーと自己ウィッキンググリッド9によって制御された液滴生成を使用しています。これにより、より速いディスペンスが時間を凍結することができますが、まだドロップレットとウィッキング速度(現在54 msに達する)によって制限されています。これまでの最速アプローチは、サンプルがスプレーノズルと小さな(〜10〜20μm)と高速(>5 m/s)の液滴がクライオEMグリッドと接触したときに広がる直接スプレーアプローチです。サンプルスプレーは、エアブラストアトマイザー、表面音響波または超音波加湿器10、11、12、13などのさまざまな方法で生成することができる。私たちの経験では、直接噴霧アプローチと氷の厚さは大きいですが、直接噴霧は、分配剤が10ミリ秒<時間凍結することを可能にします。
このプロトコルは、マイクロ流体スプレーノズルを搭載した時間分解EMデバイス(TED)を使用して、高速タイムスケール14,15でグリッドを準備する方法をステップバイステップで説明しています。このデバイスは、サンプルアプリケーションと凍結の間に6ミリ秒の最小遅延時間でグリッドを準備し、2つのサンプルを迅速に混合および凍結するために使用されています。TED の設計は、以前のバージョン16に基づいており、他のスプレーベースの時間分解クライオ EM デバイス17に似ています。
まず、TED セットアップの 4 つの主要な部分について説明します。TEDのコアは、サンプル吸引と分配を担当する液体取扱ユニットです。空気プランジャーは、スプレーを通して液体エタンにグリッドを移動します。噴霧の生成はマイクロ流体噴霧ノズルで達成され、凍結は、簡単に説明される液体エタン容器で行われる。最後に、グリッド環境、特に湿度を制御する追加機能が強調表示されます。この後、デバイスの動作とTrEM実験を行うための詳細なプロトコルが続きます。高速グリッドの準備と簡単な TrEM 実験の代表的な結果が得られます。
実験用セットアップ
液体の取扱い単位
TEDの液体取扱システムは、3つのシリンジ駆動ポンプ(‘ポンプ1-3’)によって形成され、それぞれにロータリーバルブが装備されています(図1)。電源モジュールは、24 V DC を備えたポンプ 1 ~ 3 を提供します。制御ソフトウェア (Visual Basic および C++ で記述された) との通信は、RS232 インターフェイスを介して 1 をポンプで送ります。コマンドは、シリアルI/O拡張ポートを通じてポンプ1からポンプ2-3に配信されます。ポンプ1-3はガラスの注射器が装備されている(‘シリンジ1-3’、我々はここで250 μL/ゼロデッドボリュームシリンジを使用する)。各バルブには、「負荷」と「ディスペンス」の2つの位置があります。「負荷」位置は、注射器にサンプルを吸引するために使用されます。1/16の短い部分(3 – 4 cm)O.D.、0.01′’I.D.FEPチューブは、ETFE / ETFEフラレンス継手を介してバルブ1-3の「負荷」位置に接続されます。この短いチューブは、サンプルリザーバ(通常は1.5 mLまたは0.5 mLのプラスチックチューブ)に届きます。「ディスペンス」位置はスプレーノズルに導く。「ディスペンス」出口とスプレーノズルの間の接続は、PEチューブ(〜20〜30 cmの長さ、0.043″O.D.、0.015″I.D.)、スリーブチューブ(〜0.5cm)とETFE / ETFEフラレンスフィッティングの短い部分で行われます。
空気圧プランジャー
TEDは空気式プランジャーを使用してグリッドを加速し、サンプルスプレーを通して液体エタン容器に移動します。負圧ピンセットは、グリッドを保持し、二重ロッドの空気圧シリンダに取り付けられた自家製ホルダーにねじ込みます(図2A)。
圧力は大きい窒素ガスのシリンダー(サイズW)から供給され、多段調節器(0- 10棒、’主圧力’)が装備されている。フレキシブル強化PVCチューブ(12 mm O.D.)は、加圧窒素がノズルと空気プランジャーに送達される12ポートマニホールドにレギュレータを接続します。ノズルを通るガス流は一定であり、窒素シリンダー(主圧)で直接調節される。ノズルへの接続はPUチューブ(4 mm O.D.、2.5 mm I.D.)、短いPEチューブ(〜8 cmの長さ、0.043″O.D.、0.015″I.D.)および適切なコネクタで行われます。空気のプランジャーの圧力はソレノイド弁によって制御される。PUチューブ(4 mm O.D.、2.5 mm I.D.)は、ソレノイドバルブとレギュレータと空気圧プランジャーを接続して、プランジ圧力(≤主圧)を低減します。ソレノイド弁はコンピュータ制御される。セットアップの概略図の概要を 図 2Bに示します。
この設定では、プランジ圧力は常にスプレーガス圧(主圧)と同等または小さいことに注意してください。しかし、セットアップは、低スプレーガス圧力でより高いプランジ速度を可能にするために、スプレーノズルの第2のレギュレータの上流を組み込むことによって容易に変えることができる。高圧(>>2バー)はPDMSのスプレーノズルを損傷する可能性があります。
注意:これは加圧システムであり、「主圧力」は常に7バー<する必要があります。
0.5~2バー間の圧力は、通常、空気圧プランジャーに使用され、圧力と速度(スプレーの垂直位置)の間にほぼ直線的な関係を示します。プランジ速度は、スライドポテンショメータ(10 kΩ)と平行に接続されたオシロスコープで測定されます(図2C)。電源は9 V DCをポテンショメータに提供します。プランジ圧力を設定して実験前に近似プランジ速度を設定しますが、ポテンショメータは実験後の速度を正確に読み出します。
スプレーノズルと液体エタン容器
噴霧ベースのサンプル送達のためのガス動的仮想ノズルの製造と動作については、詳細15の他の場所で説明されている。上述したように、バルブ1~3の「ディスペンス」出口は、ノズルの液体入口に接続されている(図3A)。加圧スプレーガスは、ノズルのガス入口に接続されています。PDMSスプレーノズルの入口は、0.043インチO.D.PEチューブが継手を必要とせずに直接使用できるようなものです。私たちのノズルの設計はref.18で説明されている装置と同様に、2つのサンプルを混合するための「ジェットインジェット」幾何学を含んでいる。図 3Bに設計の概略を示す図3Bは、ノズルの顕微鏡画像を 図3Cに示す。マイクロ流体デバイスのレイアウトには、2つのサンプルを混合するために3つの注射器を使用する必要があります。スプレーノズルは、通常、(サンプルアプリケーション中)、グリッドから1〜1.5センチメートルの距離に配置されます。
液体エタンを、標準的なブロッティング法に使用する液体エタン/窒素容器に入れ、凍結剤として使用しています。液体エタンカップの縦位置は実験室の持ち上がるプラットホームと達成される。
スプレーおよびグリッド環境の制御
プランジャーとスプレーノズルは、カスタム構築されたPMMA(アクリルガラス)ボックスに含まれており、ダブルドアが付いています(図4A)。箱の中の高い相対湿度はTEDの後部の空気加湿システムによって達成される(図4B)。空気はポンプによって供給され、最初の10″キャニスターに供給される(通常、シンク水浄化の下で使用される)。キャニスターは水の低い(〜5-10 cm)レベルで満たされ、また加湿器の単位を収容する。加湿器への主電源は、デジタル湿度/温度コントローラとアクリルガラスボックス内にある湿度/温度センサーによって制御されます。相対湿度が90%に達すると、コントローラはポンプをオフ≥設定されています。最初のキャニスターからの加湿空気は、拡散器を通してポンプで送られ、第2の10″キャニスターに水に浸漬し、次いでアクリルガラスボックスに入る。
注意: サンプルはスプレーノズルでエアロゾル化されるため、有害な生物学的または化学的標本はサンプルとしては適していません。
実行シーケンス
コントロール ソフトウェアの [スクリプトの実行 ] ボタンをクリックすると、実行シーケンスが開始されます。この一連のコマンドは、スクリプトファイルで事前定義され、ソフトウェアを介して変更できます。最も重要な変数は、ここで説明します。
スプレー速度: スプレー速度は、シリンジポンプで使用される液体流量を決定します。流量は次のように計算することができます:ここで使用されるシリンジポンプモーターは固定のステップサイズを有する。ポンプの全範囲は48,000ステップに分けられる。2番目の重要な要素は、シリンジの体積です。通常は250μLのシリンジを使用します。制御ソフトウェアの噴霧速度は、ステップ数/秒として設定されます。1000ステップ/秒のスプレー速度は次の通りです:
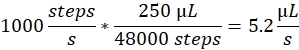
スプレー量: スプレーの容積は、スプレーされる総容積を決定します。これにより、スプレーの持続時間も決定する。制御ソフトウェアのスプレーボリュームは、いくつかのステップとして設定されます。2000ステップのスプレー容積は1000ステップ/秒のスプレー速度で、2 sのスプレー持続時間および10.4 μLの総容積に導く。
プレスプレー時間:この変数は、スプレーの開始とプランジの開始までの時間を定義します。噴霧がグリッドを突っ込む前に安定するのに十分な時間を持つような遅延時間を選択することが重要である。通常、スプレーは、グリッドが突っ込む前に安定させるために1.5〜4 sを与えられる。スプレーは、グリッドが通過するまで維持されます。通常、液体の流れ(したがって、スプレー)は、グリッドが急落した後、0.5〜1 s停止します。1000ステップ/sのスプレー速度と2000ステップのスプレー量を使用して、典型的なプレスプレー時間は、例えば1.5 sです。
例示的な一連のコマンドを図 5Aに示しますが、グリッド位置を時間の経過としますが、 図 5Bに示します。
Protocol
Representative Results
Discussion
この研究のプロトコルは、直接噴霧およびTrEM実験により、高速グリッド調製に使用することができる。高速グリッド調製は、空気水界面5との粒子相互作用を低減するために使用することができる。主な制限は、グリッド上で利用可能なサンプル濃度と氷の厚さです。これらの限界内で、サンプルの品質が良い場合、プロトコルは高解像度のクライオEMに適したグリッドを生…
Disclosures
The authors have nothing to disclose.
Acknowledgements
モリー・S.Cグラヴェットの有益な議論とABSL施設スタッフにクライオEMデータ収集の支援を感謝します。デビッド・P・クレブルは、リーズ大学が出資するアストベリー・センターのウェルカム・トラスト4年間の博士号プログラムの博士課程の学生です。FEIタイタンクリオス顕微鏡は、リーズ大学(UoL ABSL賞)とウェルカムトラスト(108466/Z/15/Z)によって資金提供されました。この研究は、スティーブン・P・ミュエンチ(BB/P026397/1)へのBBSRC助成金によって資金提供され、米国心臓協会(AMR21-236078)のハワード・D・ホワイトと米国国立衛生研究所(171261)のハワード・D・ホワイトとヴィトルド・ガルキンへの研究助成金によって支援されました。
Materials
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10×70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. 생화학 15, 5818-5826 (1976). |
References
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D’Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner’s guide to flow kinetics. The Biochemist. 42, (2020).

