粒子テンプレート化乳化により、マイクロ流体フリーのドロップレットアッセイが可能
Summary
油中水滴アッセイは、分析化学、酵素進化、単一細胞分析に有用であるが、通常は液滴を形成するためにマイクロ流体が必要である。ここでは、液滴アッセイを行うマイクロ流体フリーアプローチである粒子鋳型乳化について述べている。
Abstract
単分散液滴で行われる反応は、一括で行われる同等のものと比較して、精度と感度が向上します。しかし、制御された液滴を形成するためのマイクロ流体の要件は、非専門家に障壁を課し、その使用を制限する。ここでは、微粒子を鋳型乳化、マイクロ流体を使用しない単分散液滴を生成するアプローチについて述べている。水ゲル球をテンプレート化して、単純な渦によって単分散液滴にサンプルをカプセル化する。マイクロ流体フリーのデジタルPCRを行う手法を用いて実証します。
Introduction
液滴マイクロ流体は、ピコリットル液滴の区画化を利用して、バルク反応と比較してアッセイの感度と精度を高め、化学スクリーニング、タンパク質工学、次世代シーケンシング1,2,3に数多くの用途を持っています。例えば、デジタル液滴ポリメラーゼ連鎖反応(ddPCR)は、がんの遺伝的変異、変異を引き起こす疾患の検出、および出生前診断の応用により、バルク定量ポリメラーゼ連鎖反応(qPCR)と比較して精度が向上します。しかし、液滴マイクロ流体の課題は、サンプルを分割するためのマイクロ流体デバイスの要件です。マイクロ流体は液滴特性を優れた制御を可能にする一方で、構築および操作に専門的な専門知識を必要とします7,8.その結果、液滴ベースの方法は、主に専門家のラボに限定されるか、まれに市販の機器が利用可能なアプリケーション9,10に限定されます。液滴アッセイの使用を広げるためには、特殊なマイクロ流体機器の要件は克服しなければならないハードルです。
本稿では、単分散液滴で反応を行うマイクロ流体フリー法である粒子テンプレート乳化(PTE)について述べた。PTEでは、単純な渦によってサンプルをキャリアオイル中の液滴に巻き込む粒子(図1)。システムが混合するにつれて、水性部分断片は、液滴が単一粒子を含むまで小さくなるサイズの小滴に、その時点で粒子を破壊する必要があるため、さらに断片化は不可能である。巻き込まれたサンプルは、粒子を液滴の中のシェルとして囲み、それによって分散した細胞、試薬、または機能部分を封入する(図1D)。したがって、PTEは、共通のボルテクサーを超えて液滴反応を行う装置や専門知識を必要としません。さらに、液滴の生成はマイクロ流体で分または時間に比べて数秒かかり、生成される量は、デバイスの操作時間ではなく、コンテナの体積に比例し、最高にスケーラブルになります。これらの利点は、マイクロ流体が実用的でない様々な状況で液滴アッセイを実施するためのPTEを理想的にします。ここでは、PTE をデモンストレーションし、それを使用して ddPCR を実施します。
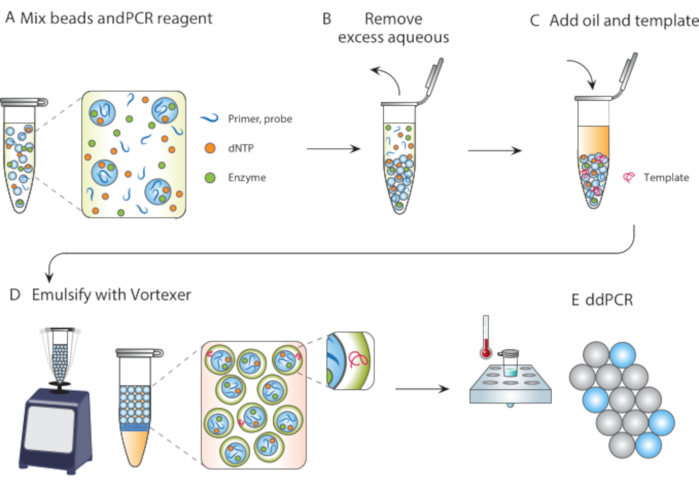
図 1.粒子テンプレート化乳化プロセスの概要。 (A)テンプレート粒子を試薬と混合する。(B)過剰試薬は遠心分離後に除去される。(C)鋳物分子の添加は、油を添加する前に起こる。(D) 渦は単一の鋳片分子を含む液滴を生成する。(E) その後の熱サイクルおよびイメージングにより、ターゲットテンプレートのデジタル液滴分析が可能になります。 この図の大きなバージョンを表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
PTEは粒子を使用して、渦を起させることによって単分散液滴にサンプルをカプセル化します。PTE は、そのシンプルさとアクセシビリティに加えて、大量の液滴を瞬時に生成するといったいくつかの利点を提供します。さらに、このプロセスは、サンプルをマイクロ流体デバイスに転送する必要性を排除し、サンプルの汚染や損失の機会を制限する、分離チューブで行うことができます。また、テンプレート粒子は、得られた液滴反応の内容を設計する手段も提供します。例えば、粒子サイズ、化学、および湿潤性は、標的化された生体分子または細胞捕捉のために設計することができ、一方、酵素、活性物、または核酸などの機能部分は、単一細胞のシーケンシングまたは機能特性化のために、反応を促進するために粒子上に表示することができる。このアプローチは柔軟ですが、その使用には重要な制約があります。例えば、マイクロ流体で頻繁に行われるように、現在のところ液滴添加を行うことは不可能であり、カプセル化の前にすべての反応成分を導入する必要があります。これは、液滴が生成されるまで試薬が互換性があり、安定であることが必要であり、面倒な組み合わせの場合、しばしば氷上でサンプルを素早く混合して乳化することによって対処することができます。あるいは、光や熱で外部から引き起こすことができる反応成分を使用することができる13。PTEは、非専門家がアクセスできる液滴アッセイを実施するための柔軟でスケーラブルな方法を提供します。この機能は、その自然なシンプルさと柔軟性と相まって、PTEを多数の液滴アプリケーションの実行と開発に最適にします。
Disclosures
The authors have nothing to disclose.
Acknowledgements
このプロトコルを開発するこの研究は、国立保健研究所(R01-EB019453-02)、国家情報長官室によってサポートされました。 レイセオンBBNテクノロジーズ社(N66001-18-C-4507)、チャン・ザッカーバーグバイオハブ調査官プログラム、テキサスA&M大学を通じた国防高度研究プロジェクト庁(W911NF1920013)、ジョン・ホプキンス大学を通じた疾病管理予防センターを通じたインテリジェンス高度研究プロジェクト活動 物理学研究所(75D30-11-9C-06818(CDC3))。ここに含まれる見解と結論は著者のものであり、必ずしも上記組織または米国政府の公式政策(明示的または暗示的)を表すものとして解釈されるべきではない。米国政府は、著作権の注釈にかかわらず、政府の目的のために再版を複製し、配布する権限を有しています。
Materials
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | |
| 27 gauge needles | BD | 305109 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | |
| Acrylamide solution,40%, for electrophoresis, sterile-filtered | Sigma-Aldrich | A4058-100ML | |
| Ammonium persulfate | Sigma-Aldrich | A3678-25G | |
| Aquapel (fluorinated surface treatment) | Pittsburgh Glass Works | 47100 | |
| Hexane | Sigma-Aldrich | 139386 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| N,N′-Methylenebis(acrylamide) | Sigma-Aldrich | 146072-100G | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec-7500 Engineering Fluid (HFE oil) | 3M | 98-0212-2928-5 | |
| polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| fluorosurfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| SU-8 3025 photoresist | Kayaku | 17030192 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Yeast FWD | IDT | 5′-GCAGACCAGACCAGAACAAA-3′ | |
| Yeast REV | IDT | 5′-ACACGTATGTATCTAGCCGAATA AC-3 |
|
| Yeast Probe | IDT | 5′-/56-FAM/ATATGTTGT/ZEN/TCACTCGCGCCTGGG/3IABk FQ/-3′ |
|
| EVOS FL AUTO | Life Technologies | ||
| EVOS LED Cube, GFP | Life Technologies | AMEP4651 | |
| SYLGARD 184 KIT 1.1 LB (PDMS base and curing reagents) | Dow Corning | DC4019862 | |
| TEMED | Thermo Fisher | 17919 | |
| Saccharomyces cerevisiae genomic DNA | Milipore | 69240-3 | |
| Expanded plasma cleaner (plasma bonder) | Harrick Plasma | PDC-002 (230V) | |
References
- Mashaghi, S., Abbaspourrad, A., Weitz, D. A., van Oijen, A. M. Droplet microfluidics: A tool for biology, chemistry, and nanotechnology. Trends in Analytical Chemistry. 82, 118-125 (2016).
- Gielen, F., et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proceedings of the National Academy of Sciences of USA. 113 (47), 7383-7389 (2016).
- Mai, S., Murphy, T. W., Lu, C. Microfluidics for genome-wide studies involving next generation sequencing. Biomicrofluidics. 11 (2), 021501 (2017).
- Olmedillas-López, S., García-Arranz, M., García-Olmo, D. Current and emerging Applications of Droplet Digital PCR in Oncology. Molecular Diagnosis and Therapy. 21 (5), 493-510 (2017).
- Tong, Y., Shen, S., Jiang, H., Chen, Z. Application of Digital PCR in Detecting Human Diseases Associated Gene Mutation. Cellular Physiology and Biochemistry. 43 (3), 1718-1730 (2017).
- Yan, Y., et al. Evaluation of droplet digital PCR for non-invasive prenatal diagnosis of phenylketonuria. Analytical and Bioanalytical Chemistry. 411 (27), 7115-7126 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging Droplet Microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- The, S., Lin, R., Hung, L., Lee, A. P. Droplet Microfluidics. Lab Chip. 8 (2), 198-220 (2008).
- Baker, M. Digital PCR hits its stride. Nature Methods. 9, 541-544 (2012).
- Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C., Teichmann, S. A. The Technology and Biology of Single-Cell RNA Sequencing. Molecular Cell. 58 (4), 610-620 (2015).
- Hatori, M. N., Kim, S. C., Abate, A. R. Particle-Templated Emulsification for Microfluidics-Free Digital Biology. Analytical Chemistry. 90 (16), 9813-9820 (2018).
- Panda, P., et al. Stop-flow lithography to generate cell-laden microgel particles. Lab Chip. 8 (7), 1056-1061 (2008).
- Yozwiak, C. E., Hirschhorn, T., Stockwell, B. R. Towards a microparticle-based system for pooled assays of small molecules in cellular contexts. ACS Chemical Biology. 13 (3), 761-771 (2018).

