Emulsificação de modelos de partículas permite ensaios de gotículas livres de microfluídicos
Summary
Ensaios de gotículas de água em óleo são úteis para química analítica, evolução enzimático e análise de células únicas, mas normalmente requerem microfluidos para formar as gotículas. Aqui, descrevemos a emulsificação de modelos de partículas, uma abordagem microfluida livre para realizar ensaios de gotículas.
Abstract
As reações realizadas em gotículas monodispersadas proporcionam maior precisão e sensibilidade em comparação com as equivalentes realizadas em massa. No entanto, a exigência de microfluidics para formar gotículas controladas impõe uma barreira aos não especialistas, limitando seu uso. Aqui, descrevemos a emulsificação de modelos de partículas, uma abordagem para gerar gotículas monodispersas sem microfluidos. Usando esferas de hidrogel templating, encapsulamos amostras em gotículas monodispersadas por vórtice simples. Demonstramos a abordagem usando-a para executar PCR digital sem microfluidic.
Introduction
Microfluidos de gotículas aproveitam a compartimentação em gotículas picoliter para aumentar a sensibilidade e a precisão dos ensaios em comparação com reações a granel, e têm inúmeras aplicações em triagem química, engenharia de proteínas e sequenciamento de próxima geração1,2,3. Por exemplo, a reação em cadeia de polimerase de gotícula digital (ddPCR) proporciona maior precisão em comparação com a reação em cadeia de polimerase quantitativa em massa (qPCR), com aplicações para variação genética em cânceres, detecção de doenças causadoras de mutações e diagnóstico pré-natal4,5,6. Um desafio dos microfluidos gotículas, no entanto, é a exigência de dispositivos microfluidos para amostras de partição; enquanto os microfluidos oferecem um excelente controle sobre propriedades de gotículas, eles exigem expertise especializada para construir e operar 7,8. Consequentemente, os métodos baseados em gotículas são em grande parte limitados a laboratórios especializados ou, em raros casos, aplicações em que um instrumento comercial está disponível9,10. Para ampliar o uso de ensaios de gotículas, a exigência de instrumentação microfluida especializada é um obstáculo que deve ser superado.
Neste artigo, descrevemos a Emulsificação de Modelo de Partículas (PTE), um método livre de microfluidic para realizar reações em gotículas monodispersadas. Em PTE, partículas templating engolfam a amostra em gotículas em óleo transportador por vórtice simples (Figura 1). À medida que o sistema se mistura, a porção aquosa se fragmenta em gotículas de tamanho redutor até que as gotículas contenham partículas únicas, momento em que a fragmentação adicional não é possível porque requer a quebra das partículas. A amostra engolfada envolve as partículas como uma concha nas gotículas, encapsulando assim quaisquer células dispersas, reagentes ou moieties funcionais (Figura 1D). Assim, o PTE não requer nenhum equipamento ou perícia para realizar reações de gotículas além de um vórtice comum. Além disso, a geração de gotículas leva segundos em comparação com minutos ou horas com microfluidos, e a quantidade produzida é proporcional ao volume do recipiente, não ao tempo de operação do dispositivo, tornando-o extremamente escalável. Esses benefícios tornam o PTE ideal para a realização de ensaios de gotículas em uma variedade de circunstâncias em que os microfluidos são impraticáveis. Aqui, demonstramos PTE e usamos para realizar ddPCR.
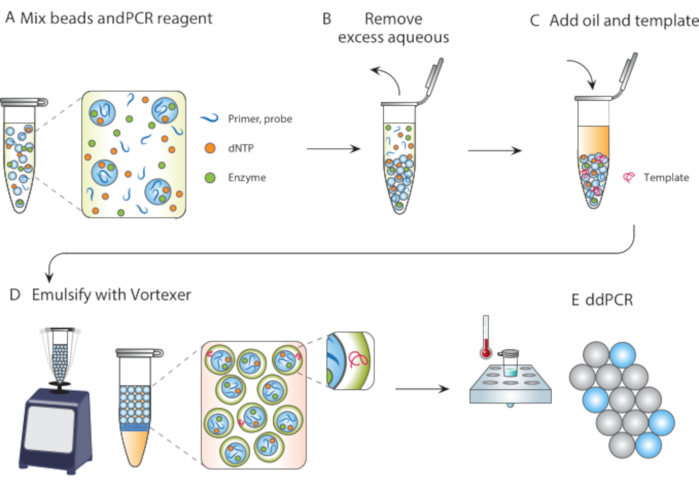
Figura 1. Visão geral do processo de emulsificação de modelos de partículas. (A) Partículas templating são misturadas com reagentes. (B) Os reagentes em excesso são removidos após a centrifugação. (C) A adição de moléculas de modelo ocorre antes da adição de óleo. (D) O vortexing produz gotículas contendo uma única molécula de modelo. (E) A termociclismo e a imagem subsequentes permitem a análise digital de gotículas do modelo de destino. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Pte usa partículas para encapsular amostras em gotículas monodispersed por vórtice. Além de sua simplicidade e acessibilidade, o PTE oferece vários benefícios adicionais, incluindo permitir que grandes volumes de gotículas sejam gerados instantaneamente. Além disso, o processo pode ser conduzido em um tubo isolado, evitando a necessidade de transferência de amostras para dispositivos microfluidos, agilizando o fluxo de trabalho global e limitando oportunidades de contaminação ou perda de amostras. As partículas templating também fornecem um meio pelo qual projetar o conteúdo das reações de gotículas resultantes. Por exemplo, o tamanho das partículas, a química e a umidade podem ser projetados para biomolécula ou captura celular direcionada, enquanto moieties funcionais, como enzimas, ativos ou ácidos nucleicos, podem ser exibidos em partículas para facilitar reações, como para sequenciamento de células únicas ou caracterização funcional. Embora a abordagem seja flexível, há, no entanto, restrições importantes ao seu uso. Por exemplo, atualmente não é possível realizar adições de gotículas como são frequentemente conduzidas com microfluidos, exigindo que todos os componentes de reação sejam introduzidos antes do encapsulamento; isso requer que os reagentes sejam compatíveis e estáveis até que as gotículas possam ser geradas e, no caso de combinações problemáticas, muitas vezes podem ser tratadas misturando e emulsificando rapidamente a amostra no gelo. Alternativamente, podem ser utilizados componentes reativos que podem ser acionados externamente com luz ou calor13. Assim, o PTE fornece um método flexível e escalável para a realização de ensaios de gotículas acessíveis a não especialistas. Isso, aliado à sua simplicidade inata e flexibilidade, torna o PTE ideal para a execução e desenvolvimento de inúmeras aplicações de gotículas.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho de desenvolvimento desse protocolo contou com o apoio dos Institutos Nacionais de Saúde (R01-EB019453-02), do Escritório do Diretor de Inteligência Nacional, Atividade de projetos de pesquisa avançada em Inteligência através da Raytheon BBN Technologies Corp (N66001-18-C-4507), o Programa de Investigação de Biohub Chan-Zuckerberg, Agência de Projetos de Pesquisa Avançada de Defesa através da Texas A&M University (W911NF1920013) e Centros de Controle e Prevenção de Doenças através da Universidade Johns Hopkins Aplicada Laboratório de Física (75D30-11-9C-06818 (CDC3)). As opiniões e conclusões aqui contidas são dos autores e não devem ser interpretadas como necessariamente representando as políticas oficiais, expressas ou implícitos, das organizações acima ou do Governo dos EUA. O governo dos EUA está autorizado a reproduzir e distribuir reimpressões para fins governamentais, apesar de qualquer anotação de direitos autorais.
Materials
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | |
| 27 gauge needles | BD | 305109 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | |
| Acrylamide solution,40%, for electrophoresis, sterile-filtered | Sigma-Aldrich | A4058-100ML | |
| Ammonium persulfate | Sigma-Aldrich | A3678-25G | |
| Aquapel (fluorinated surface treatment) | Pittsburgh Glass Works | 47100 | |
| Hexane | Sigma-Aldrich | 139386 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| N,N′-Methylenebis(acrylamide) | Sigma-Aldrich | 146072-100G | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec-7500 Engineering Fluid (HFE oil) | 3M | 98-0212-2928-5 | |
| polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| fluorosurfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| SU-8 3025 photoresist | Kayaku | 17030192 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Yeast FWD | IDT | 5′-GCAGACCAGACCAGAACAAA-3′ | |
| Yeast REV | IDT | 5′-ACACGTATGTATCTAGCCGAATA AC-3 |
|
| Yeast Probe | IDT | 5′-/56-FAM/ATATGTTGT/ZEN/TCACTCGCGCCTGGG/3IABk FQ/-3′ |
|
| EVOS FL AUTO | Life Technologies | ||
| EVOS LED Cube, GFP | Life Technologies | AMEP4651 | |
| SYLGARD 184 KIT 1.1 LB (PDMS base and curing reagents) | Dow Corning | DC4019862 | |
| TEMED | Thermo Fisher | 17919 | |
| Saccharomyces cerevisiae genomic DNA | Milipore | 69240-3 | |
| Expanded plasma cleaner (plasma bonder) | Harrick Plasma | PDC-002 (230V) | |
References
- Mashaghi, S., Abbaspourrad, A., Weitz, D. A., van Oijen, A. M. Droplet microfluidics: A tool for biology, chemistry, and nanotechnology. Trends in Analytical Chemistry. 82, 118-125 (2016).
- Gielen, F., et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proceedings of the National Academy of Sciences of USA. 113 (47), 7383-7389 (2016).
- Mai, S., Murphy, T. W., Lu, C. Microfluidics for genome-wide studies involving next generation sequencing. Biomicrofluidics. 11 (2), 021501 (2017).
- Olmedillas-López, S., García-Arranz, M., García-Olmo, D. Current and emerging Applications of Droplet Digital PCR in Oncology. Molecular Diagnosis and Therapy. 21 (5), 493-510 (2017).
- Tong, Y., Shen, S., Jiang, H., Chen, Z. Application of Digital PCR in Detecting Human Diseases Associated Gene Mutation. Cellular Physiology and Biochemistry. 43 (3), 1718-1730 (2017).
- Yan, Y., et al. Evaluation of droplet digital PCR for non-invasive prenatal diagnosis of phenylketonuria. Analytical and Bioanalytical Chemistry. 411 (27), 7115-7126 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging Droplet Microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- The, S., Lin, R., Hung, L., Lee, A. P. Droplet Microfluidics. Lab Chip. 8 (2), 198-220 (2008).
- Baker, M. Digital PCR hits its stride. Nature Methods. 9, 541-544 (2012).
- Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C., Teichmann, S. A. The Technology and Biology of Single-Cell RNA Sequencing. Molecular Cell. 58 (4), 610-620 (2015).
- Hatori, M. N., Kim, S. C., Abate, A. R. Particle-Templated Emulsification for Microfluidics-Free Digital Biology. Analytical Chemistry. 90 (16), 9813-9820 (2018).
- Panda, P., et al. Stop-flow lithography to generate cell-laden microgel particles. Lab Chip. 8 (7), 1056-1061 (2008).
- Yozwiak, C. E., Hirschhorn, T., Stockwell, B. R. Towards a microparticle-based system for pooled assays of small molecules in cellular contexts. ACS Chemical Biology. 13 (3), 761-771 (2018).

