Værktøjer til realtidsvurdering af en Pseudomonas aeruginosa-infektionsmodel
Summary
Syntetisk cystisk fibrose spyt medium (SCFM2) kan udnyttes i kombination med både konfokal laser scanning mikroskopi og fluorescens-aktiveret celle sortering til at observere bakterielle aggregater ved høj opløsning. Dette dokument beskriver metoder til at vurdere samlede populationer under antimikrobiel behandling som en platform for fremtidige undersøgelser.
Abstract
Pseudomonas aeruginosa (Pa) er en af de mest almindelige opportunistiske patogener forbundet med cystisk fibrose (CF). Når Pa kolonisering er etableret, en stor del af de inficerende bakterier danner biofilm i luftvejene spyt. Pa biofilm isoleret fra CF spyt har vist sig at vokse i små, tætte aggregater på ~ 10-1.000 celler, der er rumligt organiseret og udviser klinisk relevante fænotyper såsom antimikrobiel tolerance. En af de største udfordringer ved at studere, hvordan Pa aggregater reagerer på det skiftende spyt miljø er manglen på ernæringsmæssigt relevante og robuste systemer, der fremmer den samlede dannelse. Ved hjælp af en syntetisk CF spyt medium (SCFM2), levetiden af Pa aggregater kan observeres ved hjælp af confocal laser scanning mikroskopi (CLSM) og billedanalyse ved opløsningen af en enkelt celle. Dette in vitro-system gør det muligt at observere tusindvis af aggregater af varierende størrelse i realtid, tre dimensioner og på mikronskalaen. På individ- og befolkningsniveau gør det lettere at differentiere observationen af aggregater på forskellige udviklingsstadier, når de har evnen til at gruppere aggregater efter fænotype og position, og deres reaktion på ændringer i mikromiljøet, såsom antibiotikabehandling.
Introduction
Pseudomonas aeruginosa (Pa) er et opportunistisk patogen, der etablerer kroniske infektioner hos immun-kompromitterede personer. For dem med den genetiske sygdom cystisk fibrose (CF), disse infektioner kan spænde over løbet af livet. CF forårsager ophobning af et tyktflydende, næringsrigt spyt i luftvejene, som bliver koloniseret af en række mikrobielle patogener over tid. Pa er en af de mest udbredte CF patogener, kolonisere luftvejene i den tidlige barndom og etablere vanskelige at behandle infektioner1. Pa er fortsat et betydeligt klinisk problem og betragtes som en førende årsag til dødelighed hos dem med CF, på trods af forbedrede behandlingsregimer i de seneste år2,3. Denne persistens fænotype og stigende antibiotika tolerance har tjent Pa en plads i en gruppe af patogener identificeret af både Centers for Disease Control (CDC) og Verdenssundhedsorganisationen (WHO) som forskningsprioriteter for udviklingen af nye terapeutiske strategier-ESKAPE patogener4.
Ligesom andre ESKAPE patogener, erhvervet antibiotikaresistens er almindelig i Pa, men der er også mange iboende egenskaber, der bidrager til Pa antimikrobiel tolerance. Blandt disse er Pa’s evne til at danne aggregater meget tætte klynger af ~ 10-1.000 celler, som kan observeres i flere infektioner, herunder CF-patient spyt5,6. I lighed med Pa undersøgt i andre biofilm systemer, Pa aggregater vise klinisk relevante fænotyper såsom øget resistens over for antibiotika og aktivering af celle-celle kommunikation (quorum sensing (QS)). For eksempel har aggregater af Pa vist sig at bruge QS-regulerede adfærd til at bekæmpe andre mikrober samt tolerere antimikrobielle behandlinger såsom produktion af pyocyanin7. Evnen til at studere en sådan adfærd giver et spændende indblik i bakterielle økosystemer i et miljø, der ligner det, hvor de findes i menneskekroppen.
En af de største udfordringer ved at studere, hvordan Pa aggregater reagerer på det skiftende spyt miljø er manglen på ernæringsmæssigt relevante og robuste systemer, der fremmer den samlede dannelse. Meget af det, der er kendt om Pa er blevet opdaget ved hjælp af in vitro-systemer, hvor celler vokser planktonically eller i en karakteristisk overflade-vedhæftet, “champignon” arkitektur, der ikke er blevet observeret in vivo8. Mens klassiske biofilm vækstmodeller, såsom flowceller eller solid agar, har givet omfattende og værdifuld viden om bakteriel adfærd og mekanismer af antibiotika tolerance, disse resultater ikke altid oversætte in vivo. Mange in vitro-modeller har en begrænset evne til at efterligne vækstmiljøet på det menneskelige infektionssted, hvilket nødvendiggør dyre in vivo-undersøgelser. Til gengæld mangler mange in vivo-modeller den fleksibilitet og opløsning, som in vitro-teknikker giver.
Syntetisk cystisk fibrose spyt (SCFM2) er designet til at give et miljø for Pa vækst svarende til den, der opleves under kronisk infektion i CF lunge. SCFM2 omfatter ernæringsmæssige kilder identificeret i ekselleret CF sputa ud over mucin, lipider og DNA. Pa vækst i SCFM2 kræver en næsten identisk gen indstillet til den, der kræves for vækst i faktiske spyt og understøtter naturlige Pa aggregeret dannelse9,10. Efter podning danner planktoniske celler aggregater, der øges i størrelse gennem ekspansion. Individuelle celler (kaldet migranter) frigives fra aggregater, migrerer til ikke-kølloniserede områder og danner nye aggregater10. Denne livshistorie kan observeres ved hjælp af CLSM og billedanalyse ved opløsningen af en enkelt celle. Granulater af Pa dannet i SCFM2 er af samme størrelse som dem, der er observeret i CF lunge10. Denne model gør det muligt at observere flere aggregater af varierende størrelse i realtid og i tre dimensioner på mikronskalaen. Time-lapse mikroskopi tillader sporing af tusindvis (~ 50.000) af aggregater i et eksperiment. Brugen af billedanalysesoftware gør det muligt at kvantificere samlede fænotyper fra mikrografer, herunder samlet volumen, overfladeareal og placering i tre dimensioner til nærmeste 0,1 μm, både på de enkelte aggregat- og befolkningsniveauer. At have evnen til at gruppere aggregater efter fænotype og position gør det muligt at differentiere aggregater på forskellige udviklingsstadier med præcision samt deres reaktion på et skiftende mikromiljø6,11.
Anvendelsen af SCFM2 til at studere Pa aggregater i lav volumen og high-throughput assays gør det til en fleksibel, omkostningseffektiv model. Som et defineret medium tilbyder SCFM2 ensartethed og reproducerbarhed på tværs af flere platforme, hvilket giver en ernæringsmæssigt og fysisk relevant metode til at studere Pa aggregater in vitro9. Applikationer omfatter dens anvendelse i kombination med CLSM til at observere rumlig organisation og antibiotika tolerance ved høj opløsning (som beskrevet i denne metode papir). Evnen til at udføre eksperimenter, der giver realtidsdata i mikronskala, gør det muligt at studere interaktioner inden for arter og mellem arter, da de kan forekomme in vivo. For eksempel er SCFM2 tidligere blevet brugt til at studere den rumlige dynamik i cellecellekommunikation i samlede populationer via et netværk af systemer, der anvendes af Pa til at regulere flere gener, der bidrager til virulens og patogenese6.
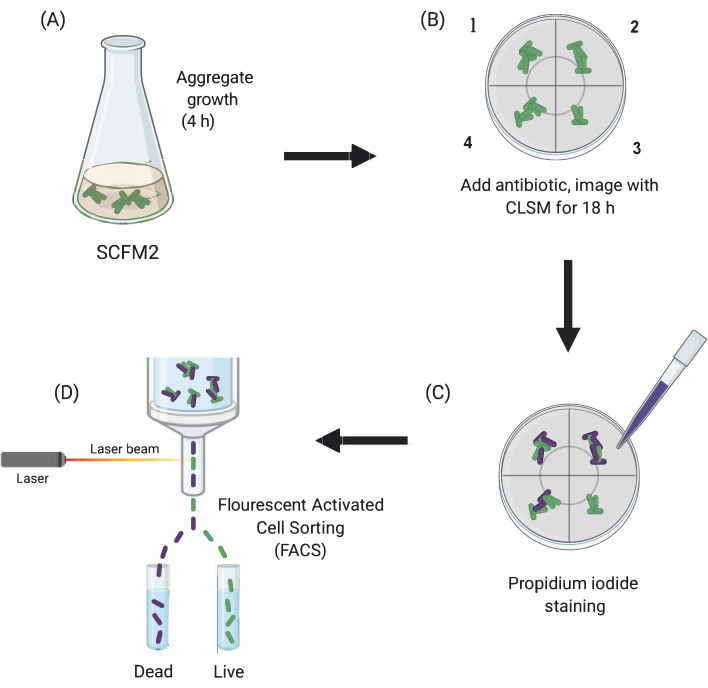
Figur 1: Grafisk skildring af de vigtigste eksperimentelle trin. (A) SCFM2 podes med Pa-celler og får lov til at danne aggregater i en glasbundet kulturskål. (B) Aggregater overføres til det konfokale mikroskop, og der tilsættes antibiotika. Afbildet er tre tekniske kopier (kamre 1-3) og en kontrol brønd (4) af podet SCFM2 uden antibiotikabehandling. Aggregater afbildes ved hjælp af CLSM i løbet af 18 timer (C) Efter den første 18-timers billeddannelse behandles aggregater med propidiumododi for at visualisere døde celler og afbildes ved hjælp af CLSM (D) Aggregater med ønsket fænotype adskilles fra SCFM2 ved hjælp af FACS. Forkortelser: SCFM2 = syntetisk cystisk fibrose spyt medium; Pa = Pseudomonas aeruginosa; CLSM = konfokal laserscanningsmikroskopi; FACS = fluorescensaktiveret cellesortering. Klik her for at se en større version af dette tal.
Her demonstreres nytten af SCFM2 til at undersøge virkningen af antibiotikabehandling på pa aggregater i realtid, efterfulgt af brugen af en cellesorteringsmetode til at isolere populationer af aggregater med forskellige fænotyper til downstream-analyse (figur 1).
Protocol
Representative Results
Discussion
Dette arbejde har indført metoder, der kan kombineres for at studere bakterielle samlede populationer i nærvær og fravær af antibiotikabehandling. Høj opløsning CLSM tillader visualisering af ændringer i den samlede biomasse og den strukturelle orientering af aggregater over realtid, når de udsættes for antibiotika. Derudover kan fysiske og strukturelle træk ved den biomasse, der er tilbage efter behandling med antibiotika, kvantificeres med det formål at korrelere disse observationer med fremtidige genekspres…
Disclosures
The authors have nothing to disclose.
Acknowledgements
S.E.D er støttet af start-up midler fra Department of Molecular Medicine, The University of South Florida, samt en CFF forskningsbevilling (DARCH19G0) N.I.H (5R21AI147654 – 02 (PI, Chen)) og USF Institute on Microbiomes. Vi takker Whiteley laboratoriet for løbende samarbejde med datasæt relateret til dette manuskript. Vi takker Dr. Charles Szekeres for at lette FACS sortering. Tallene blev skabt af A.D.G og S.E.D ved hjælp af Biorender.com.
Materials
| Amino acids | |||
| Alanine | Acr s Organics s Organics |
56-41-7 | |
| Arginine HCl | MP | 1119-34-2 | |
| Asparagine | Acr s Organics s Organics |
56-84-8 | Prepared in 0.5 M NaOH |
| Cystine HCl | Alfa Aesar | L06328 | |
| Glutamic acid HCl | Acr s Organics s Organics |
138-15-8 | |
| Glycine | Acr s Organics s Organics |
56-40-6 | |
| Histidine HCl H2O | Alfa Aesar | A17627 | |
| Isoleucine | Acr s Organics s Organics |
73-32-5 | |
| Leucine | Alfa Aesar | A12311 | |
| Lysine HCl | Alfa Aesar | J62099 | |
| Methionine | Acr s Organics s Organics |
63-68-3 | |
| Ornithine HCl | Alfa Aesar | A12111 | |
| Phenylalanine | Acr s Organics s Organics |
63-91-2 | |
| Proline | Alfa Aesar | A10199 | |
| Serine | Alfa Aesar | A11179 | |
| Threonine | Acr s Organics s Organics |
72-19-5 | |
| Tryptophan | Acr s Organics s Organics |
73-22-3 | Prepared in 0.2 M NaOH |
| Tyrosine | Alfa Aesar | A11141 | Prepared in 1.0 M NaOH |
| Valine | Acr s Organics s Organics |
72-18-4 | |
| Antibiotic | |||
| Carbenicillin | Alfa Aesar | J6194903 | |
| Day-of Stocks | |||
| CaCl2 * 2H2O | Fisher Chemical | C79-500 | |
| Dextrose (D-glucose) | Fisher Chemical | 50-99-7 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Fisher (Avanti Polar Lipids) | 4235-95-4 | shake 15-20 min at 37 °C to evaporate chloroform |
| FeSO4 * 7H2O | Acr s Organics s Organics |
7782-63-0 | this stock equals 1 mg/mL, MUST make fresh |
| L-lactic acid | Alfa Aesar | L13242 | pH stock to 7 with NaOH |
| MgCl2 * 6H2O | Acr s Organics s Organics |
7791-18-6 | |
| N-acetylglucosamine | TCI | A0092 | |
| Prepared solids | |||
| Porcine mucin | Sigma | M1778-100G | UV-sterilize |
| Salmon sperm DNA | Invitrogen | 15632-011 | |
| Stain | |||
| Propidium iodide | Alfa Aesar | J66764MC | |
| Salts | |||
| K2SO4 | Alfa Aesar | A13975 | |
| KCl | Alfa Aesar | J64189 | add solid directly to buffered base |
| KNO3 | Acr s Organics s Organics |
7757-79-1 | |
| MOPS | Alfa Aesar | A12914 | add solid directly to buffered base |
| NaCl | Fisher Chemical | S271-500 | add solid directly to buffered base |
| Na2HPO4 | RPI | S23100-500.0 | |
| NaH2PO4 | RPI | S23120-500.0 | |
| NH4Cl | Acr s Organics s Organics |
12125-02-9 | add solid directly to buffered base |
| Consumables | |||
| Conical tubes (15 mL) | Olympus plastics | 28-101 | |
| Conical tubes (50 mL) | Olympus plastics | 28-106 | |
| Culture tubes w/air flow cap | Olympus plastics | 21-129 | |
| 35 mm four chamber glass-bottom dish | CellVis | NC0600518 | |
| Luria Bertani (LB) broth | Genessee Scientific | 11-118 | |
| Phosphate-buffered saline (PBS) | Fisher Bioreagents | BP2944100 | |
| Pipet tips (p200) | Olympus plastics | 23-150RL | |
| Pipet tips (p1000) | Olympus plastics | 23-165RL | |
| Serological pipets (5 mL) | Olympus plastics | 12-102 | |
| Serological pipets (25 mL) | Olympus plastics | 12-106 | |
| Serological pipets (50 mL) | Olympus plastics | 12-107 | |
| Ultrapure water (RNAse/DNAse free); nanopure water | Genessee Scientific | 18-194 | Nanopure water used for preparation of solutions in Table 1 |
| Syringes (10 mL) | BD | 794412 | |
| Syringes (50 mL) | BD | 309653 | |
| 0.22 mm PES syringe filter | Olympus plastics | 25-244 | |
| PS cuvette semi-mico | Olympus plastics | 91-408 | |
| Software | |||
| Biorender | To prepare the figures | ||
| FacsDiva6.1.3 | Becton Dickinson, San Jose, CA | ||
| Imaris | Bitplane | version 9.6 | |
| Zen Black | |||
| Equipment | |||
| FacsAriallu | Becton Dickinson, San Jose, CA | ||
| LSM 880 confocal laser scanning microscope | Zeiss |
References
- Ramsay, K. A., et al. The changing prevalence of pulmonary infection in with fibrosis: A longitudinal analysis. Journal of Cystic Fibrosis. 16 (1), 70-77 (2017).
- Bessonova, L., et al. Data from the US and UK cystic fibrosis registries support disease modification by CFTR modulation with ivacaftor. Thorax. 73 (8), 731-740 (2018).
- Breuer, O., et al. Changing prevalence of lower airway infections in young children with cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 200 (5), 590-599 (2019).
- O’Donnell, J. N., Bidell, M. R., Lodise, T. P. Approach to the treatment of patients with serious multidrug-resistant Pseudomonas aeruginosa infections. Pharmacotherapy. 40 (9), 952-969 (2020).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Darch, S. E., et al. Spatial determinants of quorum signaling in a Pseudomonas aeruginosa infection model. Proceedings of the National Academy of Sciences of the United States of America. 115 (18), 4779-4784 (2018).
- Zhu, K., Chen, S., Sysoeva, T. A., You, L. Universal antibiotic tolerance arising from antibiotic-triggered accumulation of pyocyanin in Pseudomonas aeruginosa. PLoS Biology. 17 (12), 3000573 (2019).
- Ciofu, O., Tolker-Nielsen, T. Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents-how P. aeruginosa can escape antibiotics. Frontiers in Microbiology. 10, 913 (2019).
- Turner, K. H., Wessel, A. K., Palmer, G. C., Murray, J. L., Whiteley, M. Essential genome of Pseudomonas aeruginosa in cystic fibrosis sputum. Proceedings of the National Academy of Sciences of the United States of America. 112 (13), 4110-4115 (2015).
- Darch, S. E., et al. Phage inhibit pathogen dissemination by targeting bacterial migrants in a chronic infection model. MBio. 8 (2), 00240 (2017).
- Jorth, P., et al. Regional isolation drives bacterial diversification within cystic fibrosis lungs. Cell Host & Microbe. 18 (3), 307-319 (2015).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Davies, D. G., et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science. 280 (5361), 295-298 (1998).
- Hartmann, R., et al. Quantitative image analysis of microbial communities with BiofilmQ. Nature Microbiology. 6 (2), 151-156 (2021).
- Stacy, A., et al. Bacterial fight-and-flight responses enhance virulence in a polymicrobial infection. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7819-7824 (2014).

