Positron Emission Tomography-based Dose Radiation Therapy em um modelo de rato glioblastoma usando a plataforma de pesquisa de radiação animal de pequeno porte
Summary
Aqui apresentamos um protocolo para realizar radioterapia baseada em tomografias pré-pêtrons em um modelo de glioblastoma de ratos usando algoritmos desenvolvidos internamente para otimizar a precisão e eficiência.
Abstract
Um modelo de glioblastoma de rato para imitar o tratamento de quimioterapia-radiação do glioblastoma humano na clínica foi previamente estabelecido. Semelhante ao tratamento clínico, tomografia computadorizada (TC) e ressonância magnética (RM) foram combinadas durante o processo de planejamento do tratamento. A tomografia de emissão de pósitrons (PET) foi posteriormente adicionada para implementar o aumento de sub volume usando um sistema de microrraseamento. No entanto, a combinação de três modalidades de imagem (TC, Ressonância Magnética e PET) utilizando um sistema de microdiadistração mostrou-se trabalhosa, pois a imagem multimodal, o planejamento do tratamento e a entrega de doses devem ser concluídas sequencialmente no ambiente pré-clínico. Isso também resulta em um fluxo de trabalho mais propenso a erros humanos. Portanto, foi implementado um algoritmo fácil de usar para otimizar ainda mais o planejamento de tratamento de radiação multimodal pré-clínico baseado em imagens. Esta ferramenta de software foi utilizada para avaliar a precisão e eficiência da radioterapia de pintura de doses com micro-irradiação usando um projeto de estudo em silico . A nova metodologia para a radioterapia de pintura de doses é superior ao método descrito anteriormente em termos de precisão, eficiência de tempo e variabilidade intra e interusativa. É também um passo importante para a implementação do planejamento inverso do tratamento em micro-irradiadores, onde o planejamento futuro ainda é comumente utilizado, em contraste com os sistemas clínicos.
Introduction
Glioblastoma (GB) é um tumor cerebral primário maligno e muito agressivo. Gb é um tumor heterogêneo sólido tipicamente caracterizado por limites infiltrados, atypia nuclear e necrose1. A presença da barreira hemato-cerebral e do estado cerebral como um local imuno-privilegiado torna a descoberta de novos alvos para quimioterapia e imunoterapia uma tarefa assustadora2,3,4. Vale ressaltar que o tratamento de pacientes com GB mal mudou desde a introdução, em 2005, do protocolo Stupp que combina radioterapia de feixe externo (RT) com temozolomide concomitante, geralmente seguido por temozolomide adjuvante5. Normalmente, o protocolo Stupp é precedido por ressecção cirúrgica máxima. Portanto, abordagens alternativas de tratamento são de fundamental importância.
A radioterapia atual para pacientes com glioblastoma fornece uma dose uniforme de radiação ao volume do tumor definido. Na oncologia da radiação, há uma importante correlação dose-resposta para glioblastoma com dose crescente, que parece limitar cerca de 60 Gy, devido ao aumento da toxicidade ao cérebro normal6,7. No entanto, os tumores podem ser muito (radiobiologicamente) heterogêneos, com gradientes de nível de oxigênio e/ou grandes diferenças na densidade celular. Técnicas de imagem metabólica, como o PET, podem visualizar essas características biológicas e podem ser utilizadas para personalizar a prescrição de dose. Esta abordagem é conhecida como pintura de dose RT. Este termo foi introduzido por Ling et al. em 2000. Os autores definiram a pintura de dose RT como produzindo “distribuições de dose requintadamente conformais dentro das restrições de propagação e dispersão de radiação”8.
Existem dois tipos de pintura de dose RT, pintura de dose por contornos (DPBC), pelo qual uma dose é prescrita para um conjunto de sub-volumes aninhados, e pintura de dose por números (DPBN), pelo qual uma dose é prescrita no nível voxel. A distribuição de dose para DPBN RT pode ser extraída de imagens funcionais. A dose em cada voxel é determinada pela intensidade I do voxel correspondente na imagem, com um limite inferior e superior, para garantir que, por um lado, uma dose suficiente seja entregue a cada parte do tumor. Por outro lado, as doses não excedem um limite superior para proteger órgãos em risco e evitar a toxicidade. O método mais simples é uma interpolação linear (ver Eq. 1) entre a dose mínima Dmin e a dose máxima Dmax, variando proporcionalmente entre intensidade mínima Imax e intensidade máxima dentro do volume alvo9,10
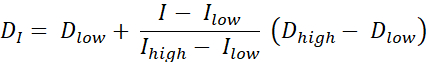 Eq. 1
Eq. 1
Como há algum ceticismo sobre a garantia de qualidade do DPBN RT, a deposição da dose deve ser verificada através de pesquisas pré-clínicas10. No entanto, apenas dados limitados podem ser adquiridos a partir de ensaios clínicos, e tem sido hipótese de que mais insights podem ser obtidos por downscaling para animais de laboratório11,12. Assim, estudos pré-clínicos utilizando plataformas de pesquisa de radiação guiadas por imagem de precisão que permitem o acoplamento com algumas técnicas muito específicas, como a autoradiografia, são adequados para examinar questões abertas e abrir caminho para a medicina personalizada e novas estratégias de tratamento, como a pintura de doses RT13,14. No entanto, a interpretação dos dados pré-clínicos deve ser realizada com cautela, e as desvantagens dessas configurações pré-clínicas devem ser consideradas14.
Sistemas de microdia irradiação, como a Small Animal Radiation Research Platform (SARRP), são equipados com tecnologias semelhantes às suas contrapartes clínicas. Eles incluem imagens ct de feixe de cone a bordo (CBCT), um sistema de planejamento de tratamento pré-clínico (PCTPS), e fornecem precisão submilímetro. Os cálculos de dose clínica são realizados pelo planejamento do tratamento inverso, pelo qual se inicia a partir da distribuição de dose desejada para determinar os feixes através de um algoritmo iterativo. Irradiadores pré-clínicos geralmente usam planejamento avançado. No planejamento futuro, a quantidade e o ângulo necessários das vigas são selecionados e, em seguida, o PCTPS calcula a distribuição da dose. A otimização dos planos é realizada por iteração manual, que é intensiva em mão-de-obra15.
Após 2009, novos desenvolvimentos tornaram possível a implementação do planejamento inverso dessas plataformas de pesquisa16,17,18. Para aumentar a semelhança com o método clínico, um colmíador retangular variável motorizado (MVC) foi desenvolvido como uma contrapartida pré-clínica do colmíador de várias folhas. Um método de pintura de dose bidimensional utilizando um colmíador variável foi publicado por Cho et al.19. Este grupo de pesquisa implementou um protocolo de planejamento de tratamento inverso tridimensional (3D) em um micro-irradiador e determinou doses mínimas e máximas para o volume alvo e uma dose máxima para os órgãos em risco. Essas técnicas têm sido avaliadas principalmente em sílico, e suas aplicações pré-clínicas precisam ser exploradas.
Este artigo apresenta um estudo em silico para comparar duas metodologias para [18F]-fluoro-ethyl-L-tyrosine ([18F]FET) pintura de dose pet em um modelo de rato GB20,21,22 usando uma pequena plataforma de pesquisa de radiação animal. Estas duas metodologias são (1) aumento de sub volume usando tamanhos de feixe predefinidos e (2) pintura de dose usando um colômulo variável motorizado onde as dimensões da mandíbula são modificadas com base na absorção do rastreador PET no volume do tumor. [18F] FET é um rastreador PET frequentemente usado em neuro-oncologia devido à sua capacidade de detectar tumores cerebrais23. [18F] FET é um aminoácido artificial que é internalizado em células tumorais, mas não incorporado em proteínas celulares. [18F] A absorção de FET corresponde à taxa de proliferação celular, densidade celular tumoral e angiogênese24. Como este é o rastreador PET cerebral oncológico mais utilizado no instituto desses autores, este radiotracer foi escolhido para avaliar o novo fluxo de trabalho.
Protocol
Representative Results
Discussion
Um modelo gb de rato para imitar o tratamento de quimioterapia-radiação na clínica para pacientes com glioblastoma foi descrito anteriormente20. Semelhante ao método clínico, a TC e a ressonância magnética foram combinadas durante o processo de planejamento do tratamento para obter irradiação mais precisa. Uma cama multimodalidade para minimizar o movimento (cabeça) foi usada quando o animal foi movido de um sistema de imagem para outro. Posteriormente, a imagem PET foi adicionada ao pro…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de agradecer à Fundação Lux Luka por apoiar este trabalho.
Materials
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | – | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | – | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | – | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | – | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | – | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | – | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain – Mouse Whole Body Volumecoil | Bruker Biospin | – | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | – | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
References
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).

