果蝇卵母细胞的核迁移
Summary
在 果蝇中,卵母细胞核在形成过程中经历微管依赖性迁移。在这里,我们描述了一个协议,这是开发,以遵循迁移,通过执行现场成像的鸡蛋室 前vive。我们的程序保持卵室活12小时,以获得多位置3D延时电影使用旋转盘共聚焦显微镜。
Abstract
活细胞成像对于了解调节细胞运动、细胞骨架重新排列或细胞内极性模式的细胞和分子机制尤为必要。在研究卵母细胞核定位时,实时成像技术对于捕捉这个过程的动态事件至关重要。 果蝇 卵室是一个多细胞结构和一个很好的模型系统来研究这种现象,因为它的大小和众多的遗传工具可用性。在 嗜血杆菌 中期生成期间,细胞核从卵母细胞内的中心位置迁移,采用由微管生成的力介导的不对称位置。这种细胞核的迁移和定位对于确定胚胎的极性轴和随后的成年苍蝇是必要的。这种迁移的一个特点是,它发生在三个维度(3D),创造了一个活成像的必要性。因此,为了研究调节核迁移的机制,我们制定了一个培养解剖卵室的协议,并利用旋转盘共聚焦显微镜进行12小时的实时成像。总的来说,我们的条件使我们能够长期保存 果蝇 卵室,从而使核迁移的完成能够在大量3D样品中实现。
Introduction
几年来,嗜血性卵母细胞已成为研究核迁移的示范系统。嗜血性卵母细胞在称为卵室的多细胞结构中发育。卵室包括16个生殖细胞(15个护士细胞和卵母细胞),周围环绕着上皮层的卵泡体细胞。卵室发育被细分为14个阶段(图1A),在此期间卵母细胞将生长并积累胚胎早期发育所需的储备。在开发过程中,在微管重组和母体决定因素的不对称传输时,卵母细胞沿着前体和多鼻体轴两极分化。这些轴确定胚胎和成人的后续极性轴产生于这个卵母细胞1的受精。在形成过程中,细胞核在卵母细胞中采用不对称位置。在第6阶段,细胞核以细胞为中心。当卵母细胞接收到的后卵泡细胞发出的尚未识别的信号时,细胞核会在第7阶段(图1B)2、3阶段向前等离子体膜和横向等离子体膜之间的交叉处迁移。此不对称位置需要诱导多索-文特轴的确定。
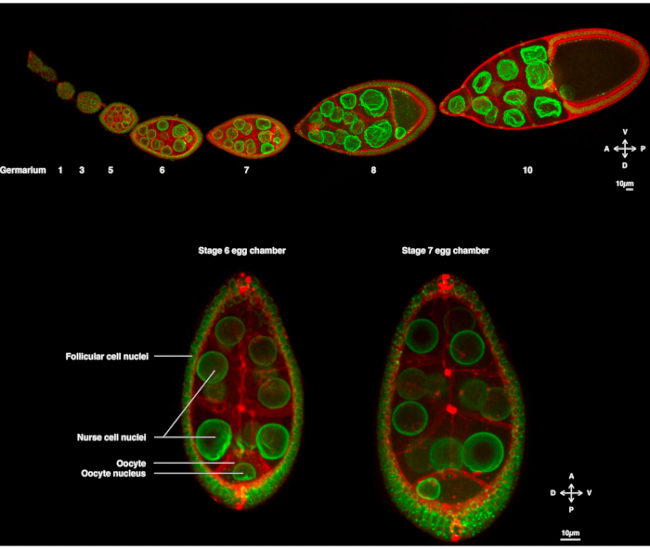
图1:果蝇黑色素加斯特卵室。(A) 转基因苍蝇的固定卵磷表示Fs(2)Ket-GFP,标记核信封和泛素-PH-RFP,标记等离子体膜。卵变由不同阶段的卵子室组成。成熟度沿着前后轴增加,前尖端(左)的天体和后尖的较旧阶段(右)。(B) 活蛋室的Z-投影,通过旋转盘共聚焦显微镜在卵母细胞的6级(左),其中细胞核以卵母细胞为中心。核将迁移到第7阶段(右)与前血浆膜(卵母细胞和护士细胞之间)和侧向血浆膜(卵母细胞和卵泡细胞之间)接触时采用不对称位置。此位置将诱导经侧的确定,从而诱导蛋室的圆周- 静脉轴。请单击此处查看此图的较大版本。
几十年来,这种核迁移一直通过免疫染色在固定组织上进行研究。这种方法显然证明这个过程依赖于一个密集的微管网络4,5。最近,我们开发了一个协议,提供条件兼容的活成像的卵母细胞在几个小时内,使有可能研究这个过程动态6。
因此,我们首次能够描述,细胞核在迁移过程中具有优先和特征轨迹,一个沿着前等离子膜(APM),另一个沿着卵母细胞的横向等离子膜(LPM)(图2)。这些最新成果强调了实时成像协议在研究核迁移等动态过程时的重要性。
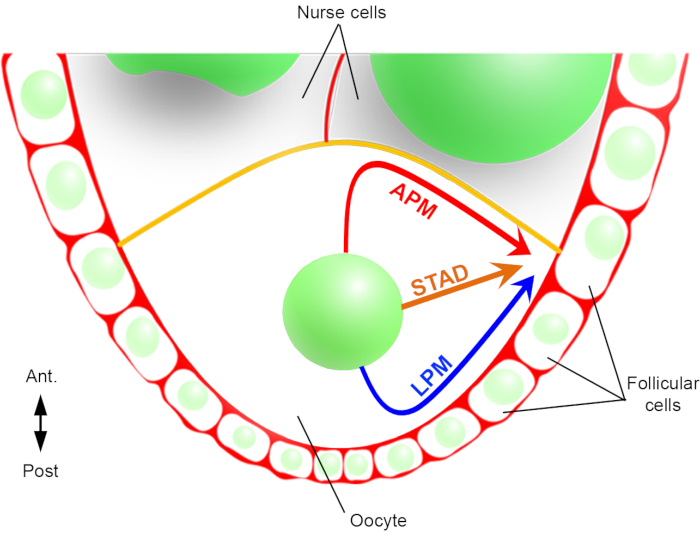
图2:细胞核不同迁移路径的示意图表示。在卵母细胞形成的第6阶段,卵母细胞是一个具有中央核的大细胞。在此阶段,前后极性轴设置与卵母细胞的后/横等离子膜接触卵泡细胞和前血浆膜(黄色)与护士细胞2接触。我们以前曾报告说,细胞核可以沿着前等离子膜(APM),沿着侧质等离子膜(LPM),或通过细胞质(STAD,直接迁移到前额皮层)6。请单击此处查看此图的较大版本。
卵母细胞核迁移是一种大约3h6的现象,到目前为止,触发实际迁移开始的事件还不得而知。用于研究这种机制的蛋白质突变体也会推迟迁移的开始。这些未知变量促使我们获得图像在很长一段时间内(10-12小时)。因此,确保卵母细胞存活是很重要的。随着蛋室的发展,它沿着前后轴从球形拉长到椭圆形。这种拉长是由卵泡细胞的旋转驱动的,卵泡细胞从第1阶段到第8阶段,垂直于前后轴7。此外,卵室周围还环绕着具有脉动特性肌肉的管状护套。其生理功能是将发育中的卵泡连续推向卵管8。为了限制解剖后诱导卵室振荡的运动,我们设计了一个高度为150微米的观测微室(图3A)。这个高度略高于10级和11级的卵泡大小。它大大限制了样品的垂直运动,同时保留了卵室的旋转,从而导致卵泡发育的有限缺陷。然后,我们使用旋转盘共聚焦显微镜对解剖的卵室进行 12 小时的实时成像。在这里,我们描述了我们研究第6阶段和第7阶段之间的卵母细胞核迁移的议定书。
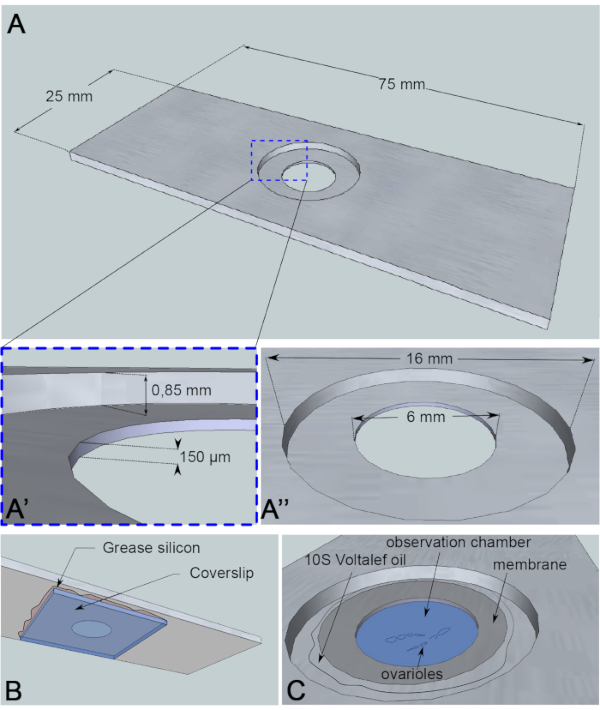
图3:观察室的示意图表示。(A) (上视图) 铝滑梯的精确尺寸与在滑梯中间钻的井的高度 (A’) 和周长 (A’) 。(B) (下视图) 封堵油井的盖片用硅润滑脂密封在滑梯上。(C) (上图) 解剖的卵巢在气体渗透膜覆盖的成像介质中发展。光环碳油用于稳定膜。请单击此处查看此图的较大版本。
为了跟踪核迁移并精确评估卵母细胞的轨迹,需要核包络和等离子体膜的标记。为此,选择了两个信号/噪声比高且不会在实时成像过程中褪色的转基因基因。为了标记等离子膜,建议使用 P[ubi-PH-RFP] 对人类磷脂酶C ∂(PLC∂1)的普莱克斯特林同源(PH)域进行编码。此 PH 域与沿卵母细胞9的等离子膜分布的磷酸二肽 PI (4,5)P2 结合。对于核包络 , P [ PPT – un1 ] Fs ( 2 ) Ket – GFP 蛋白陷阱菌株,其中 GFP 入编码的基因中 , Drosophila+ – 进口显示一个同质和强烈的信号10 。幼蝇(1-2天大)在卵巢解剖前被放置在含有干酵母24-48小时的新鲜小瓶中。
对于这种实时成像检测,一块1毫米厚的铝片,对样品没有反应,已被切成显微镜滑梯的尺寸。滑梯中央有一个直径为16毫米的孔,该孔已被反向到0.85毫米。这个计数器有一个直径为6毫米的孔,深度为150μm(图3A)。盖片粘在铝室底部的硅胶油脂(样品惰性)(图3B)。将样品放入中等填充井中后,将渗透到O2/CO2交换的膜放在中型油上,周围是卤化碳油(图3C)。
对于解剖,建议使用尖端尺寸为 0.05 x 0.02 mm 的不锈钢钳子和直径为 0.20 mm 的针头进行卵巢分离(图 4B,C)。迁移核在装有摄像头的旋转盘反向显微镜 CSU-X1 上成像。在 24 °C 下每 15 分钟通过延时获取多位置图像。 15 分钟的间隔允许进行多位置采集,对荧光蛋白的光照漂烁有限,并且样品的光毒性有限。此外,较短的间隔不会提供更多的信息数据来跟踪核轨迹。电影是通过斐济软件11处理和分析。
Protocol
Representative Results
Discussion
其他协议描述如何准备和培养果蝇卵室前活体活成像检测12,13。此协议的新颖性是使用使用空心铝滑梯、覆盖滑梯和 O2/CO 2渗透膜构建的成像室。此设置的主要优点是限制 Z 中的移动,而不会对样品施加压力。因此,卵母细胞仍然可以自由移动,这就是为什么首先,使用40倍的目标,第二,z堆栈沿40μm获得,而卵母细胞是大约20μm…
Disclosures
The authors have nothing to disclose.
Acknowledgements
我们非常感谢让-安托万·莱佩桑特和尼古拉斯·蒂索,他们最初开发了协议,并与我们分享了图3的一些图形元素。我们感谢范妮·罗兰-戈塞林,他拍摄了图4的照片。我们还感谢其他实验室成员的有益讨论,这些讨论有助于改进这项技术,纳撒尼尔·亨尼曼的评论帮助改进了这份手稿。我们感谢法国生物成像(ANR-10-INBS-04)成员雅克·莫诺德研究所的ImagoSeine核心设施。Maélys Loh 得到了法国研究部 (MESRI) 的博士奖学金的支持。安托万·吉切特和弗雷德·伯纳德得到了ARC(授予PJA20181208148)、癌症企业协会(2020年#221366授予Gefluc)和巴黎IdEx大学(ANR-18-IDEX-0001)的新兴赠款的支持。
Materials
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24×50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 – 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 – 188 | Observation-chamber preparation |
References
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. 발생학. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ‘ n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).

