Migration nucléaire dans l’ovocyte de la drosophile
Summary
Chez la drosophile,le noyau de l’ovocyte subit une migration dépendante des microtubules au cours de l’oogenèse. Ici, nous décrivons un protocole qui a été développé pour suivre la migration en effectuant une imagerie en direct sur des chambres d’œufs ex-vivo. Notre procédure maintient les chambres à œufs en vie pendant 12 h pour acquérir des films time-lapse 3D multi-positions en utilisant la microscopie confocale à disque rotatif.
Abstract
L’imagerie des cellules vivantes est particulièrement nécessaire pour comprendre les mécanismes cellulaires et moléculaires qui régulent les mouvements des organites, les réarrangements du cytosquelette ou les modèles de polarité dans les cellules. Lors de l’étude du positionnement du noyau ovocytaire, les techniques d’imagerie en direct sont essentielles pour capturer les événements dynamiques de ce processus. La chambre à œufs de la drosophile est une structure multicellulaire et un excellent système modèle pour étudier ce phénomène en raison de sa grande taille et de la disponibilité de nombreux outils génétiques. Au cours de la mi-oogenèse de la drosophile, le noyau migre d’une position centrale dans l’ovocyte pour adopter une position asymétrique médiée par des forces générées par des microtubules. Cette migration et ce positionnement du noyau sont nécessaires pour déterminer les axes de polarité de l’embryon et de la mouche adulte suivante. L’une des caractéristiques de cette migration est qu’elle se produit en trois dimensions (3D), ce qui crée une nécessité pour l’imagerie en direct. Ainsi, pour étudier les mécanismes qui régulent la migration nucléaire, nous avons développé un protocole pour mettre en culture les chambres à œufs disséquées et effectuer une imagerie en direct pendant 12 h par acquisitions time-lapse à l’aide de la microscopie confocale à disque rotatif. Dans l’ensemble, nos conditions nous permettent de préserver les chambres à œufs de la drosophile vivante pendant une longue période, permettant ainsi de visualiser l’achèvement de la migration nucléaire dans un grand nombre d’échantillons en 3D.
Introduction
Depuis plusieurs années, l’ovocyte de la drosophile est devenu un système modèle pour étudier la migration nucléaire. L’ovocyte de la drosophile se développe dans une structure multicellulaire appelée chambre à œufs. Les chambres à ovules englobent 16 cellules germinales (15 cellules nourricières et l’ovocyte) entourées d’une couche épithéliale de cellules somatiques folliculaires. Le développement de la chambre à ovules a été subdivisé en 14 étapes(Figure 1A),au cours desquelles l’ovocyte se développera et accumulera les réserves nécessaires au développement précoce de l’embryon. Au cours du développement, lors de la réorganisation des microtubules et du transport asymétrique des déterminants maternels, l’ovocyte se polarise le long des axes antéro-dorsal et dorso-ventral. Ces axes déterminent les axes de polarité ultérieurs de l’embryon et de l’adulte résultant de la fécondation de cet ovocyte1. Au cours de l’oogenèse, le noyau adopte une position asymétrique dans l’ovocyte. Au stade 6, le noyau est centré dans la cellule. Sur un signal encore à identifier émis par les cellules folliculaires postérieures qui est reçu par l’ovocyte, le noyau migre vers l’intersection entre les membranes plasmiques antérieure et latérale au stade 7 (Figure 1B)2,3. Cette position asymétrique est nécessaire pour induire la détermination de l’axe dorso-ventral.
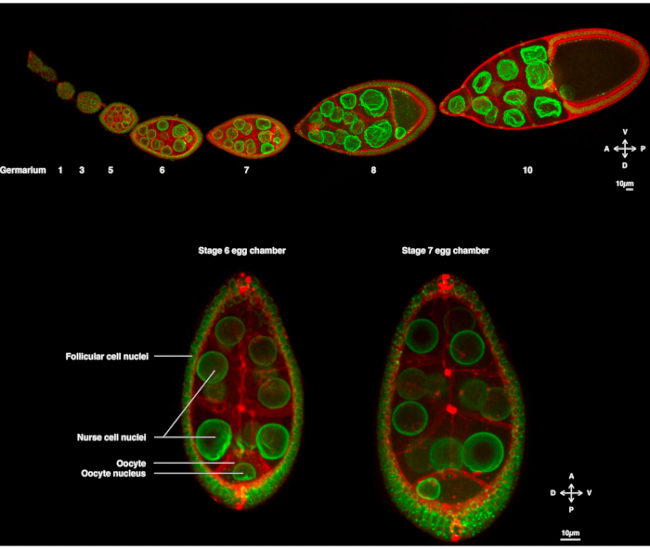
Figure 1: Chambres à œufs de Drosophila melanogaster. (A) Ovariole fixe de mouches transgéniques exprimant Fs(2)Ket-GFP qui marque les enveloppes nucléaires et ubi-PH-RFP qui marque les membranes plasmiques. L’ovariole est composée de chambres à œufs en développement à différents stades. La maturation augmente le long de l’axe antéro-postérieur avec le germarium à l’extrémité antérieure (à gauche) où réside la cellule souche germinale et le stade plus ancien à l’extrémité postérieure (à droite). (B) Projection Z de la chambre à œufs vivante par microscopie confocale à disque rotatif au stade 6 de l’oogenèse (à gauche), dans laquelle le noyau est centré dans l’ovocyte. Le noyau migrera pour adopter une position asymétrique au stade 7 (à droite) au contact de la membrane plasmique antérieure (entre l’ovocyte et la cellule nourricière) et de la membrane plasmique latérale (entre l’ovocyte et les cellules folliculaires). Cette position induira la détermination de la face dorsale et, par conséquent, de l’axe dorso-ventral de la chambre à œufs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pendant de nombreuses décennies, cette migration nucléaire a été étudiée sur des tissus fixes par immunocoloration. Cette approche a notamment permis de démontrer que ce procédé dépend d’un réseau dense de microtubules4,5. Plus récemment, nous avons développé un protocole proposant des conditions compatibles avec l’imagerie en direct de l’ovocyte pendant plusieurs heures permettant d’étudier ce processus dynamiquement6.
Ainsi, pour la première fois, nous avons pu décrire que le noyau a des trajectoires préférentielles et caractéristiques lors de sa migration, l’une le long de la membrane plasmique antérieure (APM) et l’autre le long de la membrane plasmique latérale (LPM) de l’ovocyte(Figure 2). Ces derniers résultats soulignent l’importance des protocoles d’imagerie en direct lors de l’étude des processus dynamiques tels que la migration nucléaire.
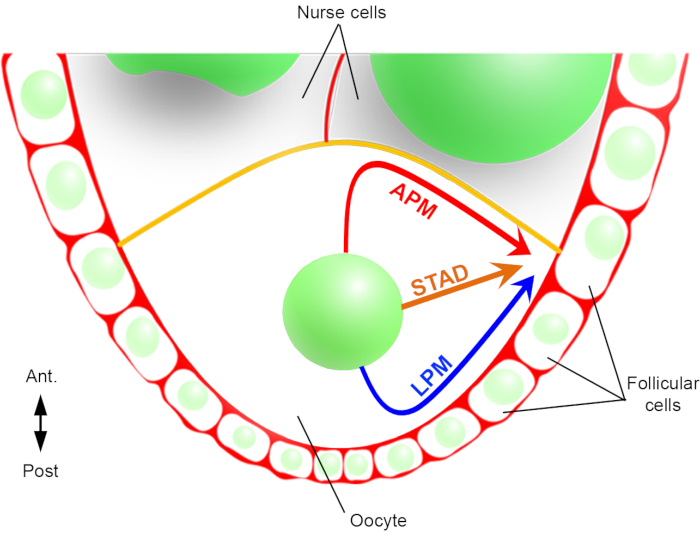
Figure 2: Représentation schématique des différentes voies de migration du noyau. Au stade 6 de l’oogenèse, l’ovocyte est une grande cellule avec un noyau central. A ce stade, l’axe de polarité antéro-postérieur est fixé avec une membrane plasmique postérieure/latérale de l’ovocyte en contact avec les cellules folliculaires et la membrane plasmique antérieure (en jaune) est en contact avec les cellules nourricières2. Nous avons précédemment rapporté que le noyau pouvait migrer soit le long de la membrane plasmique antérieure (APM), le long de la membrane plasmique latérale (LPM), soit à travers le cytoplasme (STAD, directement vers le cortex antéro-dorsal)6. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La migration du noyau ovocytaire est un phénomène d’environ 3 h6, et jusqu’à présent, l’événement déclenchant le début de la migration réelle est inconnu. Le début de la migration peut également être retardé par les mutants protéiques utilisés pour étudier ce mécanisme. Ces variables inconnues nous ont motivés à acquérir des images sur de longues périodes (10-12 h). Il est donc important de s’assurer que les ovocytes restent vivants. Au fur et à mesure que la chambre à œufs se développe, elle s’allonge le long de l’axe antéro-postérieur d’une forme sphérique à une forme elliptique. Cet allongement est entraîné par la rotation des cellules folliculaires, qui se produit du stade 1 au stade 8, perpendiculairement à l’axe antéro-postérieur7. De plus, une gaine tubulaire de muscle à propriété pulsatile entoure les chambres à œufs. Sa fonction physiologique est de pousser les follicules en développement vers l’oviducte en continu8. Afin de limiter les mouvements qui induisent des oscillations des chambres à œufs après leur dissection, nous avons conçu une micro-chambre d’observation mesurant 150 μm de hauteur(Figure 3A). Cette hauteur est légèrement supérieure à la taille d’un follicule aux stades 10 et 11. Il limite considérablement les mouvements verticaux de l’échantillon tout en préservant la rotation de la chambre à œufs, ce qui entraîne des défauts limités dans le développement des follicules. Nous effectuons ensuite une imagerie en direct pendant 12 h sur des chambres à œufs disséquées par des acquisitions time-lapse multi-positions à l’aide d’un microscope confocal à disque rotatif. Nous décrivons ici notre protocole d’étude de la migration nucléaire des ovocytes entre les stades 6 et 7.
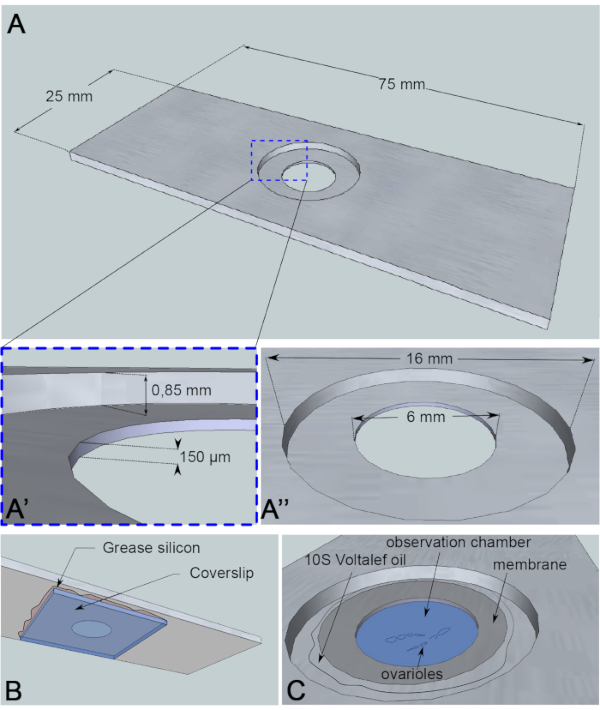
Figure 3: Représentation schématique de la chambre d’observation. (A) (Vue de dessus) Dimensions précises de la glissière en aluminium avec les hauteurs (A’) et les circonférences (A”) du puits foré au milieu de la glissière. (B) (Vue du bas) Un couvercle bloquant le puits est scellé à la glissière avec de la graisse de silicium. (C) (Vue de dessus) Les ovarioles disséqués se développent dans un milieu d’imagerie recouvert d’une membrane perméable aux gaz. L’huile d’halocarbure est utilisée pour stabiliser la membrane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Afin de suivre la migration nucléaire et d’évaluer avec précision les trajectoires dans l’ovocyte, des marqueurs pour l’enveloppe nucléaire et la membrane plasmique sont nécessaires. Dans ce but, deux transgènes ayant un rapport signal/bruit élevé et ne s’estompant pas au cours de l’imagerie en direct ont été sélectionnés. Pour étiqueter la membrane plasmique, l’utilisation d’un P[ubi-PH-RFP] qui code le domaine d’homologie de Pleckstrin (PH) de la phospholipase humaine C ∂1 (PLC∂1) fusionnée à la RFP est recommandée. Ce domaine PH se lie au phosphoinositide PI(4,5)P2 distribué le long de la membrane plasmique de l’ovocyte9. Pour l’enveloppe nucléaire, la souche piège protéique P[PPT-un1]Fs(2)Ket-GFP où la GFP est insérée dans le gène codant pour la drosophile ß-importine présente un signal homogène et intense10. Les jeunes mouches (âgées de 1 à 2 jours) sont placées dans des flacons frais contenant de la levure sèche 24 à 48 heures avant la dissection des ovaires.
Pour ce test d’imagerie en direct, un morceau d’aluminium de 1 mm d’épaisseur, qui n’est pas réactif pour l’échantillon, a été découpé dans les dimensions d’une lame de microscopie. Il a un trou de 16 mm de diamètre au centre de la glissière qui a été contre-alésé à 0,85 mm. Ce contre-alésage a un trou supplémentaire de 6 mm de diamètre avec une profondeur de 150 μm(Figure 3A). Un couvercle est collé avec de la graisse de silicone (inerte pour l’échantillon) au fond de la chambre en aluminium(Figure 3B). Après avoir placé les échantillons dans le puits rempli de milieu, une membrane perméable à l’échange O2/CO2 est placée sur le milieu et entourée d’huile halocarbonée(Figure 3C).
Pour la dissection, il est recommandé d’utiliser des pinces en acier inoxydable d’une dimension de pointe de 0,05 x 0,02 mm et des aiguilles de 0,20 mm de diamètre pour la séparation des ovarioles (Figure 4B, C). Les noyaux migrateurs sont imagés sur un microscope confocal inversé à disque rotatif CSU-X1 équipé d’une caméra. Les images multi-positions ont été acquises par time-lapse toutes les 15 minutes à 24 °C. Un intervalle de 15 minutes permet d’effectuer des acquisitions multi-positions avec un photobleachage limité des protéines fluorescentes et une phototoxicité pour les échantillons. En outre, un intervalle plus court ne fournirait pas beaucoup plus de données informatives pour suivre les trajectoires nucléaires. Les films sont traités et analysés via le logiciel Fidji11.
Protocol
Representative Results
Discussion
D’autres protocoles décrivent comment préparer et mettre en culture des chambres d’œufs de drosophile ex vivo pour un essai d’imagerie vivante12,13. La nouveauté de ce protocole est l’utilisation d’une chambre d’imagerie construite à l’aide d’une lame en aluminium évidée, d’un couvercle et d’une membrane perméableO2 / CO2. Le principal avantage de cette configuration est de limiter le mouvement en Z sans …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous sommes extrêmement reconnaissants à Jean-Antoine Lepesant et Nicolas Tissot qui ont développé le protocole à l’origine et partagé avec nous quelques éléments graphiques de la Figure 3. Nous remercions Fanny Roland-Gosselin qui a pris les photos de la figure 4. Nous remercions également les autres membres du laboratoire pour les discussions utiles qui ont contribué à l’amélioration de cette technique et Nathaniel Henneman pour ses commentaires qui ont contribué à améliorer ce manuscrit. Nous reconnaissons l’installation centrale ImagoSeine de l’Institut Jacques Monod, membre de France-BioImaging (ANR-10-INBS-04). Maëlys Loh est soutenu par une bourse de doctorat du ministère de la Recherche de l’Français (MESRI). Antoine Guichet et Fred Bernard ont été soutenus par l’ARC (Grant PJA20181208148), l’Association des Entreprises contre le Cancer (Grant Gefluc 2020 #221366) et par une bourse Emergence d’IdEx Université de Paris (ANR-18-IDEX-0001).
Materials
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24×50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 – 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 – 188 | Observation-chamber preparation |
References
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. 발생학. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ‘ n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).

