Migrazione nucleare nell'ovocita di Drosophila
Summary
In Drosophila, il nucleo dell’ovocita subisce una migrazione microtubule-dipendente durante l’oogenesi. Qui, descriviamo un protocollo che è stato sviluppato per seguire la migrazione eseguendo l’imaging dal vivo su camere di uova ex-vivo. La nostra procedura mantiene in vita le camere delle uova per 12 ore per acquisire filmati time-lapse 3D multi-posizione utilizzando la microscopia confocale a disco rotante.
Abstract
L’imaging di cellule vive è particolarmente necessario per comprendere i meccanismi cellulari e molecolari che regolano i movimenti degli organelli, i riarrangiamenti del citoscheletro o il pattern di polarità all’interno delle cellule. Quando si studia il posizionamento del nucleo ovocitario, le tecniche di live-imaging sono essenziali per catturare gli eventi dinamici di questo processo. La camera dell’uovo Di Drosophila è una struttura multicellulare e un eccellente sistema modello per studiare questo fenomeno a causa delle sue grandi dimensioni e della disponibilità di numerosi strumenti genetici. Durante la Mid-oogenesi della Drosophila, il nucleo migra da una posizione centrale all’interno dell’ovocita per adottare una posizione asimmetrica mediata da forze generate da microtubuli. Questa migrazione e il posizionamento del nucleo sono necessari per determinare gli assi di polarità dell’embrione e della successiva mosca adulta. Una caratteristica di questa migrazione è che si verifica in tre dimensioni (3D), creando una necessità per l’imaging dal vivo. Pertanto, per studiare i meccanismi che regolano la migrazione nucleare, abbiamo sviluppato un protocollo per la coltura delle camere delle uova sezionate ed eseguire l’imaging dal vivo per 12 ore mediante acquisizioni time-lapse utilizzando la microscopia confocale a disco rotante. Nel complesso, le nostre condizioni ci consentono di preservare in vita le camere delle uova di Drosophila per un lungo periodo di tempo, consentendo così di visualizzare il completamento della migrazione nucleare in un gran numero di campioni in 3D.
Introduction
Per diversi anni, l’ovocita Drosophila è emerso come un sistema modello per studiare la migrazione nucleare. L’ovocita Drosophila si sviluppa in una struttura multicellulare chiamata camera dell’uovo. Le camere degli ovuli comprendono 16 cellule germinali (15 cellule nutrici e l’ovocita) circondate da uno strato epiteliale di cellule somatiche follicolari. Lo sviluppo della camera d’uovo è stato suddiviso in 14 fasi (Figura 1A), durante le quali l’ovocita crescerà e accumulerà le riserve necessarie per lo sviluppo precoce dell’embrione. Durante lo sviluppo, dopo la riorganizzazione dei microtubuli e il trasporto asimmetrico dei determinanti materni, l’ovocita si polarizza lungo gli assi antero-dorsale e dorso-ventrale. Questi assi determinano i successivi assi di polarità dell’embrione e dell’adulto derivanti dalla fecondazione di questo ovocita1. Durante l’oogenesi, il nucleo adotta una posizione asimmetrica nell’ovocita. Nella fase 6, il nucleo è centrato nella cellula. Su un segnale ancora da identificare emesso dalle cellule follicolari posteriori che viene ricevuto dall’ovocita, il nucleo migra verso l’intersezione tra le membrane plasmatiche anteriore e laterale nello stadio 7 (Figura 1B)2,3. Questa posizione asimmetrica è necessaria per indurre la determinazione dell’asse dorso-ventrale.
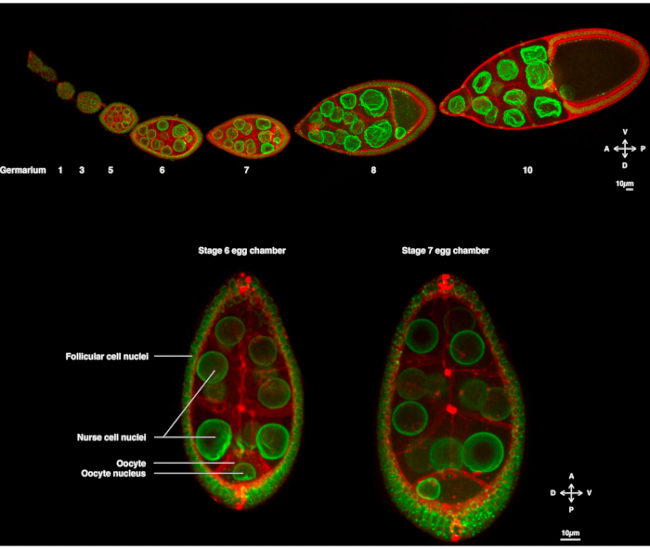
Figura 1: Drosophila melanogaster camere d’uovo. (A) Ovariole fisso da mosche transgeniche che esprimono Fs(2)Ket-GFP che etichetta gli involucri nucleari e ubi-PH-RFP che etichetta le membrane plasmatiche. L’ovariole è composto da camere per uova in via di sviluppo in diverse fasi. La maturazione aumenta lungo l’asse antero-posteriore con il germario sulla punta anteriore (a sinistra) dove risiede la cellula staminale germinale e lo stadio più vecchio sulla punta posteriore (a destra). (B) Proiezione Z della camera dell’uovo vivente mediante microscopia confocale a disco rotante allo stadio 6 dell’oogenesi (a sinistra), in cui il nucleo è centrato nell’ovocita. Il nucleo migrerà per adottare una posizione asimmetrica allo stadio 7 (a destra) a contatto con la membrana plasmatica anteriore (tra l’ovocita e la cellula nutrice) e la membrana plasmatica laterale (tra l’ovocita e le cellule follicolari). Questa posizione indurrà la determinazione del lato dorsale e, quindi, dell’asse dorso-ventrale della camera dell’uovo. Fare clic qui per visualizzare una versione più grande di questa figura.
Per molti decenni, questa migrazione nucleare è stata studiata su tessuti fissi mediante immuno colorazione. Questo approccio ha notevolmente permesso di dimostrare che questo processo dipende da una fitta rete di microtubuli4,5. Più recentemente, abbiamo sviluppato un protocollo che offre condizioni compatibili con l’imaging dal vivo dell’ovocita per diverse ore che consentono di studiare questo processo in modo dinamico6.
Quindi, per la prima volta, siamo stati in grado di descrivere che il nucleo ha traiettorie preferenziali e caratteristiche durante la sua migrazione, una lungo la membrana plasmatica anteriore (APM) e un’altra lungo la membrana plasmatica laterale (LPM) dell’ovocita (Figura 2). Questi ultimi risultati sottolineano l’importanza dei protocolli di live-imaging quando si studiano processi dinamici come la migrazione nucleare.
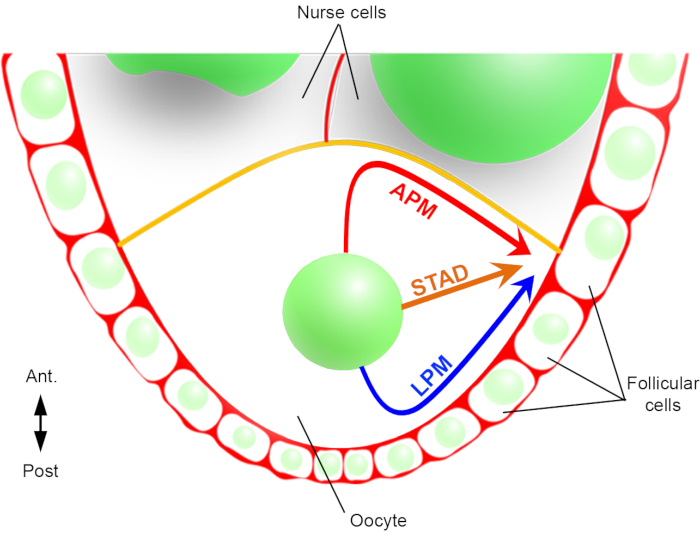
Figura 2: Rappresentazione schematica dei diversi percorsi di migrazione del nucleo. Allo stadio 6 dell’oogenesi, l’ovocita è una grande cellula con un nucleo centrale. In questa fase, l’asse di polarità antero-posteriore è impostato con una membrana plasmatica posteriore/laterale dell’ovocita a contatto con le cellule follicolari e la membrana plasmatica anteriore (in giallo) è in contatto con le cellule nutrici2. Abbiamo precedentemente riportato che il nucleo potrebbe migrare lungo la membrana plasmatica anteriore (APM), lungo la membrana plasmatica laterale (LPM), o attraverso il citoplasma (STAD, direttamente alla corteccia antero-dorsale)6. Fare clic qui per visualizzare una versione più grande di questa figura.
La migrazione del nucleo ovocitario è un fenomeno di circa 3 h6e finora l’evento che innesca l’inizio della migrazione effettiva è sconosciuto. L’inizio della migrazione può anche essere ritardato dai mutanti proteici utilizzati per studiare questo meccanismo. Queste variabili sconosciute ci hanno motivato ad acquisire immagini per lunghi periodi di tempo (10-12 ore). È quindi importante garantire che gli ovociti rimangano vivi. Man mano che la camera dell’uovo si sviluppa, si allunga lungo l’asse antero-posteriore da una forma sferica a una ellittica. Questo allungamento è guidato dalla rotazione delle cellule follicolari, che si verifica dallo stadio 1 allo stadio 8, perpendicolare all’asse antero-posteriore7. Inoltre, una guaina tubolare di muscolo con proprietà pulsatile circonda le camere delle uova. La sua funzione fisiologica è quella di spingere i follicoli in via di sviluppo verso l’ovidotto continuamente8. Al fine di limitare i movimenti che inducono oscillazioni delle camere delle uova dopo la loro dissezione, abbiamo progettato una microcamera di osservazione di 150 μm di altezza (Figura 3A). Questa altezza è leggermente superiore alla dimensione di un follicolo negli stadi 10 e 11. Limita considerevolmente i movimenti verticali del campione preservando la rotazione della camera delle uova, con conseguenti difetti limitati nello sviluppo del follicolo. Eseguiamo quindi l’imaging dal vivo per 12 ore su camere di uova sezionate mediante acquisizioni time-lapse multi-posizione utilizzando un microscopio confocale a disco rotante. Qui descriviamo il nostro protocollo per studiare la migrazione nucleare degli ovociti tra gli stadi 6 e 7.
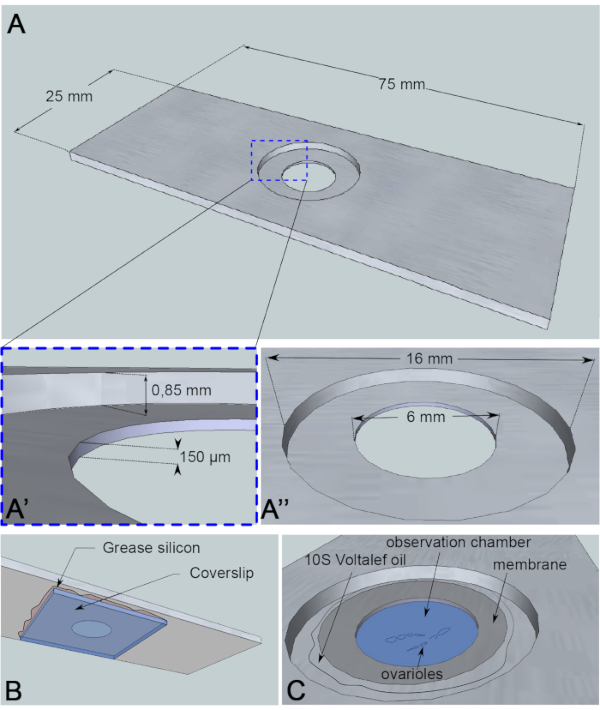
Figura 3: Rappresentazione schematica della camera di osservazione. (A) (Vista dall’alto) Dimensioni precise della slitta di alluminio con le altezze (A’) e le circonferenze (A”) del pozzo perforato al centro della slitta. (B) (vista in basso) Un coperchio che blocca il pozzo è sigillato al vetrino con grasso di silicio. (C) (Vista dall’alto) Gli ovarioli sezionati si sviluppano in un mezzo di imaging coperto da una membrana permeabile ai gas. L’olio di alocarbonio viene utilizzato per stabilizzare la membrana. Fare clic qui per visualizzare una versione più grande di questa figura.
Per seguire la migrazione nucleare e valutare con precisione le traiettorie nell’ovocita, sono necessari marcatori sia per l’involucro nucleare che per la membrana plasmatica. A tal fine, sono stati selezionati due transgeni che hanno un elevato rapporto segnale/rumore e non svaniscono nel corso dell’imaging dal vivo. Per etichettare la membrana plasmatica, si raccomanda l’uso di un P[ubi-PH-RFP] che codifica il dominio Pleckstrin Homology (PH) della Fosfolipasi C Umana ∂1 (PLC∂1) fuso a RFP. Questo dominio PH si lega al fosfoinositide PI(4,5)P2 distribuito lungo la membrana plasmatica dell’ovocita9. Per l’involucro nucleare, il ceppo di trappola proteica P[PPT-un1]Fs(2)Ket-GFP in cui GFP è inserito all’interno del gene che codifica per la Drosophila ß-importina mostra un segnale omogeneo e intenso10. Le giovani mosche (1-2 giorni) vengono poste in fiale fresche contenenti lievito secco 24-48 ore prima della dissezione ovarica.
Per questo test di live-imaging, un pezzo di alluminio di 1 mm di spessore, che non è reattivo per il campione, è stato tagliato nelle dimensioni di un vetrino di microscopia. Ha un foro di 16 mm di diametro al centro della slitta che è stato controforato a 0,85 mm. Questo foro di controforo ha un foro aggiuntivo di 6 mm di diametro con una profondità di 150 μm (Figura 3A). Un coverslip è incollato con grasso siliconico (inerte per il campione) nella parte inferiore della camera di alluminio (Figura 3B). Dopo aver posizionato i campioni nel pozzo riempito a medio, una membrana permeabile allo scambio O2/ CO2 viene posizionata sul mezzo e circondata da olio di alocarbonio (Figura 3C).
Per la dissezione, si consiglia di utilizzare pinci in acciaio inossidabile con una dimensione della punta di 0,05 x 0,02 mm e aghi di diametro 0,20 mm per la separazione degli ovarioli (Figura 4B,C). I nuclei migratori sono ripresi su un microscopio confocale invertito a disco rotante CSU-X1 dotato di una telecamera. Le immagini multi-posizione sono state acquisite mediante time-lapse ogni 15 minuti a 24 °C. Un intervallo di 15 minuti consente di eseguire acquisizioni multi-posizione con fotosbiancamento limitato delle proteine fluorescenti e fototossicità per i campioni. Inoltre, un intervallo più breve non fornirebbe dati molto più informativi per seguire le traiettorie nucleari. I filmati vengono elaborati e analizzati tramite il software Fiji11.
Protocol
Representative Results
Discussion
Altri protocolli descrivono come preparare e coltura le camere per uova di Drosophila ex vivo per il saggio di imaging dal vivo12,13. La novità di questo protocollo è l’uso di una camera di imaging costruita utilizzando un vetrino di alluminio cavo, un coverslip e una membrana permeabile A O2/ CO2. Il vantaggio principale di questa configurazione è quello di limitare il movimento in Z senza esercitare pressione sul campione. Pert…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Siamo estremamente grati a Jean-Antoine Lepesant e Nicolas Tissot che hanno originariamente sviluppato il protocollo e condiviso con noi alcuni elementi grafici della Figura 3. Ringraziamo Fanny Roland-Gosselin che ha scattato le foto della Figura 4. Ringraziamo anche gli altri membri del laboratorio per le discussioni utili che hanno contribuito al miglioramento di questa tecnica e Nathaniel Henneman per i suoi commenti che hanno contribuito a migliorare questo manoscritto. Riconosciamo la struttura principale di ImagoSeine dell’Istituto Jacques Monod, membro di France-BioImaging (ANR-10-INBS-04). Maëlys Loh è supportato da una borsa di dottorato del Ministero della Ricerca francese (MESRI). Antoine Guichet e Fred Bernard sono stati sostenuti dall’ARC (Grant PJA20181208148), dall’Association des Entreprises contre le Cancer (Grant Gefluc 2020 #221366) e da una sovvenzione Emergence dell’IdEx Université de Paris (ANR-18-IDEX-0001).
Materials
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24×50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 – 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 – 188 | Observation-chamber preparation |
References
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. 발생학. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ‘ n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).

