Summary
I Drosophilagjennomgår oocyttkjernen mikrotubulavhengig migrasjon under oogenese. Her beskriver vi en protokoll som ble utviklet for å følge migrasjonen ved å utføre levende avbildning på eggkamre ex-vivo. Vår prosedyre opprettholder eggkamre i live i 12 timer for å skaffe seg 3D-tidsforløpfilmer med flere posisjoner ved hjelp av konfektmikroskopi med spinnende disk.
Abstract
Levende celleavbildning er spesielt nødvendig for å forstå de cellulære og molekylære mekanismene som regulerer organelle bevegelser, cytoskjelett omorganiseringer eller polaritetsmønster i cellene. Når du studerer oocyttkjerneposisjonering, er live-imaging teknikker avgjørende for å fange opp de dynamiske hendelsene i denne prosessen. Drosophila eggkammer er en multicellulær struktur og et utmerket modellsystem for å studere dette fenomenet på grunn av sin store størrelse og tilgjengelighet av mange genetiske verktøy. Under Drosophila midt-oogenese migrerer kjernen fra en sentral posisjon i oocytten for å vedta en asymmetrisk posisjon formidlet av mikrotubulegenererte krefter. Denne migrasjonen og plasseringen av kjernen er nødvendig for å bestemme polaritetsøksene til embryoet og den etterfølgende voksne fly. Et kjennetegn ved denne overføringen er at den forekommer i tre dimensjoner (3D), noe som skaper en nødvendighet for levende avbildning. For å studere mekanismene som regulerer kjernefysisk migrasjon, har vi derfor utviklet en protokoll for å dyrke de dissekerte eggkamrene og utføre levende avbildning i 12 timer ved tidsforløpoppkjøp ved hjelp av spinnende disk konfokal mikroskopi. Samlet sett tillater våre forhold oss å bevare Drosophila eggkamre i live i lang tid, og dermed muliggjøre fullføring av kjernefysisk migrasjon som skal visualiseres i et stort antall prøver i 3D.
Introduction
I flere år har Drosophila-oocytten dukket opp som et modellsystem for å studere kjernefysisk migrasjon. Drosophila oocytten utvikler seg i en multicellulær struktur kalt eggkammeret. Eggkamre omfatter 16 bakterieceller (15 sykepleierceller og oocytten) omgitt av et epitellag av follikulære somatiske celler. Eggkammerutvikling har blitt delt inn i 14 stadier (Figur 1A), hvor oocytten vil vokse og akkumulere reserver som er nødvendige for den tidlige utviklingen av embryoet. Under utviklingen, ved mikrotubul omorganisering og asymmetrisk transport av mors determinanter, polariserer oocytten langs antero-dorsale og dorso-ventrale akser. Disse aksene bestemmer de påfølgende polaritetsøksene til embryoet og den voksne som oppstår ved befruktning av denne oocytten1. Under oogenese vedtar kjernen en asymmetrisk posisjon i oocytten. I trinn 6 er kjernen sentrert i cellen. Ved et ennå ikke identifisert signal som slippes ut av de bakre follikulære cellene som mottas av oocytten, migrerer kjernen mot skjæringspunktet mellom de fremre og laterale plasmamembranene i trinn 7 (Figur 1B)2,3. Denne asymmetriske posisjonen er nødvendig for å indusere bestemmelsen av dorso-ventralaksen.
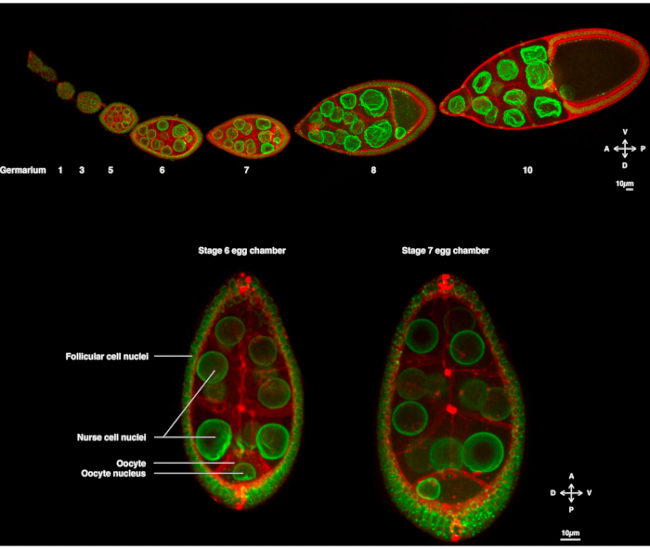
Figur 1: Drosophila melanogaster eggkamre. (A) Fast ovariol fra transgene fluer som uttrykker Fs(2)Ket-GFP som merker atomkonvoluttene og ubi-PH-RFP som merker plasmamembranene. Ovariolen består av å utvikle eggkamre på forskjellige stadier. Modningen øker langs antero-posterioraksen med germariumet på den fremre spissen (venstre) der bakteriestammecellen ligger og det eldre stadiet på bakre spiss (høyre). (B) Z-projeksjon av levende eggkammer ved å spinne disk konfektmikroskopi på trinn 6 av oogenese (venstre), der kjernen er sentrert i oocytten. Kjernen vil migrere for å vedta en asymmetrisk posisjon på trinn 7 (høyre) i kontakt med den fremre plasmamembranen (mellom oocytten og sykepleiercellen) og den laterale plasmamembranen (mellom oocytten og follikulære celler). Denne posisjonen vil indusere bestemmelsen av dorsalsiden og dermed eggkammerets dorso-ventrale akse. Klikk her for å se en større versjon av denne figuren.
I mange tiår har denne kjernefysiske migrasjonen blitt studert på fast vev ved immunstaining. Denne tilnærmingen har spesielt gjort det mulig å demonstrere at denne prosessen avhenger av et tett nettverk av mikrotubuler4,5. Mer nylig utviklet vi en protokoll som tilbyr forhold som er kompatible med live bildebehandling av oocytten i løpet av flere timer, noe som gjør det mulig å studere denne prosessen dynamisk6.
Derfor har vi for første gang kunnet beskrive at kjernen har fortrinnsrett og karakteristiske baner under sin migrasjon, en langs den fremre plasmamembranen (APM) og en annen langs den laterale plasmamembranen (LPM) i oocytten (figur 2). Disse siste resultatene understreker viktigheten av live-imaging protokoller når du studerer dynamiske prosesser som kjernefysisk migrasjon.
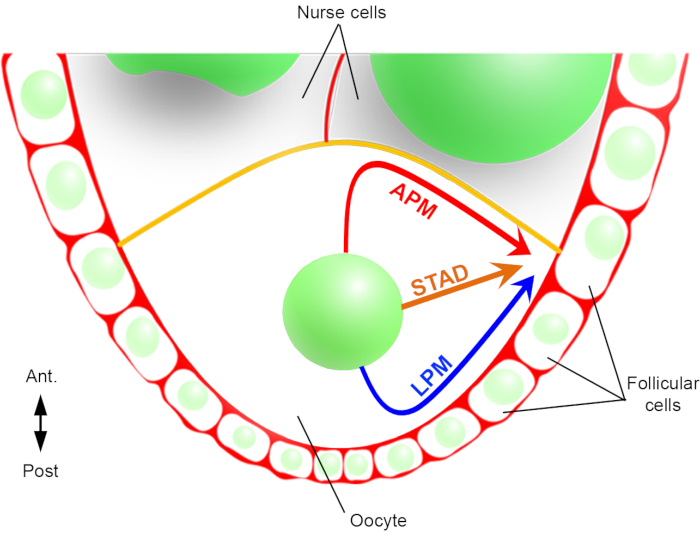
Figur 2: Skjematisk representasjon av de ulike overføringsbanene til kjernen. På trinn 6 av oogenesen er oocytten en stor celle med en sentral kjerne. På dette stadiet er antero-posterior polaritetsaksen satt med en bakre / lateral plasmamembran av oocytten i kontakt med follikulære celler og den fremre plasmamembranen (i gult) er i kontakt med sykepleiercellene2. Vi har tidligere rapportert at kjernen kan migrere enten langs den fremre plasmamembranen (APM), langs lateral plasmamembranen (LPM), eller gjennom cytoplasma (STAD, rett til antero-dorsal cortex)6. Klikk her for å se en større versjon av denne figuren.
Oocyttkjernemigrasjonen er et fenomen på ca 3 h6, og så langt er hendelsen som utløser starten på selve migrasjonen ukjent. Starten på migrasjonen kan også forsinkes av proteinmutanter som brukes til å studere denne mekanismen. Disse ukjente variablene motiverte oss til å skaffe bilder over lange tidsperioder (10-12 timer). Det er derfor viktig å sørge for at oocyttene forblir i live. Etter hvert som eggkammeret utvikler seg, forlenger det langs antero-posterioraksen fra en sfærisk til en elliptisk form. Denne forlengelsen drives av rotasjonen av follikulære celler, som oppstår fra trinn 1 til trinn 8, vinkelrett på antero-posterioraksen7. I tillegg omgir en rørformet skjede av muskel med pulsatile eiendom eggkamrene. Den fysiologiske funksjonen er å skyve de utviklende folliklene mot ovidukten kontinuerlig8. For å begrense bevegelsene som induserer svingninger i eggkamrene etter avhandlingen, designet vi et observasjonsmikrokammer som måler 150 μm i høyden (Figur 3A). Denne høyden er marginalt høyere enn størrelsen på en follikkel i trinn 10 og 11. Det begrenser betraktelig de vertikale bevegelsene til prøven samtidig som rotasjonen av eggkammeret bevares, og dermed resulterer det i begrensede feil i follikkelutviklingen. Vi utfører deretter levende avbildning i 12 timer på dissekerte eggkamre ved flerposisjonelle tidsforløpanskaffelser ved hjelp av et konfokalt mikroskop med spinnende disk. Her beskriver vi vår protokoll for å studere oocytt kjernefysisk migrasjon mellom trinn 6 og 7.
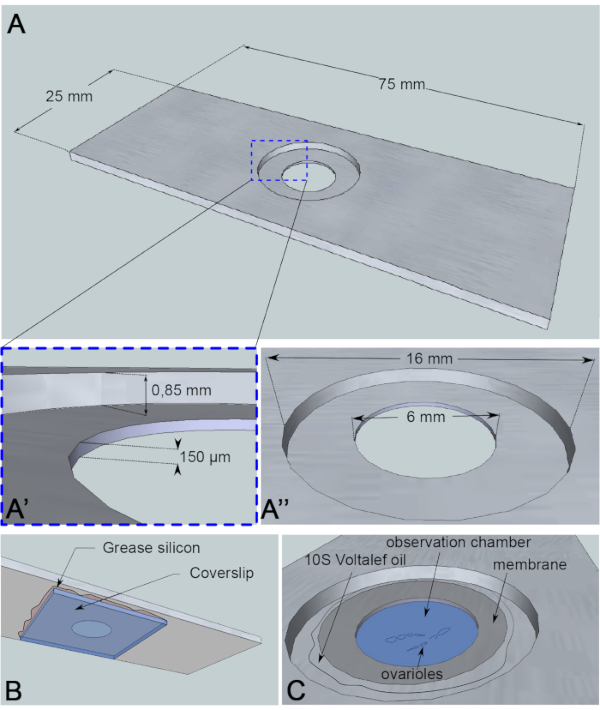
Figur 3: Skjematisk representasjon av observasjonskammeret. (A) (Sett ovenfra) Nøyaktige dimensjoner på aluminiumsskuffen med høydene (A) og omkretsene (A” av brønnen boret midt i skredet. (B) (Nederste visning) En deksler som blokkerer brønnen er forseglet til lysbildet med silisiumfett. (C) (Sett ovenfra) Dissekerte eggstokker utvikler seg i et bildemedium som er dekket av en gassgjennomtrengelig membran. Halokarbonolje brukes til å stabilisere membranen. Klikk her for å se en større versjon av denne figuren.
For å følge atommigrasjonen og nøyaktig vurdere baner i oocytten, er det nødvendig med markører for både atomkonvolutten og plasmamembranen. Med dette målet er to transgenes som har et høyt signal / støyforhold og ikke falmer i løpet av live bildebehandling valgt. For å merke plasmamembranen anbefales det å bruke en P[ubi-PH-RFP] som koder Pleckstrin Homology (PH)-domenet til Human Phospholipase C ∂1 (PLC∂1) som er smeltet til RFP. Dette PH-domenet binder seg til fosfoinositid PI(4,5)P2 fordelt langs plasmamembranen til oocytten9. For atomkonvolutten viser P[PPT-un1]Fs(2)Ket-GFP proteinfellestamme der GFP settes inn i genet som koder Drosophila ß-importin, et homogent og intenst signal10. Unge fluer (1-2 dager gamle) plasseres i friske hetteglass som inneholder tørr gjær 24-48 timer før eggstokk disseksjon.
For denne levende bildeanalysen er et 1 mm tykt stykke aluminium, som ikke er reaktivt for prøven, kuttet inn i dimensjonene til en mikroskopisklie. Den har et hull med en diameter på 16 mm i midten av lysbildet som er motboret til 0,85 mm. Denne motbanen har et ekstra hull med en diameter på 6 mm med en dybde på 150 μm (figur 3A). En deksler limes med silikonfett (inert for prøven) nederst i aluminiumskammeret (Figur 3B). Etter å ha plassert prøvene i den middels fylte brønnen, plasseres en membran som kan gjennomsyres av O2/CO2-utveksling over mediet og er omgitt av halokarbonolje (figur 3C).
For disseksjonen anbefales det å bruke rustfrie stål tang med en spissdimensjon på 0,05 x 0,02 mm og 0,20 mm diameter nåler for separasjon av eggstokkene (Figur 4B,C). De migrerende kjernene er avbildet på et konfokalt invertert mikroskop CSU-X1 med spinnende disk utstyrt med et kamera. Bilder med flere posisjoner ble anskaffet ved tidsforløp hvert 15. Et intervall på 15 minutter gjør det mulig å utføre oppkjøp med flere posisjoner med begrenset fotobleaching av fluorescerende proteiner og fototoksisitet for prøvene. Videre vil et kortere intervall ikke gi mye mer informative data for å følge kjernefysiske baner. Filmene behandles og analyseres via Fiji-programvare11.
Protocol
Representative Results
Discussion
Andre protokoller beskriver hvordan du forbereder og kultur Drosophila eggkamre ex vivo for live-imaging analyse12,13. Nyheten i denne protokollen er bruken av et bildekammer konstruert ved hjelp av en uthulet aluminiumssklie, en dekslelip og en O2/ CO2 gjennomtrengelig membran. Den største fordelen med dette oppsettet er å begrense bevegelsen i Z uten å utøve press på prøven. Dermed kan oocytten fortsatt bevege seg fritt, og …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi er svært takknemlige for Jean-Antoine Lepesant og Nicolas Tissot som opprinnelig utviklet protokollen og delte noen grafiske elementer i figur 3 med oss. Vi takker Fanny Roland-Gosselin som tok bildene av figur 4. Vi takker også andre laboratoriemedlemmer for nyttige diskusjoner som bidro til ameliorasjonen av denne teknikken og Nathaniel Henneman for hans kommentarer som bidro til å forbedre dette manuskriptet. Vi anerkjenner ImagoSeine kjerneanlegget til instituttet Jacques Monod, medlem av France-BioImaging (ANR-10-INBS-04). Maëlys Loh støttes av et stipendiat fra det franske forskningsdepartementet (MESRI). Antoine Guichet og Fred Bernard ble støttet av ARC (Grant PJA20181208148), Association des Entreprises contre le Cancer (Grant Gefluc 2020 #221366) og av et Emergence-stipend fra IdEx Université de Paris (ANR-18-IDEX-0001).
Materials
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24×50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 – 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 – 188 | Observation-chamber preparation |
References
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. 발생학. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ‘ n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).

