Fluorescensmikroskopi för ATP-internalisering medierad av makropinocytos hos mänskliga tumörceller och tumör-xenograferade möss
Summary
Vi utvecklat en reproducerbar metod för att visualisera internalisering av nonhydrolyzable fluorescerande adenosin triphosphate (ATP), en ATP surrogat, med hög cellulär upplösning. Vi validerade vår metod med oberoende in vitro och in vivo analyser-mänskliga tumör cellinjer och immunodeficient möss xenografted med mänskliga tumör vävnad.
Abstract
Adenosintrifosfat (ATP), inklusive extracellulär ATP (eATP), har visat sig spela betydande roller i olika aspekter av tumorigenesis, såsom läkemedelsresistens, epitelial-mesenchymal övergång (EMT) och metastasering. Intratumoral eATP är 103 till 104 gånger högre i koncentration än i normala vävnader. Medan eATP fungerar som en budbärare för att aktivera purinergisk signalering för EMT-induktion, internaliseras den också av cancerceller genom uppreglerad makropinocytos, en specifik typ av endocytos, för att utföra en mängd olika biologiska funktioner. Dessa funktioner inkluderar att ge energi till ATP-krävande biokemiska reaktioner, donera fosfatgrupper under signaltransduktion och underlätta eller påskynda genuttryck som en transkriptionell kofaktor. ATP är lättillgängligt, och dess studie inom cancer och andra områden kommer utan tvekan att öka. EATP-studien är dock fortfarande i ett tidigt skede, och olösta frågor förblir obesvarade innan de viktiga och mångsidiga aktiviteterna som spelas av eATP och internaliserade intracellulära ATP kan rivas upp helt.
Dessa författares laboratorier bidrag till dessa tidiga eATP studier inkluderar mikroskopisk avbildning av icke-hydrolyserbara fluorescerande ATP, tillsammans med hög- och låg-molekylvikt fluorescerande dextrans, som fungerar som makropinocytosis och endocytosis tracers, liksom olika endocytosis inhibitorer, för att övervaka och karakterisera eATP internaliseringsprocessen. Denna bildframställning modalitet tillämpades på tumör cellinjer och immunbrist möss, xenografted med mänskliga cancer tumörer, att studera eATP internalisering in vitro och in vivo. Detta dokument beskriver dessa in vitro och in vivo protokoll, med tonvikt på att ändra och finjustera analys villkor så att macropinocytosis-/endocytosis-medierade eATP internalisering analyser kan utföras framgångsrikt i olika system.
Introduction
Det opportunistiska upptaget av intratumorala extracellulära (dvs) näringsämnen har nyligen utsetts till ett viktigt kännetecken för cancermetabolism1. En av dessa viktiga näringsämnen är ATP, eftersom koncentrationen av ieATP är 103 och 104 gånger högre än den som finns i normala vävnader, i intervallet flera hundra μM till låg mM2,3,4,5. Som en viktig energi- och signalmolekyl spelar ATP en central roll i cellulär metabolism i cancerceller och friska celler6,7,8. Extracellulär ATP är inte bara involverad i cancercelltillväxt, men det främjar också läkemedelsresistens9. Tidigare okända funktioner av ATP, såsom hydrotrop aktivitet, har nyligen identifierats, vilket innebär ATP-engagemang i sjukdomar som Alzheimers10. Det verkar faktiskt som om vår förståelse av ATP och dess funktioner i cancerceller, friska celler och andra sjuka celler är långt ifrån fullständig. Men på grund av ATP: s instabilitet och höga omsättningshastigheter i celler är det tekniskt utmanande att övervaka ATP: s rörelse över cellmembranet och in i cellen.
För att ta itu med detta problem och fylla behovet av detta forskningsområde utvecklades en metod där icke-lättsinnig fluorescerande ATP (NHF-ATP) (figur 1) användes som surrogat för att visualisera internaliseringen av ATP och observera intracellulär rumslig lokalisering av internaliserad ATP, både in vitro och in vivo11,12 . NHF-ATP har visat sig ersätta endogen ATP för att undersöka ATP-rörelse över djurcellsmembran, både i cancercelllinjer och i human tumörvävnad xenografted på immunbrist möss11,12. Dessutom, administrera makropinocytoshämmare till celler blockerade eATP internalisering, vilket tyder på att intracellulärt upptag av eATP innebär en makropinocytotisk mekanism9,11,12. Detta protokoll tillåter immunobaserad colabeling mot cellspecifika proteiner och därmed identifiering av vilken celltyp internaliserar NHF-ATP. Med hjälp av in vivo tumör xenografts och högupplöst mikroskopi, NHF-ATP kan visualiseras rumsligt över vävnadsprovet och även inom en enda cell. Dessa metoder tillåter också kvantitativ analys, såsom andelen cellulära upptag, antal makropinocytotic vesiklar och internalisering kinetik. Detta dokument beskriver i detalj hur NHF-ATP, arbetar ensam eller tillsammans med endocytosis-tracer fluorescerande dextrans13,14,15,16, kan användas i olika experimentella inställningar för att studera ATP: s internalisering och intracellulär lokalisering, efter internalisering i celler.
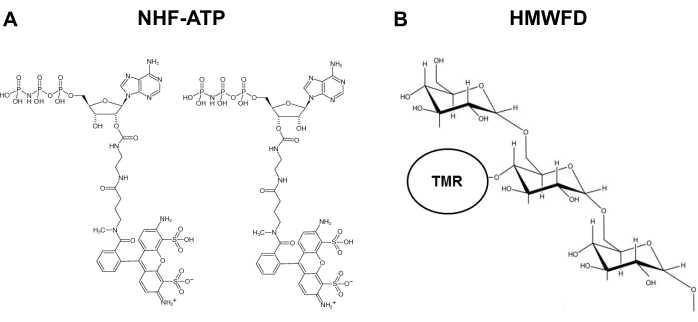
Figur 1: Strukturer av icke-lättsanerlig fluorescerande ATP och tetrametylrhodamin märkt hög molekylvikt fluorescerande dextran. (A) Struktur hos NHF-ATP. b)Schematisk representation av HMWFD. Förkortningar: ATP = adenosintrifosfat; NHF-ATP = icke-lättslös fluorescerande ATP; TMR = tetrametylrhodamin; HMWFD = fluorescerande dextran med hög molekylvikt. Klicka här för att se en större version av den här figuren.
Protocol
Representative Results
Discussion
En metod utvecklades för rumsliga, tidsmässiga och kvantitativa analys av cellulär internalisering av nonhydrolyzable ATP. Denna metod är i stort sett tillämplig för användning i olika biologiska system, inklusive olika tumörogena modeller, för vilka vi tillhandahåller teknisk instruktion och representativa data. För att erhålla tolkningsbara data under in vivo ATP internaliseringsstudier (avsnitt 4 i protokollet), är det viktigt att begränsa den experimentella tid som förflutit från intratumoral…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cryosectioning utfördes på plats vid Ohio University Histopathology Core. Detta arbete stöddes delvis av start-up fonder (Ohio University College of Arts & Sciences) till C Nielsen; NIH-anslag R15 CA242177-01 och RSAC-utmärkelse till X Chen.
Materials
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker – orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical – sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
References
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008 (2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101 (2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154 (2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).

