تشريح والكيمياء المناعية من الساق الكبار Drosophila للكشف عن التغيرات في تقاطع العصبية والعضلية لخلية عصبية محركية محددة
Summary
نحن نصف تقنية تشريح تحافظ على بنية التقاطع العصبي العضلي وتمكن من دراسة كيميائية مناعية مفصلة للخلايا العصبية الحركية في ساق دروسوفيلا البالغة.
Abstract
Drosophila melanogaster يمثل نموذجا وراثيا لدراسة بنية الخلايا العصبية ووظيفتها، والتغيرات اللاحقة في حالات المرض. غالبا ما يستخدم التقاطع العصبي العضلي اليرقاتي المميز جيدا لمثل هذه الدراسات. ومع ذلك ، فإن التطور السريع لليرقات يليه انحلال العضلات وإعادة عرض الجهاز العصبي أثناء التحول يجعل هذا النموذج إشكاليا لدراسة التغيرات التنكسية البطيئة المعتمدة على العمر مثل تلك التي تحدث في التصلب الجانبي الضموري. بدلا من ذلك، يعيش الذباب البالغ لمدة 90 يوما ويمكن استخدام ساق البالغين لدراسة تغيرات الخلايا العصبية الحركية على مدار عمر البالغين باستخدام التصوير الفلوري في الجسم الحي من خلال السفاح. هنا، ونحن نصف تقنية تشريح الساق إلى جانب الكيمياء المناعية، والذي يسمح لدراسة التغيرات الجزيئية في تقاطع العصبية والعضلية من الخلايا العصبية الحركية الساق الكبار المحددة. ويمكن أن يقترن هذه التقنيات مع عدد لا يحصى من الأجسام المضادة وضع العلامات على حد سواء قبل وبعد الهياكل متشابك. معا هذه الإجراءات تسمح وصفا أكثر اكتمالا للتغيرات البطيئة التي تعتمد على العمر في الذباب الكبار ويمكن تطبيقها عبر نماذج مرض الخلايا العصبية الحركية متعددة.
Introduction
تشمل أمراض الخلايا العصبية الحركية (MN) مجموعة من الحالات غير المتجانسة التي تشمل الانحطاط التدريجي مما يؤدي إلى إهدار العضلات والشلل كنمط الظاهري السريري الأساسي1. وعلى الرغم من ندرة الانتشار العالمي بنسبة 4.5 لكل 000 100، فمن المتوقع أن يزداد هذا الانتشار مع شيخوخة السكان(2). التصلب الجانبي الضموري (ALS) هو مرض MN الأكثر شيوعا (MND) وعادة ما يكون قاتلا في غضون فترة قصيرة من التشخيص مع عدم وجود علاجات تعديل المرض المتاحة3. تشترك MNDs في مرحلة مشتركة طويلة قبل أعراض مع تغييرات العلامات الحيوية الجزيئية المبكرة وتغييرات التصوير الوظيفي التي شوهدت في المرضى4. كما لوحظ الأمراض الخلوية في وقت مبكر قبل أعراض في نماذج الأمراض غير البشرية5،6،7،8. دراسة التغيرات المبكرة عند التقاطع العصبي العضلي مهم لفهم مسببات الأمراض مرض MN ويمكن أن تساعد في تطوير التشخيص المبكر والعلاجات المحتملة.
توجد ثروة من الأدوات الوراثية والجزيئية في Drosophila لتشريح بنية ووظيفة التقاطع العصبي العضلي (NMJ ، see9 لمراجعة NMJ اليرقات ذات السمات الجيدة). هذه الأدوات جنبا إلى جنب مع عمر قصير جعل Drosophila نموذجا ممتازا لدراسة التغيرات العصبية في NMJ. على وجه التحديد، MNs الداخلية عضلات الكبار موجودة طوال عمر البالغين ~ 90 يوما وتخضع لعمليات الشيخوخة العادية10،11،12،13. ولذلك توفر MNs الكبار فرصة لدراسة التغيرات التنكسية البطيئة على النقيض من NMJs اليرقات التي توجد لفترة قصيرة ~ 1 أسبوع فقط قبل التحول14،15.
هنا، نقوم بوصف إجراء تشريح يسمح لنا بإجراء تحليل كيميائي مناعي لل MNs في ساق البالغين. يتم تنشيط كل ساق بالغة من قبل ~ 50 MNs ، والتي متشابكة على الساق المرتبطة العضلات لدفع الحركة. وقد وصفت جيدا تشريح الساق، وعلم وظائف الأعضاء الميكانيكية، وعلم الأعصاب16،17،18. وقد سبق أن تميزت أربورات أكسون من MNs الساق عن طريق التصوير من خلال كتيكل في مجموعات الخلايا مملوءة بالظهر أو المسمى وراثيا باستخدام نظام Gal4/UAS ثنائي الأطراف وقد نشرت أساليب التصوير سابقا19. تحافظ طرق التشريح المعروضة هنا على مورفولوجيا متفرعة المحور العصبي وتسمح لنا باستغلال مجموعة متنوعة من الأجسام المضادة لتسمية المكونات الجزيئية المختلفة ل NMJ. وقد ركز عملنا السابق على إسقاطات MN محددة في الساق metathoracic (3) ، الذي innervates عضلة الساق ليفاتور (tilm) ويظهر أنماط التشجير متسقة وأرقام بوتون. في البداية درسنا التغيرات المعتمدة على العمر في Drosophila superoxide dismutase 1 (dsod1) المسوخ ووجدت تعديلات تتفق مع تفكيك NMJ20. توفر طرق التشريح هذه الفرصة لتوصيف أفضل للتغيرات التنكسية البطيئة في NMJ لنماذج ALS الأخرى والدراسات الأساسية للشيخوخة وغيرها من الأمراض المرتبطة بال MN.
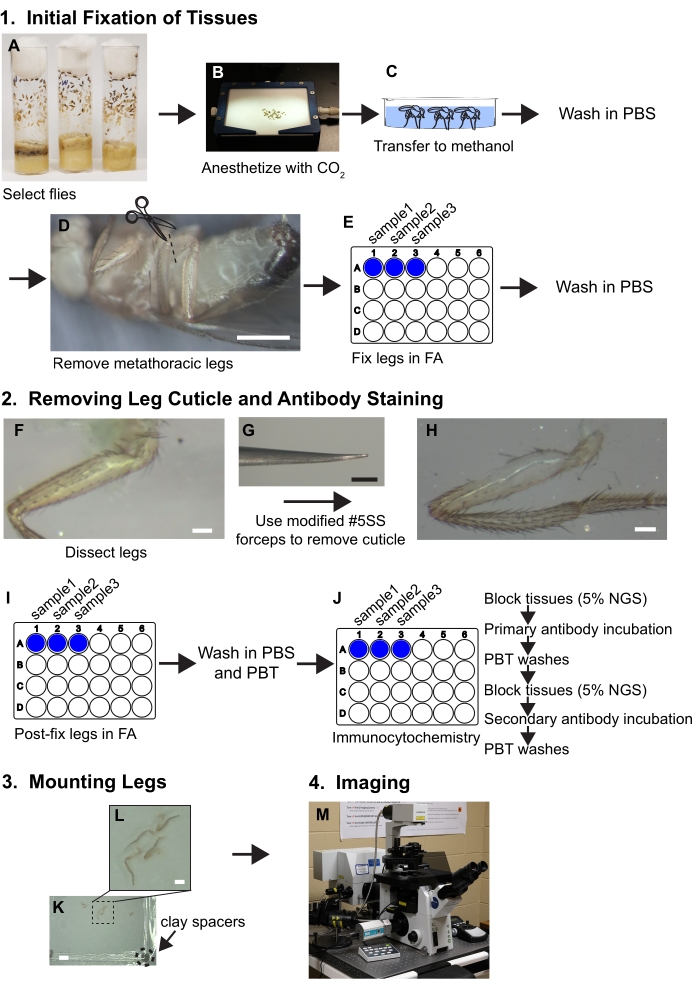
الشكل 1 – الأرقام 1– الأرقام 1 ملخص سير العمل لتشريح الساقين. راجع البروتوكول للحصول على خطوات تفصيلية. (أ، ب) يتم اختيار الذباب وتخديره. (ج) يتم نقل الذباب إلى الميثانول وغسلها مع برنامج تلفزيوني. (د) تتم إزالة الساقين metathoracic في قاعدة كوكسا في حين تصور مع المجهر تشريح (~ 30x التكبير)؛ شريط المقياس = 500 ميكرومتر. (ه) ثم يتم إصلاح الساقين في حل 3.7٪ الفورمالديهايد / PBS (FA) لمدة 30 دقيقة داخل آبار من لوحات 24 بئرا ومن ثم تتم إزالة الاتحاد الإنجليزي عن طريق يغسل مع برنامج تلفزيوني. (واو، ز، ح) يتم نقل الساقين إلى صواني تشريح الاستومر السيليكون ويتم إزالة قطعة من الجلد من عظم الفخذ القريب باستخدام ملقط مشطوف في حين تصور تحت المجهر تشريح في 80x; شريط المقياس = 50 ميكرومتر. (I) الساقين هي مرحلة ما بعد تشريح ثابتة في الاتحاد الانجليزي وغسلها في برنامج تلفزيوني ثم PBT (PBS + 0.1٪ غير الأيونية السطحي). (J) الساقين تتعرض لتلطيخ الكيميائية المناعية. (ك، ل) يتم نقل الساقين إلى شريحة زجاجية، مسح في وسائل الإعلام المتصاعدة، وتغطي مع غطاء يحتوي على الفواصل الطينية. أشرطة المقياس = 2 مم و 500 ميكرومتر. (M) يتم تصوير الساقين عن طريق المجهر confocal. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
الساق البالغة Drosophila هو نموذج مثالي لدراسة التنكس العصبي نظرا البساطة النسبية مع MNs تتميز بشكل جيد تعيينها من الأنساب neuroblast وأنماط التشجير النمطية. وقد استخدمت عدة تقارير سابقا MNs الساق لدراسة الأمراض العصبية21,22. استخدمت هذه الدراسات خطوط التعبير عن GFP جنبا إلى جنب مع تحليل الفسيفساء مع علامة الخلية القابلة للقمع (MARCM) للصورة من خلال السفاح ووثقت سلسلة من التغييرات المورفولوجية. تصوير NMJs الكبار عن طريق الكيمياء المناعية مع كتل استئصال تمكن من مزيد من التوصيف مع القدرة على تتبع التغيرات الجزيئية المعقدة باستخدام صندوق أدوات من الأجسام المضادة المتاحة.
جزء الكيمياء المناعية من هذا البروتوكول هو معيار نسبيا ويمكن تنفيذها مستقلة عن النمط الجيني (انظر23 للحصول على وصف ممتاز لأساليب تلطيخ الأجسام المضادة العامة للاستخدام مع Drosophila). وعلاوة على ذلك، يمكن تحديد معلمات مثل كثافة الفلورسينس، وطول فرع المحور، وأرقام وحجم بوتون باستخدام مجموعة متنوعة من وحدات الماكرو المتاحة ImageJ بمجرد التقاط الصور ونشر أساليب مفصلة للتحليل الكمي (على سبيل المثال، انظر 24،25،26). وبالتالي ، فإن تقنية التشريح هي الابتكار الرئيسي الموصوف هنا. قبل تشريح، يتم غمر الذباب في الكحول لتجريد الهيدروكربونات مقطعي. ويستخدم الإيثانول والميثانول عادة لهذا الغرض؛ ومع ذلك، استخدمنا الميثانول فقط. حاسمة لنجاح تشريح عدة عوامل: أولا، باستخدام ملقط المعدلة مع شطبة يسمح للاتصال سطحية جدا مع كتل. ثانيا، باستخدام مجهر تشريح قادر على التكبير الكلي 60-100x بحيث يكون سطح السفاح مرئيا بوضوح. بالنسبة للمجاهر ذات الحد الأقصى الأدنى من التكبير ، تتوفر أهداف 2x لمعظم العلامات التجارية الشائعة ويجب أن تكون كافية عند دمجها مع العدسات الموجودة. ثالثا، خطوة التثبيت الأولي يجعل الجلد هشة وأسهل لسحب بعيدا دون الإضرار العضلات تحت. الإفراط في التثبيت في هذه الخطوة يجعل الساق بأكملها قاسية جدا لتشريح فعال. لذلك، يجب أن يقتصر التثبيت الأولي إلى 30 دقيقة. فإن مثبت الفورمالديهايد لا تخترق ما يكفي لتقاطع الأنسجة الكامنة بشكل فعال خلال هذه الفترة القصيرة، وبالتالي خطوة التثبيت الثاني ضروري. قبل التثبيت الثاني ، يجب الاحتفاظ بالأنسجة على الجليد لمنع التدهور والتغيرات في مورفولوجيا. رابعا، وجدنا تشريح العينات في حين أن البرد مهم أيضا، من المرجح لأسباب مماثلة في أن الجلد هش ويمكن إزالة قطعة صغيرة بسهولة أكبر.
مع الممارسة، نجد ~ 50٪ من تشريح ستكون قابلة للاستخدام في أي ضرر الأنسجة ملحوظ. على الرغم من أن هذه النسبة المئوية قد تبدو منخفضة بالنسبة لبعض الأنسجة الأخرى ، فإن إجراء التشريح سريع ، ويمكن معالجة العديد من الساقين في 30-60 دقيقة. لذلك، حتى لو كانت معدلات النجاح منخفضة في البداية، فمن الممكن الحصول على عينات جيدة 4-5 لكل مجموعة تجريبية. ومع ذلك، قد يكون الحد من عدد الذباب المتاحة في أي وقت من الأوقات إذا كانت الأنماط الجينية و / أو العمر يؤدي إلى فتك كبير.
وهناك قيد آخر هو أننا لم نتمكن من تشريح مناطق أخرى من الساق خارج المنطقة القريبة من عظم الفخذ بسبب الحجم. وهكذا، يمكننا دراسة تحديد MN arbors innervating TILM موثوق بها، وأنه من الممكن تشريح لطيف فوق عضلة الاكتئاب الساق مع تغييرات صغيرة على الطريقة التي يتم توجيه الساق عند تشريح. ومع ذلك ، فقد ثبت أن الوصول إلى مناطق أخرى من الساق أكثر صعوبة دون تعطيل العمارة المحورية أثناء التشريح.
هنا، نقدم طرق تشريح للكشف عن التغيرات في NMJ الكبار لMNs محددة الداخلية tilm باستخدام الكيمياء المناعية. الساق مفيدة كنظام بسيط، ت الداخلي من قبل ~ 50 MNs فقط وتحتوي على 14 العضلات مع التشريح وصفت جيدا. يمكن استخدام إعداد الساق تشريح عبر الأنماط الجينية ومجموعة من الأجسام المضادة متاحة لتصور NMJ دون الحاجة إلى بناء مخزونات معقدة جينيا من بنيات الجينات مراسل في خلفيات متحولة. وسيمكن هذا النهج من تحديد وصف أكثر تفصيلا للتغيرات في ال NMJ لأمراض MN وغيرها من الحالات المرتبطة بالعمر.
Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر إريك روبرتس على المشورة بشأن التصوير. ونود أيضا أن نشكر خدمات تكنولوجيا المعلومات في كلية رود آيلاند، ولا سيما مايكل كين وجيك دوغلاس على تصوير الفيديو. تم تطوير الأجسام المضادة أحادية النسيلة المضادة للdlg ومكافحة brp من قبل جامعة كاليفورنيا في بيركلي وجامعة فيرزبورغ، وتم الحصول عليها من بنك Hybridoma الدراسات التنموية، التي أنشأتها NICHD من المعاهد القومية للصحة والحفاظ عليها في جامعة أيوا، قسم البيولوجيا، مدينة أيوا، IA 52242، الولايات المتحدة الأمريكية. تم دعم البحث المبلغ عنه هنا بشكل كامل من قبل شبكة جائزة رود آيلاند للتنمية المؤسسية (IDeA) للتميز في البحوث الطبية الحيوية من المعهد الوطني للعلوم الطبية العامة للمعاهد الوطنية للصحة تحت رقم المنحة [P20GM103430].
Materials
| 10x Phosphate Buffered Saline | Fisher Scientific | BP3991 | |
| 24 well plates | Corning | 3473 | Hydrophobic, ultra-low attachment surface |
| 2x objective accessory | Olympus | 110AL2X | Screw-on attachment |
| Anti-ATP5A primary antibody | Abcam | ab14748 | Mouse monoclonal |
| Anti-bruchpilot primary antibody | Developmental Studies Hybridoma Bank | nc82 | Mouse monoclonal |
| Anti-discs large primary antibody | Developmental Studies Hybridoma Bank | 4F3 | Mouse monoclonal |
| Anti-hrp primary antibody | Jackson Immuno Research | 123-605-021 | Alexa Fluor 647 conjugated polyclonal |
| Anti-polyubiquitin (FK2) primary antibody | Millipore Sigma | 04-263 | Mouse monoclonal |
| Confocal Microscope | Olympus | FV1000 | Objectives (NA): 10x (0.4), 20x (0.85), 40x (1.20), 60x (1.42), 100x (1.40) |
| Coverslips | Corning | 285022 | 160-190 mm thickness |
| Dissecting forceps | Fine Science Tools | 11252-00 | Dumont #5SF |
| Dissecting Microscope | Olympus | SZ61 | |
| Formaldehyde | Fisher Scientific | BP531-500 | 37% stock stabilized with methanol |
| Goat anti-mouse secondary antibody | Jackson Immuno Research | 115-545-146 | Alexa Fluor 488 conjugated |
| Goat Serum | Novus Biologicals | NB036768 | 0.2 mm filtered |
| Laboratory sealing tape | Fisher Scientific | 03-448-254 | Parafilm M |
| Methanol | Fisher Scientific | A413 | |
| Microscope Slides | Fisher Scientific | 12-550-123 | 76mm x 25mm |
| Mounting media | Molecular Probes | S36972 | Slowfade Diamond mounting media |
| Nonionic surfactant | Acros Organics | 215680010 | Triton-X 100 |
| Nutator | Fisher Scientific | S06622 | |
| Phalloidin | Invitrogen | A34055 | Alexa Fluor 555- conjugated |
| Sharpening stone | Fine Science Tools | 29008-01 | |
| Silicone elastomer | Electron Microscopy Sciences | 2423610 | Sylgard 184 |
References
- McDermott, C. J., Shaw, P. J. Diagnosis and management of motor neurone disease. BMJ. 336 (7645), 658-662 (2008).
- Global Collaborators, G. B. D. M. N. D. Global, regional, and national burden of motor neuron diseases 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (12), 1083-1097 (2018).
- Foster, L. A., Salajegheh, M. K. Motor Neuron Disease: Pathophysiology, Diagnosis, and Management. American Journal of Medicine. 132 (1), 32-37 (2019).
- Bede, P., Pradat, P. F. Editorial: Biomarkers and Clinical Indicators in Motor Neuron Disease. Frontiers in Neurology. 10, 1318 (2019).
- Clark, J. A., Southam, K. A., Blizzard, C. A., King, A. E., Dickson, T. C. Axonal degeneration, distal collateral branching and neuromuscular junction architecture alterations occur prior to symptom onset in the SOD1(G93A) mouse model of amyotrophic lateral sclerosis. Journal of Chemical Neuroanatomy. 76, 35-47 (2016).
- Martineau, E., Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. Elife. 7, (2018).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Tremblay, E., Martineau, E., Robitaille, R. Opposite Synaptic Alterations at the Neuromuscular Junction in an ALS Mouse Model: When Motor Units Matter. Journal of Neuroscience. 37 (37), 8901-8918 (2017).
- Harris, K. P., Littleton, J. T. Transmission, Development, and Plasticity of Synapses. 유전학. 201 (2), 345-375 (2015).
- Beramendi, A., Peron, S., Casanova, G., Reggiani, C., Cantera, R. Neuromuscular junction in abdominal muscles of Drosophila melanogaster during adulthood and aging. Journal of Comparative Neurology. 501 (4), 498-508 (2007).
- Banerjee, S., et al. Miniature neurotransmission is required to maintain Drosophila synaptic structures during ageing. Nature Communications. 12 (1), 4399 (2021).
- Liao, S., Broughton, S., Nassel, D. R. Behavioral Senescence and Aging-Related Changes in Motor Neurons and Brain Neuromodulator Levels Are Ameliorated by Lifespan-Extending Reproductive Dormancy in Drosophila. Frontiers in Cellular Neuroscience. 11, 111 (2017).
- Mahoney, R. E., Rawson, J. M., Eaton, B. A. An age-dependent change in the set point of synaptic homeostasis. Journal of Neuroscience. 34 (6), 2111-2119 (2014).
- Fernandes, J. J., Keshishian, H. Development of the adult neuromuscular system. International Review of Neurobiology. 43, 221-239 (1999).
- Truman, J. W. Metamorphosis of the central nervous system of Drosophila. Journal of Neurobiology. 21 (7), 1072-1084 (1990).
- Baek, M., Mann, R. S. Lineage and birth date specify motor neuron targeting and dendritic architecture in adult Drosophila. Journal of Neuroscience. 29 (21), 6904-6916 (2009).
- Enriquez, J., et al. Specification of individual adult motor neuron morphologies by combinatorial transcription factor codes. Neuron. 86 (4), 955-970 (2015).
- Soler, C., Daczewska, M., Da Ponte, J. P., Dastugue, B., Jagla, K. Coordinated development of muscles and tendons of the Drosophila leg. Development. 131 (24), 6041-6051 (2004).
- Guan, W., Venkatasubramanian, L., Baek, M., Mann, R. S., Enriquez, J. Visualize Drosophila Leg Motor Neuron Axons Through the Adult Cuticle. Journal of Visualized Experiments. (140), e58365 (2018).
- Agudelo, A., et al. Age-dependent degeneration of an identified adult leg motor neuron in a Drosophila SOD1 model of ALS. Biology Open. 9 (10), (2020).
- Fernius, J., Starkenberg, A., Thor, S. Bar-coding neurodegeneration: identifying subcellular effects of human neurodegenerative disease proteins using Drosophila leg neurons. Disease Models & Mechanisms. 10 (8), 1027-1038 (2017).
- Sreedharan, J., Neukomm, L. J., Brown, R. H., Freeman, M. R. Age-Dependent TDP-43-Mediated Motor Neuron Degeneration Requires GSK3, hat-trick, and xmas-2. Current Biology. 25 (16), 2130-2136 (2015).
- Patel, N. H. Imaging neuronal subsets and other cell types in whole-mount Drosophila embryos and larvae using antibody probes. Methods in Cell Biology. 44, 445-487 (1994).
- Guirado, R., Carceller, H., Castillo-Gomez, E., Castren, E., Nacher, J. Automated analysis of images for molecular quantification in immunohistochemistry. Heliyon. 4 (6), 00669 (2018).
- Castells-Nobau, A., et al. Two Algorithms for High-throughput and Multi-parametric Quantification of Drosophila Neuromuscular Junction Morphology. Journal of Visualized Experiments. (123), e55395 (2017).
- Brown, J. R., Phongthachit, C., Sulkowski, M. J. Immunofluorescence and image analysis pipeline for Drosophila motor neurons. Biology Methods and Protocols. 4 (1), (2019).

