Dissecção e Imunohistoquímica da Perna Adulta Drosophila para detectar alterações na junção neuromuscular para um neurônio motor identificado
Summary
Descrevemos uma técnica de dissecção que preserva a arquitetura da junção neuromuscular e permite um estudo imunocitoquímico detalhado dos neurônios motores na perna de Drosophila adulta.
Abstract
Drosophila melanogaster representa um modelo geneticamente tratável para estudar a estrutura e a função neuronal, e alterações subsequentes nos estados da doença. A junção neuromuscular larval bem caracterizada é frequentemente utilizada para tais estudos. No entanto, o rápido desenvolvimento larval seguido de histrólise muscular e remodelação do sistema nervoso durante a metamorfose torna este modelo problemático para o estudo de mudanças degenerativas dependentes da idade lenta, como as que ocorrem na esclerose lateral amiotrófica. Alternativamente, moscas adultas vivem por 90 dias e a perna adulta pode ser usada para estudar mudanças de neurônios motores ao longo da vida adulta usando imagens fluorescentes in vivo através da cutícula. Aqui, descrevemos uma técnica de dissecção de pernas aliada à imunocitoquímica, que permite o estudo de alterações moleculares na junção neuromuscular de neurônios motores de perna adulta identificados. Essas técnicas podem ser acopladas a uma miríade de anticorpos que rotulam estruturas pré e pós-sinápticas. Juntos, esses procedimentos permitem uma caracterização mais completa das mudanças lentas dependentes da idade em moscas adultas e podem ser aplicados em vários modelos de doença do neurônio motor.
Introduction
As doenças do neurônio motor (MN) abrangem um grupo de condições heterogrógenas que incluem degeneração progressiva levando ao perda muscular e paralisia como fenótipo clínico primário1. Embora raro com uma prevalência global de 4,5 por 100.000, espera-se que essa prevalência aumente com um envelhecimento populacional2. A esclerose lateral amiotrófica (ELA) é a doença de MN mais comum (MND) e é tipicamente fatal em um curto espaço de tempo de diagnóstico sem tratamentos modificados por doenças existentes 3. Os MNDs compartilham em comum uma fase pré-sinttomática prolongada com alterações de biomarcadores moleculares precoces e alterações de imagem funcionais vistas em pacientes4. A patologia celular pré-síntomática precoce também é observada em modelos de doenças não humanas5,6,7,8. O estudo de alterações precoces na junção neuromuscular é importante para a compreensão da patogênese da doença de MN e pode auxiliar no desenvolvimento de diagnósticos precoces e terapêuticas potenciais.
Existe uma riqueza de ferramentas genéticas e moleculares em Drosophila para dissecar a estrutura e a função da junção neuromuscular (NMJ, ver9 para uma revisão da larva bem caracterizada NMJ). Essas ferramentas combinadas com uma vida útil curta fazem do Drosophila um excelente modelo para estudar mudanças neurodegenerativas no NMJ. Especificamente, os músculos adultos que inervam inervando estão presentes ao longo da vida adulta de ~90 dias e estão sujeitos a processos normais de envelhecimento10,11,12,13. Os MNs adultos, portanto, oferecem uma oportunidade de estudar mudanças degenerativas lentas em contraste com os NMJs larvais que existem por apenas um curto período de tempo de ~1 semana antes da metamorfose14,15.
Aqui, descrevemos um procedimento de dissecção que nos permite realizar análises imunocitômicas de MNs na perna adulta. Cada perna adulta é inervatada por ~50 MNs, que sinapse na perna associada muscular para conduzir a locomoção. A anatomia da perna, a fisiologia mecânica e a neurobiologia foram bem descritas16,17,18. As arbors axon de MNs de perna foram anteriormente caracterizadas por imagens através de cutículas em populações de células com antecedentes ou geneticamente rotuladas usando o sistema bipartite Gal4/UAS e métodos de imagem foram publicados anteriormente19. Os métodos de dissecção aqui apresentados preservam a morfologia ramificada do axônio e nos permitem explorar uma gama diversificada de anticorpos para rotular diferentes componentes moleculares do NMJ. Nosso trabalho anterior se concentrou em projeções de um MN definido na perna metatorácica (3ª), que inerva o músculo levator da tíbia (tilm) e mostra padrões consistentes de arborização e números de bouton. Inicialmente estudamos alterações dependentes da idade em drosophila superoxida desmutase 1 (dsod1) mutantes e encontramos alterações consistentes com o desmantelamento do NMJ20. Esses métodos de dissecção oferecem a oportunidade de caracterizar melhor mudanças degenerativas lentas no NMJ para outros modelos de ELA, estudos básicos de envelhecimento e outras doenças associadas à MN.
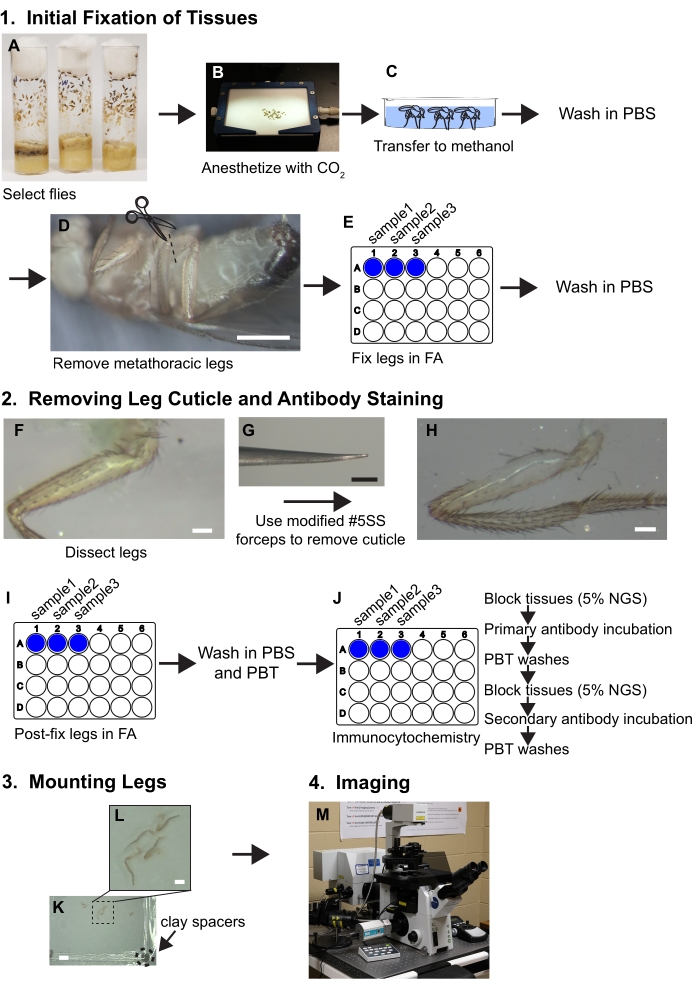
Figura 1. Resumo do fluxo de trabalho para dissecar as pernas. Consulte o protocolo para obter etapas detalhadas. (A,B) Moscas são selecionadas e anestesiadas. (C) As moscas são transferidas para o metanol e lavadas com PBS. (D) As pernas metaturácicas são removidas na base da coxa enquanto visualizadas com um microscópio dissecador (ampliação~30x); barra de escala = 500 μm. (E) As pernas são então fixadas em solução de formaldeído/PBS (FA) de 3,7% por 30 minutos dentro de poços de placas de 24 poços e, em seguida, a FA é removida por lavagens com PBS. (F, G, H) As pernas são transferidas para bandejas de dissecação de destomerso de silicone e um pedaço de cutícula é removido do fêmur proximal usando fórceps chanfrados enquanto visualizado sob um microscópio dissecando em 80x; barra de escala = 50 μm. (I) As pernas são pós-dissecção fixadas em FA e lavadas em PBS e, em seguida, PBT (PBS+ 0,1% surfactante não iônico). (J) As pernas são submetidas a coloração imunocitômica. (K,L) As pernas são transferidas para um escorregador de vidro, limpas em meios de montagem, e cobertas com um deslizamento contendo espaçadores de argila; barras de escala = 2 mm e 500 μm. (M) As pernas são imagens por microscopia confocal. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A perna adulta Drosophila é um modelo ideal para estudar a neurodegeneração dada a relativa simplicidade com MNs bem caracterizados mapeados de linhagens neuroblastos e padrões de arborização estereotipados. Vários relatos já utilizaram MNs de perna para o estudo da doença neurodegenerativa21,22. Estes estudos utilizaram linhas de expressão de GFP combinadas com a análise de mosaico com um marcador celular repressível (MARCM) para a imagem através da cutícula e documentaram uma série de alterações morfológicas. Imagens de NMJs adultos por imunocitoquímica com cutícula ressecada permitem uma caracterização adicional com a capacidade de rastrear mudanças moleculares complexas usando uma caixa de ferramentas de anticorpos disponíveis.
A porção imunocitoquímica deste protocolo é relativamente padrão e pode ser implementada independente do genótipo (ver23 para uma excelente descrição dos métodos gerais de coloração de anticorpos para uso com Drosophila). Além disso, parâmetros como intensidade de fluorescência, comprimento do ramo de axônio e números e tamanho bouton podem ser determinados usando uma variedade de macros ImageJ disponíveis uma vez que as imagens são capturadas e métodos detalhados para análise quantitativa foram publicados (por exemplo, ver24,25,26). Assim, a técnica de dissecção é a principal inovação descrita aqui. Antes da dissecção, as moscas são submersas em um álcool para remover hidrocarbonetos cuticulares. Tanto o etanol quanto o metanol são comumente utilizados para este fim; no entanto, só usamos metanol. Crítico para dissecção o sucesso são vários fatores: Primeiro, o uso de fórceps modificados com um chanfrado permite um contato muito superficial com a cutícula. Segundo, usando um microscópio dissecando capaz de ampliação total de 60-100x para que a superfície da cutícula seja claramente visível. Para microscópios com menor ampliação máxima, os objetivos 2x estão disponíveis para as marcas mais comuns e devem ser suficientes quando combinados com as lentes existentes. Em terceiro lugar, a etapa inicial de fixação torna a cutícula frágil e mais fácil de se afastar sem danificar o músculo por baixo. A super fixação nesta etapa torna toda a perna muito rígida para dissecção eficaz. Portanto, a fixação inicial deve ser limitada a 30 minutos. O fixador de formaldeído não penetrará o suficiente para interligar efetivamente o tecido subjacente durante este curto período e, portanto, é necessário um segundo passo de fixação. Antes da segunda fixação, os tecidos devem ser mantidos no gelo para evitar a degradação e mudanças na morfologia. Em quarto lugar, encontramos amostras dissecando enquanto o frio também é importante, provavelmente por razões semelhantes em que a cutícula é frágil e uma pequena peça pode ser mais facilmente removida.
Com a prática, descobrimos que ~50% das dissecções serão utilizáveis dentro de nenhum dano tecidual discernível. Embora essa porcentagem possa parecer baixa em relação a alguns outros tecidos, o procedimento de dissecção é rápido, e muitas pernas podem ser processadas em 30- 60 minutos. Portanto, mesmo que as taxas de sucesso sejam baixas inicialmente, é viável obter 4-5 boas amostras para cada grupo experimental. No entanto, uma limitação pode ser o número de moscas disponíveis a qualquer momento se genótipos e/ou idade resultar em letalidade substancial.
Outra limitação é que não conseguimos dissecar outras áreas da perna além da região proximal do fêmur devido ao tamanho. Assim, podemos estudar arbors MN identificados inervando o TILM de forma confiável e é possível dissecar cutícula acima do músculo depressor da tíbia com pequenas alterações na forma como a perna é orientada ao dissecar. No entanto, o acesso a outras regiões da perna tem se mostrado mais difícil sem interromper a arquitetura axonal durante a dissecção.
Aqui, apresentamos métodos de dissecção para detectar alterações no NMJ adulto para MNs definidas que inervam o tilm usando imunocitoquímica. A perna é útil como um sistema simples, inervado por apenas ~50 MNs e contendo 14 músculos com anatomia bem descrita. A preparação da perna dissecada pode ser usada através de genótipos e um conjunto de anticorpos estão disponíveis para visualização NMJ sem a necessidade de construir estoques genotipicamente complexos de construções genéticas de repórteres em fundos mutantes. Essa abordagem permitirá uma caracterização mais detalhada das alterações no NMJ para doenças de MN e outras condições relacionadas à idade.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Eric Roberts por conselhos sobre imagens. Também queremos agradecer aos Serviços de Tecnologia da Informação no Rhode Island College e, em particular, michael Caine e Jake Douglas pela videografia. Anticorpos monoclonais anti-dlg e anti-brp foram desenvolvidos pela UC-Berkeley e Universitaetsklinikim Wuerzburg, respectivamente, e foram obtidos do Banco Hybridoma de Estudos de Desenvolvimento, criado pelo NICHD do NIH e mantido na Universidade de Iowa, Departamento de Biologia, Iowa City, IA 52242, EUA. A pesquisa aqui relatada foi apoiada integralmente pela Rede de Excelência em Pesquisa Biomédica do Rhode Island (IDeA) Network of Biomedical Research Excellence do Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde sob o número de subvenção [P20GM103430].
Materials
| 10x Phosphate Buffered Saline | Fisher Scientific | BP3991 | |
| 24 well plates | Corning | 3473 | Hydrophobic, ultra-low attachment surface |
| 2x objective accessory | Olympus | 110AL2X | Screw-on attachment |
| Anti-ATP5A primary antibody | Abcam | ab14748 | Mouse monoclonal |
| Anti-bruchpilot primary antibody | Developmental Studies Hybridoma Bank | nc82 | Mouse monoclonal |
| Anti-discs large primary antibody | Developmental Studies Hybridoma Bank | 4F3 | Mouse monoclonal |
| Anti-hrp primary antibody | Jackson Immuno Research | 123-605-021 | Alexa Fluor 647 conjugated polyclonal |
| Anti-polyubiquitin (FK2) primary antibody | Millipore Sigma | 04-263 | Mouse monoclonal |
| Confocal Microscope | Olympus | FV1000 | Objectives (NA): 10x (0.4), 20x (0.85), 40x (1.20), 60x (1.42), 100x (1.40) |
| Coverslips | Corning | 285022 | 160-190 mm thickness |
| Dissecting forceps | Fine Science Tools | 11252-00 | Dumont #5SF |
| Dissecting Microscope | Olympus | SZ61 | |
| Formaldehyde | Fisher Scientific | BP531-500 | 37% stock stabilized with methanol |
| Goat anti-mouse secondary antibody | Jackson Immuno Research | 115-545-146 | Alexa Fluor 488 conjugated |
| Goat Serum | Novus Biologicals | NB036768 | 0.2 mm filtered |
| Laboratory sealing tape | Fisher Scientific | 03-448-254 | Parafilm M |
| Methanol | Fisher Scientific | A413 | |
| Microscope Slides | Fisher Scientific | 12-550-123 | 76mm x 25mm |
| Mounting media | Molecular Probes | S36972 | Slowfade Diamond mounting media |
| Nonionic surfactant | Acros Organics | 215680010 | Triton-X 100 |
| Nutator | Fisher Scientific | S06622 | |
| Phalloidin | Invitrogen | A34055 | Alexa Fluor 555- conjugated |
| Sharpening stone | Fine Science Tools | 29008-01 | |
| Silicone elastomer | Electron Microscopy Sciences | 2423610 | Sylgard 184 |
References
- McDermott, C. J., Shaw, P. J. Diagnosis and management of motor neurone disease. BMJ. 336 (7645), 658-662 (2008).
- Global Collaborators, G. B. D. M. N. D. Global, regional, and national burden of motor neuron diseases 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (12), 1083-1097 (2018).
- Foster, L. A., Salajegheh, M. K. Motor Neuron Disease: Pathophysiology, Diagnosis, and Management. American Journal of Medicine. 132 (1), 32-37 (2019).
- Bede, P., Pradat, P. F. Editorial: Biomarkers and Clinical Indicators in Motor Neuron Disease. Frontiers in Neurology. 10, 1318 (2019).
- Clark, J. A., Southam, K. A., Blizzard, C. A., King, A. E., Dickson, T. C. Axonal degeneration, distal collateral branching and neuromuscular junction architecture alterations occur prior to symptom onset in the SOD1(G93A) mouse model of amyotrophic lateral sclerosis. Journal of Chemical Neuroanatomy. 76, 35-47 (2016).
- Martineau, E., Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. Elife. 7, (2018).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Tremblay, E., Martineau, E., Robitaille, R. Opposite Synaptic Alterations at the Neuromuscular Junction in an ALS Mouse Model: When Motor Units Matter. Journal of Neuroscience. 37 (37), 8901-8918 (2017).
- Harris, K. P., Littleton, J. T. Transmission, Development, and Plasticity of Synapses. 유전학. 201 (2), 345-375 (2015).
- Beramendi, A., Peron, S., Casanova, G., Reggiani, C., Cantera, R. Neuromuscular junction in abdominal muscles of Drosophila melanogaster during adulthood and aging. Journal of Comparative Neurology. 501 (4), 498-508 (2007).
- Banerjee, S., et al. Miniature neurotransmission is required to maintain Drosophila synaptic structures during ageing. Nature Communications. 12 (1), 4399 (2021).
- Liao, S., Broughton, S., Nassel, D. R. Behavioral Senescence and Aging-Related Changes in Motor Neurons and Brain Neuromodulator Levels Are Ameliorated by Lifespan-Extending Reproductive Dormancy in Drosophila. Frontiers in Cellular Neuroscience. 11, 111 (2017).
- Mahoney, R. E., Rawson, J. M., Eaton, B. A. An age-dependent change in the set point of synaptic homeostasis. Journal of Neuroscience. 34 (6), 2111-2119 (2014).
- Fernandes, J. J., Keshishian, H. Development of the adult neuromuscular system. International Review of Neurobiology. 43, 221-239 (1999).
- Truman, J. W. Metamorphosis of the central nervous system of Drosophila. Journal of Neurobiology. 21 (7), 1072-1084 (1990).
- Baek, M., Mann, R. S. Lineage and birth date specify motor neuron targeting and dendritic architecture in adult Drosophila. Journal of Neuroscience. 29 (21), 6904-6916 (2009).
- Enriquez, J., et al. Specification of individual adult motor neuron morphologies by combinatorial transcription factor codes. Neuron. 86 (4), 955-970 (2015).
- Soler, C., Daczewska, M., Da Ponte, J. P., Dastugue, B., Jagla, K. Coordinated development of muscles and tendons of the Drosophila leg. Development. 131 (24), 6041-6051 (2004).
- Guan, W., Venkatasubramanian, L., Baek, M., Mann, R. S., Enriquez, J. Visualize Drosophila Leg Motor Neuron Axons Through the Adult Cuticle. Journal of Visualized Experiments. (140), e58365 (2018).
- Agudelo, A., et al. Age-dependent degeneration of an identified adult leg motor neuron in a Drosophila SOD1 model of ALS. Biology Open. 9 (10), (2020).
- Fernius, J., Starkenberg, A., Thor, S. Bar-coding neurodegeneration: identifying subcellular effects of human neurodegenerative disease proteins using Drosophila leg neurons. Disease Models & Mechanisms. 10 (8), 1027-1038 (2017).
- Sreedharan, J., Neukomm, L. J., Brown, R. H., Freeman, M. R. Age-Dependent TDP-43-Mediated Motor Neuron Degeneration Requires GSK3, hat-trick, and xmas-2. Current Biology. 25 (16), 2130-2136 (2015).
- Patel, N. H. Imaging neuronal subsets and other cell types in whole-mount Drosophila embryos and larvae using antibody probes. Methods in Cell Biology. 44, 445-487 (1994).
- Guirado, R., Carceller, H., Castillo-Gomez, E., Castren, E., Nacher, J. Automated analysis of images for molecular quantification in immunohistochemistry. Heliyon. 4 (6), 00669 (2018).
- Castells-Nobau, A., et al. Two Algorithms for High-throughput and Multi-parametric Quantification of Drosophila Neuromuscular Junction Morphology. Journal of Visualized Experiments. (123), e55395 (2017).
- Brown, J. R., Phongthachit, C., Sulkowski, M. J. Immunofluorescence and image analysis pipeline for Drosophila motor neurons. Biology Methods and Protocols. 4 (1), (2019).

