Visualización dinámica de microtúbulos plus-end en el modelo de la enfermedad de Huntington basado en fibroblastos primarios de piel humana
Summary
Este protocolo está dedicado a la visualización de microtúbulos plus-end mediante transfección de proteínas EB3 para estudiar sus propiedades dinámicas en cultivo celular primario. El protocolo se implementó en fibroblastos primarios de piel humana obtenidos de pacientes con enfermedad de Huntington.
Abstract
La transfección con una proteína marcadora de interés marcada fluorescentemente en combinación con videomicscopía de lapso de tiempo es un método clásico para estudiar las propiedades dinámicas del citoesqueleto. Este protocolo ofrece una técnica para la transfección de fibroblastos primarios humanos, que puede ser difícil debido a los detalles de las condiciones de cultivo de células primarias. Además, el mantenimiento de la propiedad dinámica del citoesqueleto requiere un bajo nivel de transfección para obtener una buena relación señal-ruido sin causar estabilización de microtúbulos. Es importante tomar medidas para proteger las células del estrés inducido por la luz y el desvanecimiento del tinte fluorescente. En el curso de nuestro trabajo, probamos diferentes métodos y protocolos de transfección, así como diferentes vectores para seleccionar la mejor combinación de condiciones adecuadas para estudios de fibroblastos primarios humanos. Analizamos los videos de lapso de tiempo resultantes y calculamos la dinámica de los microtúbulos utilizando ImageJ. La dinámica de los extremos positivos de los microtúbulos en las diferentes partes celulares no es similar, por lo que dividimos el análisis en subgrupos: la región del centrosoma, la lámina y la cola de los fibroblastos. En particular, este protocolo se puede utilizar para el análisis in vitro de la dinámica del citoesqueleto en muestras de pacientes, lo que permite el siguiente paso hacia la comprensión de la dinámica de los diversos desarrollos de la enfermedad.
Introduction
La enfermedad de Huntington (EH) es una patología neurodegenerativa incurable causada por un gen mutacionina que codifica la proteína cazadora (HTT). La HTT se asocia principalmente con vesículas y microtúbulos y probablemente esté involucrada en procesos de transporte dependientes de microtúbulos1,2. Para estudiar la influencia de la HTT mutante en la dinámica de los microtúbulos, utilizamos la visualización in vitro de la proteína EB3, que regula las propiedades dinámicas de los microtúbulos uniéndose y estabilizando los extremos superiores en crecimiento. Para cargar EB3 marcado fluorescentemente en fibroblastos de piel humana, se aplicó transfección por plásmido. Para este estudio se utilizó el cultivo primario de fibroblastos obtenido de la biopsia de piel de los pacientes con EH.
La mutación en el gen de la proteína HTT conduce a la elongación del tracto de la poliglutamina3. HTT tiene un papel en procesos celulares tales como endocitosis4,transporte celular1,2,degradación deproteínas 5,etc. Una parte sustancial de estos procesos involucra varios elementos del citoesqueleto celular, incluidos los microtúbulos.
Las células primarias humanas son el mejor modelo para reproducir los eventos que ocurren en las células de los pacientes lo más cerca posible. Para crear tales modelos, uno necesita aislar células de material de biopsia humana (por ejemplo, de muestras quirúrgicas). La línea celular primaria resultante es adecuada para estudiar la patogénesis utilizando varios métodos genéticos, bioquímicos, moleculares y de biología celular. Además, los cultivos celulares primarios humanos sirven como precursores para la creación de diversos cultivos transdiferenciados y transgénicos6.
Sin embargo, a diferencia de los cultivos celulares inmortalizados, la desventaja significativa de las células primarias es su limitada capacidad de paso. Por lo tanto, recomendamos el uso de células en la etapa de pasajes tempranos (hasta 15). Las culturas más antiguas degeneran muy rápidamente, perdiendo sus propiedades únicas. Por lo tanto, las células primarias recién obtenidas deben mantenerse congeladas para su almacenamiento a largo plazo.
Los cultivos celulares primarios son susceptibles a las condiciones de cultivo. Por lo tanto, a menudo requieren enfoques únicos y optimización de las condiciones de crecimiento. En particular, los fibroblastos primarios de la piel humana utilizados en nuestros experimentos son exigentes con el sustrato. Por lo tanto, utilizamos varios recubrimientos adicionales (por ejemplo, gelatina o fibronectina) dependiendo del tipo de experimento.
El citoesqueleto celular determina la forma celular, la movilidad y la locomoción. La dinámica del citoesqueleto es crucial para muchos procesos intracelulares tanto en interfase como en mitosis. En particular, el citoesqueleto polimerizado a partir de tubulina, son estructuras altamente dinámicas y polares, lo que permite el transporte intracelular dirigido mediado por proteínas motoras. Los extremos de los microtúbulos están en constante reordenamiento, sus fases de ensamblaje se alternan con las fases de desmontaje, y este comportamiento se denomina “inestabilidad dinámica”7,8,9. Varias proteínas asociadas cambian el equilibrio de la reacción de polimerización, lo que lleva a la formación de polímeros o a la formación de monómeros de proteínas. La adición de subunidades de tubulina ocurre principalmente en el extremo superior de los microtúbulos10. La familia de proteínas de unión al final (EB) consta de tres miembros: EB1, EB2 y EB3. Sirven como proteínas de seguimiento de extremos más (+TIP) y regulan las propiedades dinámicas de los microtúbulos uniéndose y estabilizando sus extremos superiores en crecimiento11.
Muchos estudios utilizan microinyección o transfección de tubulina marcada con moléculas fluorescentes con imágenes de lapso de tiempo y análisis de video para visualizar microtúbulos in vitro. Estos métodos pueden ser invasivos y dañinos para las células, especialmente las células humanas primarias. El paso más desafiante es encontrar las condiciones para la transfección celular. Intentamos alcanzar el nivel más alto posible de transfección sin afectar la viabilidad y la morfología celular nativa. Este estudio aplica el método clásico para estudiar las diferencias en la dinámica de los microtúbulos en fibroblastos de la piel de donantes sanos y pacientes con enfermedad de Huntington.
Protocol
Representative Results
Discussion
Se pueden obtener resultados de mejor calidad para el análisis dinámico de microtúbulos a partir de imágenes microscópicas de alta calidad. Es importante observar todas las condiciones necesarias para la obtención de imágenes de lapso de tiempo de las células vivas y ajustar correctamente los parámetros de la imagen. El uso de platos especiales de cultivo celular con un fondo de vidrio (platos confocales) es importante, ya que el vidrio tiene un índice de refracción de la luz diferente al plástico. El grosor …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue financiada por el Ministerio de Ciencia y Educación Superior de la Federación Rusa, subvención No. 075-15-2019-1669 (transfección de fibroblastos), por la Fundación Rusa de Ciencias, subvención No. 19-15-00425 (todos los demás trabajos sobre el cultivo de fibroblastos in vitro). Fue parcialmente apoyado por el programa de desarrollo de la Universidad Estatal de Moscú Lomonosov PNR5.13 (imágenes y análisis). Los autores reconocen el apoyo del Centro de Excelencia Nikon en el Instituto A. N. Belozersky de Biología Físico-Química. Queremos ofrecer nuestro agradecimiento especial a Ekaterina Taran por su ayuda con la actuación de voz. Los autores también agradecen a Pavel Belikov por su ayuda con la edición de video. Las figuras en el manuscrito fueron creadas con BioRender.com.
Materials
| Instrumentation | |||
| Camera iXon DU897 EMCCD | Andor Technology | ||
| Eppendorf Centrifuge 5804 R | Eppendorf Corporate | ||
| Fluorescence filter set HYQ FITC | Nikon | Alternative: Leica, Olympus, Zeiss | |
| LUNA-II Automated Cell Counte | Logos Biosystems | L40002 | |
| Microscope incubator for lifetime filming | Okolab | Temperature controller H301-T-UNIT-BL-PLUS | |
| Gas controller CO2-O2-UNIT-BL | |||
| Objective lens CFI Plan Apo Lambda 60x Oil 1.4 (WD 0.13) | Nikon | Alternative: Leica, Olympus, Zeiss | |
| Widefield fluorescence light microscope Eclipse Ti-E | Nikon | Alternative: Leica, Olympus, Zeiss | |
| Software | |||
| Fiji (Image J version 2.1.0/1.53c) | Open source image processing software | ||
| NIS Elements | Nikon | Alternative: Leica, Olympus, Zeiss | |
| Additional reagents | |||
| Mineral oil (Light white oil) | MP | 151694 | |
| Cell culture dish | |||
| Cell Culture Dish | SPL Lifesciences | 20035 | |
| Confocal Dish (glass thickness 170 µm) | SPL Lifesciences | 211350 | Alternative: MatTek |
| Conical Centrifuge tube | SPL Lifesciences | 50015 | |
| Cryogenic Vials | Corning-Costar | 430659 | |
| Microcentrifuge Tube | Nest | 615001 | |
| Cultivation | |||
| Lipofectamine 3000 Transfection Reagent | Thermo Fisher Scientific | L3000001 | |
| Dimethyl sulfoxide | PanEko | 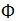 135 135 |
|
| DMEM (Dulbecco's Modified Eagle Media) | PanEko | C420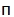 |
|
| DPBS (Dulbecco's phosphate-salt solution) | PanEko | P060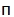 |
|
| Fetal bovine serum (FBS) | Hyclone | K053/SH30071.03 | |
| Gelatin (bovine skin) | PanEko | 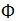 070 070 |
|
| GlutaMAX | Thermo Fisher Scientific | 35050038 | |
| Opti-MEM (1x) + Glutamax | Gibco | 519850026 | |
| Penicillin-streptomycin | PanEko | A063 |
|
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200072 | |
| Transfection | |||
| Plasmid DNA with EB3-GFP | Kind gift of Dr. I. Kaverina [Vanderbilt University, Nashville] with permission from Dr. A. Akhmanova [Erasmus University, Rotterdam] |
Stepanova et al., 2003 DOI: 10.1523/JNEUROSCI.23-07-02655.2003 |
References
- Engelender, S., et al. Huntingtin-associated Protein 1 (HAP1) Interacts with the p150 Glued Bubunit of Dynactin. Human Molecular Genetics. 6 (13), 2205-2212 (1997).
- Caviston, J. P., Ross, J. L., Antony, S. M., Tokito, M., Holzbaur, E. L. Huntingtin facilitates dynein/dynactin-mediated vesicle transport. Proceedings of the National Academy of Sciences. 104 (24), 10045-10050 (2007).
- MacMillan, J. C., et al. Molecular analysis and clinical correlations of the Huntington’s disease mutation. The Lancet. 342 (8877), 954-958 (1993).
- Proskura, A. L., Vechkapova, S. O., Zapara, T. A., Ratushniak, A. S. Protein-protein interactions of huntingtin in the hippocampus. Molecular Biology. 51 (4), 647-653 (2017).
- Steffan, J. S., et al. The Huntington’s disease protein interacts with p53 and CREB-binding protein and represses transcription. Proceedings of the National Academy of Sciences. 97 (12), 6763-6768 (2000).
- Nekrasov, E. D., et al. Manifestation of Huntington’s disease pathology in human induced pluripotent stem cell-derived neurons. Molecular Neurodegeneration. 11 (1), 1-15 (2016).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Walker, R. A., et al. Dynamic instability of individual microtubules analyzed by video light microscopy: rate constants and transition frequencies. The Journal of Cell Biology. 107 (4), 1437-1448 (1988).
- Desai, A., Mitchison, T. J. Microtubule polymerization dynamics. Annual Review of Cell and Developmental Biology. 13 (1), 83-117 (1997).
- Allen, C., Borisy, G. G. Structural polarity and directional growth of microtubules of Chlamydomonas flagella. Journal of Molecular Biology. 90 (2), 381-402 (1974).
- Stepanova, T., et al. Visualization of microtubule growth in cultured neurons via the use of EB3-GFP (end-binding protein 3-green fluorescent protein). Journal of Neuroscience. 23 (7), 2655-2664 (2003).
- Shelden, E., Wadsworth, P. Observation and quantification of individual microtubule behavior in vivo: microtubule dynamics are cell-type specific. Journal of Cell Biology. 120 (4), 935-945 (1993).
- O’Brien, E. T., Salmon, E. D., Walker, R. A., Erickson, H. P. Effects of magnesium on the dynamic instability of individual microtubules. 생화학. 29 (28), 6648-6656 (1990).
- Drechsel, D. N., Hyman, A. A., Cobb, M. H., Kirschner, M. W. Modulation of the dynamic instability of tubulin assembly by the microtubule-associated protein tau. Molecular Biology of the Cell. 3 (10), 1141-1154 (1992).
- Gildersleeve, R. F., Cross, A. R., Cullen, K. E., Fagen, A. P., Williams, R. C. Microtubules grow and shorten at intrinsically variable rates. Journal of Biological Chemistry. 267 (12), 7995-8006 (1992).
- Penazzi, L., Bakota, L., Brandt, R. Microtubule dynamics in neuronal development, plasticity, and neurodegeneration. International Review of Cell and Molecular Biology. 321, 89-169 (2016).
- van de Willige, D., Hoogenraad, C. C., Akhmanova, A. Microtubule plus-end tracking proteins in neuronal development. Cellular and Molecular Life Sciences. 73 (10), 2053-2077 (2016).
- Applegate, K. T., et al. plusTipTracker: Quantitative image analysis software for the measurement of microtubule dynamics. Journal of Structural Biology. 176 (2), 168-184 (2011).
- Komarova, Y. A., Vorobjev, I. A., Borisy, G. G. Life cycle of MTs: persistent growth in the cell interior, asymmetric transition frequencies and effects of the cell boundary. Journal of Cell Science. 115 (17), 3527-3539 (2002).
- Nahidiazar, L., Agronskaia, A. V., Broertjes, J., vanden Broek, B., Jalink, K. Optimizing imaging conditions for demanding multi-color super resolution localization microscopy. PLoS One. 11 (7), 0158884 (2016).
- Dixit, R., Cyr, R. Cell damage and reactive oxygen species production induced by fluorescence microscopy: effect on mitosis and guidelines for non-invasive fluorescence microscopy. The Plant Journal. 36 (2), 280-290 (2003).
- Grzelak, A., Rychlik, B., Bartosz, G. Light-dependent generation of reactive oxygen species in cell culture media. Free Radical Biology and Medicine. 30 (12), 1418-1425 (2001).

